Астраханская пятнистая лихорадка (АПЛ)– острое трансмиссивное природно-очаговое заболевание риккетсиозной этиологии, которое начали регистрировать на территории Астраханского региона с конца 70-х гг. прошлого столетия. Первоначально предполагалась вирусная природа заболевания, однако неэффективность противовирусной терапии и дальнейшая генетическая расшифровка заболевания в Институте эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН (Москва) окончательно идентифицировали заболевание как Астраханскую пятнистую лихорадку1, вызываемую риккетсией conori, подвидом caspiensis [1–3]. В прошлом столетии заболевание регистрировалось в административных районах Астраханской области, территориально расположенных вблизи Астраханского газоперерабатывающего комплекса, что позволило рассматривать очаг АПЛ как антропургический. В настоящее время география АПЛ и ареал переносчика – клеща R. pumilio значительно расширились, заболевание регистрируется во всех районах области. Ежегодно остается стабильно высоким и имеет тенденцию к росту индекс обилия клещей [4]. В настоящее время пораженными переносчиком являются не только дикие, но и домашние животные, крупный и мелкий рогатый скот, что создает предпосылки для распространения заболевания и повышения заболеваемости АПЛ. Кроме того, благодаря туризму и активному отдыху в низовьях Волги АПЛ регистрируют и на других территориях Российской Федерации [5].
Изменилась и клиническая симптоматика АПЛ: отмечаются осложнения и летальные исходы. Если ранее в клинической картине тяжелого течения АПЛ преобладал нейротоксикоз, то теперь тяжесть заболевание характеризуется формированием острой почечной недостаточности (ОПН) с развитием тяжелого интоксикационного синдрома и вторичными сосудистыми изменениями [6, 7].
Следует отметить, что госпитализация больных с тяжелой формой запаздывает и осуществляется в среднем на 3–4-й день болезни [8, 9]. При госпитализации никаких клинико-лабораторных маркеров, свидетельствующих о начале патогенетического процесса в почках, в это время еще не обнаруживают, креатинин и мочевина остаются в пределах нормальных значений или на верхних границах нормы.
Спустя 2–3 дня после госпитализации у больных с тяжелым течением АПЛ манифестируют первые признаки ОПН, возникают олигурия, гипостенурия, которые в дальнейшем нарастают и могут явиться причиной летального исхода [10].
В связи с этим актуальным и практически значимым стал поиск ранних, диагностически чувствительных и прогностических маркеров ОПН у больных АПЛ. Анализ отечественных и зарубежных литературных источников позволил обратить наше внимание на нейтрофильный желатинозно-ассоциированный липокалин (NGAL), который секретируется в плазму крови из активированных нейтрофилов, а также нефроцитами при их повреждении [11, 12].
Цель исследования – оценка диагностической и прогностической значимости определения NGAL у больных АПЛ.
Материалы и методы
Исследование было проведено на кафедре инфекционных болезней и эпидемиологии Аcтраханского государственного медицинского университета Минздрава России и одобрено этическим комитетом (протокол № 2 от 18.03.2014). В работе с больными соблюдались этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации (1964, 2000 гг.). От всех пациентов было получено добровольное информированное согласие на проведение исследования.
Концентрацию липокалина в плазме 49 больных АПЛ определяли с помощью набора Hbthuman NGAL ELISA (США) «сэндвич»-методом твердофазного ИФА. Время анализа составило 3,5 ч. Образцы и стандарты были инкубированы в лунках микропланшета, покрытых антителами к человеческому NGAL. Концентрацию липокалина в образцах с неизвестным содержанием определяли по калибровочной кривой. В группу контроля были отобраны образцы плазмы здоровых добровольцев, информация об уровне липокалина которых значилась в инструкции по применению диагностического набора.
Статистическую обработку результатов осуществляли методами параметрической статистики. Для определения средних величин (М), стандартных отклонений (m) и достоверности групповых различий для совокупностей, подчиняющихся нормальному распределению, использовали t-критерий Стьюдента. Различия считались достоверными при р < 0,05. Для сравнения частоты встречаемости признаков в группах сравнения применяли программы статистической обработки STATISTIСA Trial 13 и IBM SPSS Statistics 26.0 (США). Переменные факторы проанализированы с помощью скорректированного 95% доверительного интервала (ДИ).
Результаты
Под наблюдением находились 49 больных АПЛ, получавших стационарное лечение в Областной инфекционной клинической больнице им. А.М. Ничоги (Астрахань). 44 (89,7%) пациента были старше 60 лет (95% ДИ 0,84–0,94). Средний возраст больных составил 66,7 ± 5,9 года (95% ДИ 54,9–78,5).
63% заболевших были сельскими жителям (95% ДИ 0,52–0,74), имели контакт с домашними животными и работали на приусадебных участках. Присасывание клеща отмечали 23 (46,9%) больных, контакт с клещами – 8 (16,3%). Инкубационный период при АПЛ колебался от нескольких дней до месяца. Первым признаком болезни являлся первичный аффект на месте присасывания клеща.
Чаще всего он локализовался на нижних конечностях и туловище (15 чел.), реже – на верхних конечностях (4) и голове/шее (2).
Клиническая картина АПЛ характеризовалась типичными симптомами. При тяжелой форме болезни они были максимально выражены и отмечались уже при госпитализации пациентов. У всех больных наблюдалась лихорадка: от 39,1 до 40°С – у 32 (64,8%) пациентов (95% ДИ 0,53–0,75), от 40 до 41°С – у 8 (16,3%) больных (95% ДИ 0,09–0,23). Средняя продолжительность лихорадки у больных тяжелой формой АПЛ составила 9,8 ± 2,2 дня (95% ДИ 5,4–9,2).
Сыпь появлялась на 2–5-й дни болезни. У тяжелых больных в разгаре заболевания она нередко становилась геморрагической и исчезала с образованием пигментации на 8–9-й день болезни.
Уже при госпитализации наблюдались симптомы интоксикации. У всех больных были выраженная слабость, головная боль, снижение аппетита, нарушение сна. Мышечные боли, особенно в икроножных мышцах, отмечены у 42 (82%) пациентов (95% ДИ 0,77–0,87). У ряда больных из-за сильных болей в мышцах нижних конечностей появлялась специфическая походка на полусогнутых ногах – «обезьянья». Артралгии были у 42 (82,8%) больных (95% ДИ 0,71–0,93), тошнота – у 33 (67,0%; 95% ДИ 0,56–0,78), рвота – у 25 (51,0%; 95% ДИ 0,38–0,64), диарея – у 9 (18,36%; 95% ДИ 0,07–0,29). У 39 (79,5%) обследуемых (95% ДИ 0,64–0,86) был выражен склероконъюнктивит. Начальный период продолжался в среднем 4 ± 1,2 дня.
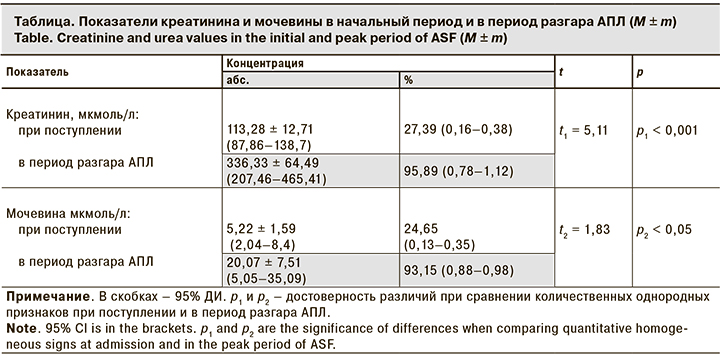
Уровни креатинина и мочевины в начальном периоде заболевания у всех больных не отражали специфики происходящих изменений и повышались только в период разгара заболевания (см. таблицу), в то время как концентрация липокалина плазмы уже на начальном этапе заболевания была повышена у всех больных. Наиболее высокие значения отмечали при среднетяжелом и тяжелом течении АПЛ. При сравнении средних показателей концентрации липокалина у больных с тяжелым и среднетяжелым течением АПЛ с показателями NGAL условно здоровых лиц разница оказалась статистически значимой: 511,27 ± 146 нг/ мл против 78,89 ± 24,2 (t1 = 2,92; p1 < 0,01) и 173,95 ± 40,19 нг/мл против 78,89 ± 24,2 соответственно (t2 = 2,03; p2 < 0,05).
Многолетнее наблюдение за больными АПЛ позволило сделать вывод о том, что не всегда интенсивность интоксикационного синдрома, наличие яркой экзантемы и гиперергическая лихорадка при поступлении в стационар являются маркерами тяжелого течения и появления осложнений в дальнейшем.
У ряда пациентов на фоне этиопатогенетической терапии и дезинтоксикационных мероприятий уже в период разгара происходило заметное улучшение клинической симптоматики, у остальных, напротив, симптомы заболевания нарастали и приводили к формированию различного рода осложнений, среди которых чаще всего регистрируют ОПН.
Обсуждение
В последние годы отмечается утяжеление клинической симптоматики АПЛ. Среди осложнений у больных с тяжелым и среднетяжелым течением доминируют симптомы поражения почек и сосудов. В настоящее время нет специфических тестов и патогномоничных симптомов АПЛ, позволяющих на ранних стадиях заболевания прогнозировать развитие ОПН при АПЛ. Выраженность интоксикационного синдрома, экзантемы и гиперергическая лихорадка в начале заболевания сами по себе не являются специфичными клиническими маркерами, позволяющими прогнозировать дальнейшее тяжелое течение АПЛ и возникновение осложнений.
Поскольку в современном течении АПЛ прослеживается тенденция к утяжелению симптомов с преимущественным поражением сосудистого звена и органов мочевыделительной системы, в реальной клинической практике актуальным становится поиск маркеров повреждения паренхимы почек, диагностическая чувствительность которых могла бы позволить на ранних этапах заболевания спрогнозировать развитие ОПН. В литературных источниках изложены результаты проведенных ранее исследований по поиску таких маркеров у больных геморрагической лихорадкой с почечным синдромом (ГЛПС). Исследование, проведенное нашими коллегами из Республики Башкортостан [11], позволило сделать вывод о том, что уже в лихорадочный период уровень специфических белков, продуцируемых почками и связанных с развитием ОПН, таких как липокалин, у больных ГЛПС повышается в 30–96 раз по сравнению с группой контроля, постепенно снижаясь в дальнейшем. При этом уровни креатинина и мочевины долгое время могут оставаться в пределах референсных значений, значимо повышаясь только на олигоурической стадии.
Отдельные зарубежные исследования продемонстрировали значимость определения липокалина у больных с лихорадкой Денге, что может быть связано с участием белка в формировании иммунного ответа при арбовирусной инфекции. Было высказано предположение, что липокалин совместно с эластазой-2 и лактоферрином играют определенную роль в противолихорадочном иммунном ответе в гипертермическую фазу [12]. По-видимому, этим обстоятельством можно объяснить повышение уровня липокалина с первых дней заболевания у пациентов с АПЛ, зависящее от уровня и длительности гиперергической лихорадки.
По результатам нашего исследования при АПЛ уровни мочевины и креатинина у пациентов с тяжелым и среднетяжелым течением в начальный период заболевания оставались в пределах референсных значений и только в разгар заболевания статистически значимо повышались – p1 < 0,001 для креатинина и р2 < 0,05 для мочевины. В то же время оказалось, что уровень липокалина изменялся с первых дней заболевания и в дальнейшем нарастал в соответствии с тяжестью заболевания.
Таким образом, использование современных биохимических маркеров почечной патологии при АПЛ, таких как определение концентрации липокалина, наряду с традиционными показателями, позволяет более дифференцированно подходить к оценке развития ранней патологии почечных структур, прогностически выделять пациентов, входящих в группу риска по развитию ОПН, и своевременно моделировать медикаментозное лечение.
Результаты проведенного исследования демонстрируют диагностическую ценность определения уровня липокалина плазмы как информативного раннего маркера для подтверждения развития и определения степени тяжести ОПН при АПЛ. Клинические проявления АПЛ в начале болезни не позволяют точно прогнозировать дальнейшее нарастание степени ее тяжести и развития осложнений, в том числе со стороны мочевыделительной системы. Уровни маркеров нарушения клубочковой фильтрации (сывороточный креатинин, мочевина) при АПЛ достигают максимальных значений только в разгар заболевания, при уже появившихся первых клинических симптомах ОПН, что не позволяет отнести их к ранним диагностическим и прогностическим признакам острого повреждения почек. В связи этим считаем перспективным изучение уровня липокалина плазмы у больных АПЛ с клинической картиной среднетяжелого и тяжелого течения заболевания при поступлении в стационар для прогнозирования дальнейшей динамики клинических симптомов и развития осложнений.
Выводы
1. В современных условиях прослеживается тенденция к утяжелению симптомов АПЛ.
2. Наиболее часто у пациентов со среднетяжелым и тяжелым течением АПЛ наблюдаются поражения сосудистого звена и почек.
3. Уровни креатинина и мочевины как показателей клубочковой фильтрации в начальный период АПЛне меняются в начальный период АПЛ.
4. В качестве диагностически чувствительного маркера поражения почек при АПЛ предлагается исследовать уровень липокалина – специфического белка, продуцируемого почками, который статистически значимо повышается у больных со среднетяжелым и тяжелым течением уже в начальный период заболевания, что позволяет дифференцировать степень тяжести заболевания, прогнозировать осложнения и своевременно корректировать лечение.


