В Российской Федерации на протяжении последних 20 лет заболеваемость бактериальными гнойными менингитами (БГМ) носит спорадический характер, составляя в среднем 2,6 на 100 тыс. населения (2013), однако учитывая, что у нас в стране обязательной регистрации подлежат только случаи менингококковой инфекции и первичных БГМ, можно предположить, что ее реальный уровень значительно выше [1–3]. Дети, особенно первых лет жизни, являются основной группой риска по развитию БГМ и формированию грубого психо-неврологического дефицита в исходе, заболеваемость среди детей и подростков по стране составляет 6–8 случаев на 100 тыс.
Одной из наиболее частых этиологических причин БГМ у детей является Haemophilus influenzae типа b (Hib). Заболеваемость гемофильными менингитами (ГМ) в различных регионах мира чрезвычайно вариабельна – от 0,5 до 143 на 100 тыс. детского населения младше 5 лет [1, 4, 5] – и зависит от наличия или отсутствия в национальных календарях вакцинации от гемофильной инфекции. Достоверно оценить уровень заболеваемости ГМ в Российской Федерации к настоящему моменту крайне сложно, учитывая низкую этиологическую расшифровку БГМ, не превышающую в целом по стране 40%, и тот факт, что обязательная регистрация введена лишь в отдельных регионах [1, 3]. Одним из таких регионов является Санкт-Петербург, в котором регистрация генерализованных форм гемофильной инфекции, в том числе менингитов, проводится с 2006 г. В Санкт-Петербурге, как и в большинстве других регионов России, от гемофильной инфекции планово прививаются только дети групп риска с иммунодефицитными состояниями и находящиеся в закрытых коллективах (психо-неврологические дома ребенка) [6]. Во всех остальных случаях вакцинация носит спорадический характер и осуществляется преимущественно по инициативе и за счет средств родителей. При существующем положении дел заболеваемость ГМ в Санкт-Петербурге на 2014 г. среди детей до 14 лет составила 1,6 (в группе до 5 лет – 2,6) на 100 тыс. детей соответствующего возраста при показателях общей заболеваемости в городе 0,14 на 100 тыс. населения.
Относительная редкость заболевания в настоящее время не исключает роста ее в ближайшие годы, так как для гемофильной инфекции характерны подъемы заболеваемости каждые 8–10 лет. Тяжесть патологии, риск развития критических, угрожающих жизни состояний при ГМ у детей обусловливают необходимость мониторирования эпидемической ситуации, совершенствования диагностики и терапии.
Целью нашей работой явилось изучение современных клинико-эпидемиологических особенностей ГМ у детей в Санкт-Петербурге, учитывая, что в клинику НИИ детских инфекций Федерального медико-биологического агентства России (далее – НИИДИ) госпитализируется подавляющее большинство пациентов с подозрением на инфекционные заболевания нервной системы, проживающих в Санкт-Петербурге и Ленинградской области.
Материалы и методы
 Нами проанализированы истории болезней 73 пациентов с верифицированным диагнозом ГМ, лечившихся в НИИДИ с 2007 по 2014 г. включительно. Всем детям ежедневно проводили клинико-неврологический осмотр; консультацию офтальмолога (при поступлении и повторно при необходимости), ЛОРа; нейросонографию при поступлении и в динамике заболевания; исследование акустических стволовых вызванных потенциалов на первой неделе от момента поступления; ЭЭГ на 7–14-й день болезни (при судорогах в дебюте – чаще). В 11 (18,9%) случаях для исключения интракраниальных осложнений менингита проводили компьютерную томографию головного мозга с контрастным усилением.
Нами проанализированы истории болезней 73 пациентов с верифицированным диагнозом ГМ, лечившихся в НИИДИ с 2007 по 2014 г. включительно. Всем детям ежедневно проводили клинико-неврологический осмотр; консультацию офтальмолога (при поступлении и повторно при необходимости), ЛОРа; нейросонографию при поступлении и в динамике заболевания; исследование акустических стволовых вызванных потенциалов на первой неделе от момента поступления; ЭЭГ на 7–14-й день болезни (при судорогах в дебюте – чаще). В 11 (18,9%) случаях для исключения интракраниальных осложнений менингита проводили компьютерную томографию головного мозга с контрастным усилением.
Диагноз БГМ основывался на клинико-лабораторных данных: проявлениях синдрома системной воспалительной реакции, наличии менингеального симптомокомплекса в сочетании с нейтрофильным плеоцитозом в цереброспинальной жидкости (ЦСЖ). Этиологию устанавливали при высеве Hib из крови или/и ЦСЖ, при обнаружении антигена возбудителя в реакции агглютинации латекса в ЦСЖ либо при выявлении ДНК Нib методом ПЦР в крови и/или ЦСЖ.
Статистическую обработку проводили с использованием пакета программ Microsoft office (Excel), Statistica 6,0.
Результаты и обсуждение
За рассматриваемый период случаи ГМ составили 23,6% от общего числа БГМ (n = 352). Под нашим наблюдением находились 73 пациента в возрасте от 3 мес. до 6 лет. Из них дети от 1 до 3 лет составляли 50,7%, до 1 года – 24,6%, 3–5 лет – 23,3%, старше 5 лет – 1,4%. Средний возраст больных равнялся 23,6 ± 4,1 мес. Соотношение мальчиков и девочек – 1,25:1,00.
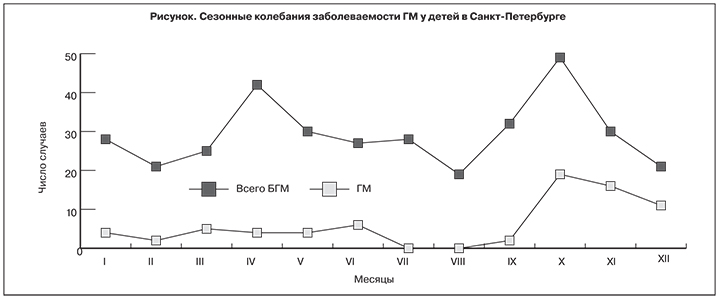
Анализ помесячной заболеваемости выявил относительное увеличение случаев ГМ в осеннее-зимний период, что, вероятно, объясняется сезонным ростом простудных заболеваний (см. рисунок).
Большинство (62%) больных поступали из дома, остальные были переведены из других стационаров Санкт-Петербурга и Ленинградской области. В 1-е сутки от начала заболевания госпитализированы лишь 16,4% больных, на 2-е сутки попадали в стационар 57,5%, на поздних сроках (3–5-е сутки от дебюта болезни) – 30%.
Изучение факторов, предшествующих заболеванию, показало, что более половины детей за 1–3 недели до госпитализации переносили ОРИ, 10 (13,8%) пациентов лечились по поводу катарального среднего отита. В раннем анамнезе у 34,5% больных было отмечено осложненное течение перинатального и натального периодов. Аллергические проявления различной степени тяжести были выявлены у 16,4% больных. Один ребенок за 10 мес. до развития менингита перенес оперативное вмешательство – кохлеарную имплантацию по поводу врожденной сенсоневральной тугоухости, еще у одного был выявлен порок развития лабиринта (аномалия Мондини). Сочетание различных неблагоприятных факторов отмечалось у 17 (23,2%) детей. В 37 (50,6%) случаях заболевание развивалось в первые полгода от начала посещения ребенком детского дошкольного учреждения.
Начало менингита в 76,7% случаев было острым с нарастанием симптоматики в течение 24–36 ч. В 23,3% случаев отмечалось подострое развитие заболевания (в течение 2–3 суток). У большинства пациентов менингит развивался на фоне течения ОРИ: на 5–7-й день от начала катаральных явлений происходило повторное повышение температуры тела до фебрильных цифр, постепенное нарастание общемозговой и менингеальной симптоматики.
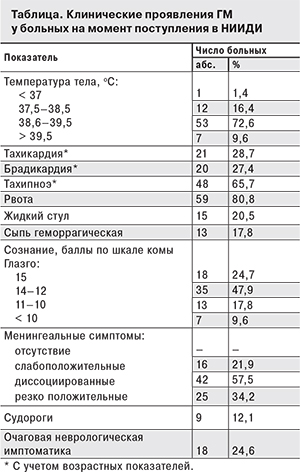
При остром дебюте, как правило, заболевание начиналось во второй половине дня с резкого подъема температуры, появления вялости, отказа от еды. У младенцев отмечалось немотивированное беспокойство, сменяющееся резкой вялостью и сонливостью. Дети отказывались от еды, при попытках кормления возникали обильные срыгивания, рвота фонтаном. В 20,5% случаев у детей в возрасте до 1 года учащались дефекации без наличия патологических примесей в стуле. Дети старше 3 лет жаловались на интенсивную головную боль, демонстрировали проявления гиперестезии. Температура тела к концу первых суток от начала менингита в среднем составила 39,4 оС. Прием антипиретиков плохо купировал лихорадку.
Наличие элементов геморрагической сыпи на теле отмечалось у 13 (17,8%) больных, у 9 (12,3%) из них сыпь была необильной, единичные элементы локализовались преимущественно на ногах и нижней части туловища. У 4 детей наблюдалась обильная распространенная геморрагическая сыпь на туловище и конечностях, мало отличимая от таковой при менингококкемии.
Более чем в 1/4 случаев у больных выявлялась брадикардия в сочетании с повышенным артериальным давлением и брадипноэ (триада Кушинга), что свидетельствовало о развитии острого ГМ с вовлечением стволовых структур. У 28,7% больных при поступлении отмечалась тахикардия на фоне гипертермии при отсутствии гемодинамических нарушений.
Выраженность менингеальных симптомов разнилась в зависимости от сроков заболевания к моменту поступления в стационар и возраста ребенка. В 19,2% случаев при поступлении в ранние сроки менингеальные симптомы были слабоположительными. У большинства (57,5%) больных имела место диссоциация менингеальных симптомов, чаще всего – отсутствие симптомов Кернига при резко положительной ригидности мышц затылка. Лишь у 30,1% больных при поступлении были ярко выражены все «классические» менингеальные симптомы.
У 9 (12,3%) пациентов на пике температуры развились судороги. У 4 (5,4%) детей они носили генерализованный характер и быстро купировались после снижения температуры тела и введения диазепама. У 5 (6,5%) детей развился судорожный статус на фоне нарастающего отека головного мозга.
Очаговая неврологическая симптоматика разной степени выраженности, проявляющаяся недостаточностью черепных нервов и/или парезами, отмечена у 24,6% больных ГМ. Выраженность и частота клинических проявлений синдромов при поступлении в стационар больных ГМ представлены в таблице.
Анализ направительных диагнозов показал, что первоначально БГМ был заподозрен у 40 (54,7%) больных, ОРИ – у 20 (27,3%), ОКИ – у 10 (13,6%), менингококковая инфекция – у 3 (3,9%). По тяжести состояния 57 (78,0%) пациентов были госпитализированы в отделение реанимации и интенсивной терапии, 11 (18,9%) из них потребовалась искусственная вентиляция легких.
Тяжесть состояния при поступлении в НИИДИ у 37 (50,6%) пациентов была обусловлена отеком головного мозга, у 2 (2,6%) – септическим шоком с развитием синдрома полиорганной недостаточности.
Этиологическое обследование проводили всем больным незамедлительно с момента поступления в НИИДИ. У большинства больных исследование крови осуществляли до введения антибиотика, в 45% случаев забору биологического материала предшествовало введение или пероральный прием антибиотиков на догоспитальном этапе. Сразу после поступления брали пробы крови на посев и для исследования методом ПЦР. Исследование ЦСЖ до введения антибиотиков проведено лишь у 9,5% больных, у 30,1% исследование проводили через 1–4 ч после первого введения антибиотика (как правило, цефтриаксона или цефотаксима). У остальных люмбальная пункция была отсрочена в связи с рисками развития интра- и экстракраниальных осложнений, ее проводили через 1–2 суток на фоне антибактериальной терапии.
Выделить культуру Hib из крови и/или ЦСЖ удалось у 32 (43,8%) больных. В подавляющем большинстве (87,5%) случаев Hib относилась к 1-му биовару, в единичных случаях – к 4-му (6,2%) и 2-му (3,2%) биоварам. Все исследуемые культуры были лишены β-лактамазной (цефеназной) активности. В 56,2% случаев этиологическая расшифровка менингита основывалась на результатах ПЦР и РЛА.
При рутинном лабораторном обследовании при поступлении лейкоцитоз наблюдали у 40 (58,9%) детей, лейкопению и нормоцитоз – с одинаковой частотой (n = 15; 20,5%). У 1/3 больных, вне зависимости от уровня лейкоцитов при поступлении в стационар, на 3–4-е сутки от начала терапии на фоне клинического улучшения состояния и купирования лихорадки отмечали нарастание лейкоцитоза до 30–40 х109/л. Постепенное снижение числа лейкоцитов в гемограмме происходило в течение последующих 1–3 суток, не требуя какой-либо медикаментозной коррекции. Снижение уровня гемоглобина ниже 100 г/л наблюдали в 77,5% случаев, тромбоцитопению – в 20,7% случаев, средний показатель СОЭ составил 17,5 мм/ч. Уровень прокальцитонина, определяемый полуколичественным методом, у всех больных был выше 2 пг/мл, а у 38 (52,0%) пациентов превышал 10 пг/мл. СРБ также превышал норму у всех больных, колеблясь от 92 до 180 мг/л.
В ЦСЖ у всех больных был выявлен нейтрофильный плеоцитоз (7208 ± 2786 х 106/л), уровень белка колебался от 0,6 до 4,6 (2,27 ± 1,4) г/л, глюкозы – от 1,8 до 2,9 (2,02 ± 0,6) ммоль/л.
Расширение желудочковой системы в острый период ГМ диагностировали в 38 (52%) случаях, однако в процессе выздоровления на фоне терапии у большинства пациентов происходила нормализация размеров ликворосодержащих структур.
Анализ интракраниальных осложнений острого периода менингитов показал, что наиболее частым (n = 11; 15,0%) осложнением являлся субдуральный выпот (СДВ). При динамическом НСГ-исследовании возникновение СДВ наблюдали на 4–7-й день от начала менингита; у 6 детей отмечали двусторонний СДВ, у 5 – односторонний.
Клинические проявления СДВ были у 8 из 11 детей: длительно сохранялся субфебрилитет с периодическими фебрильными «свечками», преимущественно в вечернее время. В неврологическом статусе у большинства больных с СДВ отмечалась негрубая анизорефлексия и асимметрия мышечного тонуса. В 10 из 11 случаев СДВ велись консервативно и разрешались на фоне адекватной антибактериальной терапии. У 1 ребенка проведено наружное дренирование СДВ в связи значительными его размерами и угрозой дислокации церебральных структур. Еще у 1 ребенка субдуральная эмпиема потребовала нейрохирургического вмешательства.
Развитие острой сенсоневральной тугоухости диагностировали у 5 (6,8%) больных на 1-й неделе пребывания в стационаре при исследовании акустических стволовых вызванных потенциалов. У 4 детей поражение было двусторонним, у 1 ребенка – односторонним.
Всем больным проводили комплексную этиопатогенетическую терапию. В качестве стартовой антибактериальной терапии применяли цефалоспорины 3-го поколения в «менингитных» дозах, на ее фоне у большинства больных к 7–10-му дню отмечали санацию ЦСЖ. В качестве патогенетической терапии в первые 2–4 суток применяли дексазон в суточной дозе 0,6 мг/кг, дегидратирующие средства (по показаниям – маннитол, диакарб, фуросемид), препараты антиокидантного, ноотропного действия (цитофлавин, пантогам, актовегин и др.). По показаниям проводили симптоматическую терапию (антипиретики, антиконвульсанты).
На фоне терапии летальных случаев, вызванных ГМ, за последние 8 лет не было, полное выздоровление наступило у 53,4% детей. Катамнестическое наблюдение за реконвалесцентами показало, что в исходе перенесенного ГМ в 4,1% случаев формировалась симптоматическая эпилепсия, в 3,1% – сенсоневральная тугоухость (двусторонняя, III–IV степени), в 8,2% – компенсированная сообщающаяся гидроцефалия. У 17,8% детей были отмечены различные проявления энцефалопатии, у 26% – двигательные нарушения в виде длительно (до 6 мес.) сохраняющейся лобно-мозжечковой атаксии разной степени выраженности.
Проведенное исследование показало, что ГМ на современном этапе продолжают оставаться одной из наиболее тяжелых форм БГМ. Тяжесть течения заболевания определяется как биологическими, так и социальными факторами. К биологическим факторам, определяющим частоту осложненного течения ГМ, следует отнести возрастные анатомо-физиологические особенности (несовершенство иммунной системы, гидрофильность мозга, особенность церебрального кровотока, отсутствие пахионовых грануляций у детей раннего возраста) и наличие сопутствующей патологии. Как показало наше исследование, осложненный преморбидный фон был выявлен у подавляющего числа пациентов. Факторами, способствующими развитию ГМ, являлись перенесенные ОРИ и наличие ЛОР-патологии. Тот факт, что большая часть наблюдаемых нами детей заболевала в первые месяцы от начала посещения детских дошкольных учреждениий, вероятно, обусловлен не только встречей с «новой» микробной флорой, но и со стрессом при смене привычной для ребенка обстановки, оказывающим депрессивное влияние на иммунные реакции.
Позднее обращение за медицинской помощью и недооценка состояния больного на догоспитальном этапе – факторы, во многом определяющие тяжесть течения и исходы ГМ.
Преобладанием среди больных ГМ детей раннего возраста с отсутствием у младенцев характерных менингеальных симптомов отчасти можно объяснить причину поздней госпитализации в стационар в 30% случаев. К сожалению, даже наличие у пациентов стойкой фебрильной лихорадки и общемозговой симптоматики часто расценивалось как ОРИ, а учащение дефекаций на этом фоне – как ОКИ. Недооценка состояния и поздняя госпитализация уменьшали эффективность проводимых терапевтических мероприятий, резко увеличивая риск развития осложнений.
Исход ГМ, как и других бактериальных менингитов, зависит от своевременности диагностики и адекватности проводимой терапии. Для предотвращения диагностических ошибок необходимо сохранять постоянную настороженность в отношении рисков развития БГМ, особенно у детей раннего возраста, и при подозрении на БГМ немедленно госпитализировать пациента в профильный стационар.
Несомненно, что несмотря на успехи медицинских технологий, мы не можем влиять на все факторы, способные полностью предотвратить развитие осложнений при при БГМ у детей, однако в настоящее время мы можем предотвратить заболевание ГМ как таковое путем включения в национальный календарь прививок обязательную вакцинацию от гемофильной инфекции или, по крайней мере, значительно расширить группы риска.


