Инфекция, вызванная SARS-CoV-2, является серьезным вызовом для здравоохранения всего мира. Продолжающаяся пандемия COVID-19 уже на ранних этапах была названа чрезвычайной ситуацией в области общественного здравоохранения, имеющей международное значение [1]. Она является самой крупной в новейшей истории человечества [2]: на 12.01.2021 зафиксировано около 91 млн случаев инфекции и около 2 млн летальных исходов [3]. Распространение SARS-CoV-2 явилось поистине глобальным – в настоящее время в мире отсутствуют территории, на которых не зарегистрировано случаев COVID-19.
На ранних этапах пандемии было выявлено, что COVID-19 поражает преимущественно взрослое население, в то время как дети болеют крайне редко, вплоть до формирования убеждений о невозможности развития у них этой инфекции. Однако по мере распространения возбудителя и накопления статистических данных стало понятно, что инфицированию SARS-CoV-2 подвержены дети всех возрастов, включая новорожденных и младенцев, но на эти возрастные группы приходится не более 1–5% всех выявленных случаев COVID-19 [4, 5]. Кроме того, большинство случаев COVID-19 в педиатрической практике отличалось легким, зачастую бессимптомным течением [6–8]. Пилотное исследование, посвященное особенностям клинического течения COVID-19 у детей разных возрастных групп, проведенное в Новосибирске, также свидетельствовало о тенденции к легкому и бессимптомному течению COVID-19 с развитием клинически более манифестных форм в старшем возрасте [9]. В целом COVID-19 у детей не отличался выраженной тяж стью даже при развитии COVID-19-пневмоний.
Но период «мнимого» благополучия в педиатрической практике сменился настораживающей тенденцией. Некоторые данные свидетельствуют о возможности развития тяжелого течения COVID-19 у детей в остром периоде, кроме того начали регистрироваться формы отсроченного полиорганного поражения воспалительного генеза – так называемые мультисистемные COVID-19 ассоциированные воспалительные синдромы (Multisystem inflammatory syndrome in children –MIS-C) [10, 11]. В большинстве опубликованных работ, посвященных описанию MIS-C, выявлены положительные серологические тесты на SARS-CoV-2 и значительно реже, практически в единичных случаях – положительные результаты назофарингеального тестирования методом полимеразной цепной реакции (ПЦР). Можно предположить, что этот синдром может быть постинфекционным, а не связанным с острой ранней инфекцией. При MIS-C регистрируется системное гипервоспалительное состояние, которое характеризуется повышенными уровнями фактора некроза опухоли (TNF), интерлейкинов (IL) IL-6, IL-1β, IL-17 и фактора стимуляции колоний гранулоцитов (G-CSF) [12], что патогенетически схоже с иммунными нарушениями при тяжелом течении COVID-19 у взрослых [13]. Таким образом, патогенез MIS-C, вероятно, связан с постинфекционными иммунными нарушениями и является отсроченной иммунологической реакцией гипервоспалительного иммунного ответа, развивающейся после симптоматической или бессимптомной инфекции COVID-19.
MIS-C, как правило, является ранним осложнением и чаще всего регистрируется в период от 2 до 4 нед. после острой инфекции, вызванной SARS-CoV-2. Однако не исключена возможность более поздних иммунных дисфункций, ассоциированных с COVID-19. Долгосрочное катамнестическое наблюдение за пациентами детского возраста, перенесшими COVID-19, в настоящее время фактически отсутствует в силу объективных причин. Но уже сейчас некоторые авторы рассматривают возможность развития поздних аутоиммунных нарушений, триггером для которых может являться COVID-19 [14–16]. Приводим серию клинических наблюдений развития аутоиммунных патологий у детей, для которых перенесенная инфекция, вызванная SARS-CoV-2, вероятно, явилась триггером развития аутоиммунной агрессии.
Клинический случай 1.
Пациент Х., 16 лет. У отца ребенка и бабушки COVID-19-пневмонии, оба находятся на стационарном лечении. Пациент находился в прямом контакте.
Из анамнеза жизни известно, что детскими инфекциями он не болел. Находится под диспансерным наблюдением онколога, невролога. В 2010 г. перенес оперативное вмешательство по поводу медуллобластомы червя мозжечка с последующей полихимиотерапией с достижением ремиссии заболевания, которое осложнилось развитием гидроцефалии, компенсированнной путем вентрикуло-перитонеального шунтирования в 2010 г. После перенесенного заболевания сохраняются легкая мозжечковая недостаточность, незначительные когнитивные нарушения. Другие хронические патологии отсутствуют.
Заболел 30.07.2020 с появления заложенности носа, развития насморка. Отмечалось развитие аносмии. Жалобы сохраняются вплоть до 07.08, когда температура тела повысилась до 37,8 °С, развился редкий сухой кашелья, снизились активность, аппетит. Жалобы сохраняются до 09.08, ребенок осмотрен участковым врачом, учитывая невозможность исключения течения COVID-19, 09.08 госпитализирован в стационар. В ГБУЗ НСО «Детская городская клиническая больница № 3».
Объективно при поступлении: ЧДД – 18 в минуту; ЧСС – 80 в минуту. Общее состояние средней тяжести. Сознание ясное, положение активное. Кожный покров умеренной влажности, бледно-розового цвета, в области кожного покрова волосистой части головы – послеоперационный рубец, подкожно в области шеи слева пальпируется вентрикуло-перитонеальный шунт. Лимфатические узлы не увеличены. В зеве – яркая гиперемия небных дужек; гипертрофия небных миндалин 1–2-й степени, налетов нет. Аускультативно в легких дыхание везикулярное, хрипы не выслушиваются. Перкуторно ясный легочный звук. Кашель редкий, сухой. Аускультативно тоны сердца ясные ритмичные, патологических шумов не выслушивается. Перкуторно границы сердца в пределах возрастной нормы. Живот мягкий, при пальпации безболезненный. Перистальтика выслушивается. Печень не увеличена, селезенка не пальпируется. Стул накануне, однократно оформленный. Дизурических расстройств не определяется, диурез адекватен.
Диагноз при поступлении: Острая инфекция верхних дыхательных путей, ринофаринготрахеит, средней степени тяжести. Фоновый диагноз: «Медуллобластома червя мозжечка, состояние после оперативного лечения, ремиссия. Внутренняя субкомпенсированная гидроцефалия, вентрикуло-перитонеальное шунтирование. Легкая мозжечковая недостаточность. Когнитивные нарушения». Лабораторные показатели пациента Х со времени поступления и их последующая динамика приведены в табл. 1.
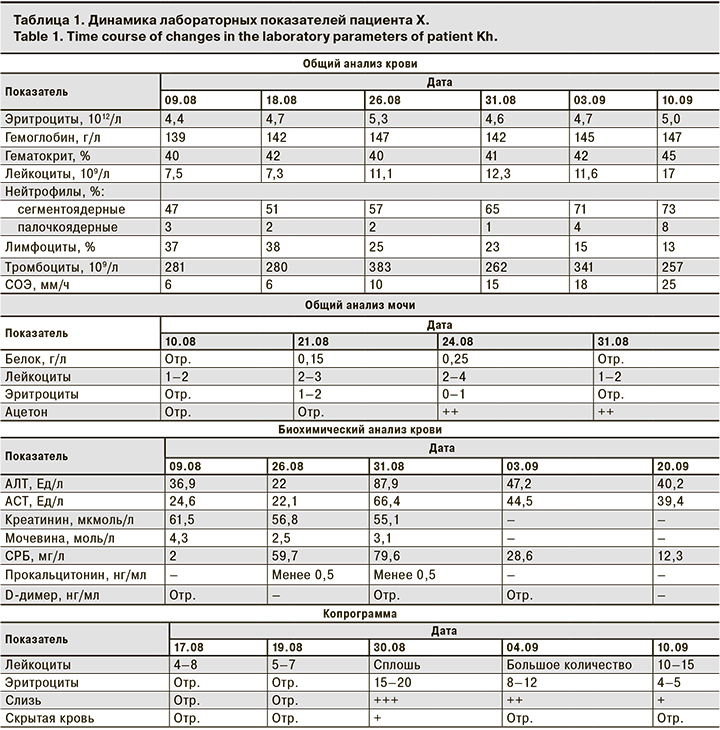
09.08 проведена ПЦР на РНК SARS-CoV-2, РНК обнаружена, что позволило верифицировать у пациента COVID-19. 10.08 проведена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки, заключение: небольшие единичные очаги уплотнения легочной паренхимы в S3 и S9 правого легкого. Указанные изменения соответствуют полисегментарной пневмонии при новой коронавирусной инфекции (КТ-1, легкой степени, до 8% вовлечения легочной паренхимы). Был выставлен диагноз: «Коронавирусная инфекция, вызванная вирусом COVID-19, вирус идентифицирован (подтвержден лабораторным тестированием независимо от тяжести клинических проявлений или симптомов) ПЦР мазков из носа и ротоглотки на РНК SARS-CoV-2 от 10.08. – РНК обнаружена, средней степени тяжести. Внебольничная вирусно-бактериальная правосторонняя полисегментарная пневмония легкой степени тяжести, ДН-0». Фоновый диагноз: «Медуллобластома червя мозжечка, состояние после оперативного лечения, ремиссия. Внутренняя субкомпенсированная гидроцефалия, вентрикуло-перитонеальное шунтирование. Легкая мозжечковая недостаточность. Когнитивные нарушения».
Пациенту проведены комбинированная антибактериальная терапия: цефотаксим + азитромицин, муколитическая терапия бромгексина гидрохлоридом в возрастной дозировке, симптоматическая терапия. На фоне комплексного лечения были купированы проявления интоксикационного синдрома, кашель разрешился, на контрольной МСКТ органов грудной клетки от 21.08 по сравнению с данными МСКТ-исследования от 10.08.2020 определяется положительная динамика в виде разрешения имевшихся очагов. Очаговых и инфильтративных изменений не выявлено. Однако начиная с 23.08 у пациента отмечались отрицательная динамика, появление волнообразных подъемов температуры тела до фебрильных цифр, развитие диарейного синдрома, гемоколита. Физикально, при пальпации живота, определялась болезненная спазмированная сигма. Ситуация была расценена как присоединение нозокомиальной бактериальной кишечной инфекции, в связи с чем был назначен антибактериальный препарат группы аминогликозидов – амикацин в возрастной дозировке. Несмотря на терапию антибиотиками группы резерва, стабилизации состояния не отмечено. 31.08 сохранялись проявления диарейного синдрома, гемоколита, выраженных воспалительных изменений в копрограмме, в сочетании с признаками гуморальной активности в крови. Расширенное этиологическое обследование, направленное на выявление возбудителей инвазивных кишечных инфекций (кал на дизгруппу, сальмонеллез, ПЦР-скрининг кишечных инфекций (Salmonella, Shigella, Campylobacter, аденовирус, ротавирус, норовирус), кал на микрофлору, клостридии и токсины клостридий, реакция непрямой агглютинации крови с сальмонеллезным, дизентерийным, иерсиниозным диагностикумом, кровь на тифо-паратифозную группу), показало отрицательные результаты. Учитывая данные клинической картины, параклинических методов исследования, торпидность гемоколита к терапии антибиотиками резерва, складывалось впечатление о вероятном дебюте воспалительного заболевания кишечника (ВЗК). С 01.09 был назначен метронидазол в возрастной дозировке. В обследовании назначен уровень фекального кальпротектина, который 02.09 составил более 1800 мкг/г (референс: менее 50 – норма; 50–200 – умеренное повышение; более 200 – выраженное повышение). 10.09 методом иммуноферментного анализа (ИФА) на антитела к SARS-CoV-2 были обнаружении IgM [коэффициент позитивности (КП) – 3,1], IgG (КП – 12,6). На фоне терапии метронидазолом отмечена некоторая положительная динамика, снизились частота жидкого стула, проявления гемоколита с положительной динамикой – кровь не в каждой порции. Отмечалась также положительная динамика параклинических показателей: снижение воспалительных изменений в копрограмме, уменьшение проявлений гуморальной активности в крови. Учитывая выраженное увеличение фекального кальпротектина, требовалось дальнейшее исключение дебюта ВЗК. 12.09 была проведена диагностическая колоноскопия с биопсией. В результате были выявлены признаки воспалительного поражения 2/3 сигмовидной кишки с развитием единичных эрозий. Определяется выраженная контактная кровоточивость слизистой оболочки. При морфологическом исследовании отмечены воспалительные изменения, ограниченные слизистой оболочкой, деформация крипт, формирование единичных крипт-абсцессов, инфильтрация базальной пластинки слизистой оболочки. На основании клинико-лабораторных данных, а также результатов инструментального и морфологического обследования был выставлен заключительный диагноз: «Коронавирусная инфекция, вызванная вирусом COVID-19, ПЦР мазков из носа и ротоглотки на РНК SARS-CoV-2 от 10.08 – РНК обнаружена, средней степени тяжести. Внебольничная вирусно-бактериальная правосторонняя полисегментарная пневмония, легкой степени тяжести, ДН-0». Сопутствующий диагноз: «Язвенный колит, дебют заболевания, левосторонний колит, острое течение, среднетяжелая атака. Фоновый диагноз: «Медуллобластома червя мозжечка, состояние после оперативного лечения, ремиссия. Внутренняя субкомпенсированная гидроцефалия, вентрикуло-перитонеальное шунтирование. Легкая мозжечковая недостаточность. Когнитивные нарушения».
14.09 пациент был переведен в профильный гастроэнтерологический стационар для дальнейшей диагностики и подбора базисной терапии.
Клинический случай 2.
Пациент С., 11 лет. У матери ребенка 05.10.2020 диагностирован COVID-19 (ПЦР на РНК SARS-CoV-2 – положительна, находился в прямом контакте. К 10.10.2020 у ребенка отмечалось развитие катаральных явлений, подкашливания, результат мазка на РНК SARS-CoV-2 положительный. Лечились симптоматически, с положительной динамикой. К 14.10 симптомы заболевания купированы.
Анамнез жизни. Из детских инфекций перенес ветряную оспу. На диспансерном учете не состоит. Около 1 года назад проводилось стоматологическое вмешательство. Около 1 года назад отец ребенка лечился от описторхоза, речную рыбу употребляют всей семьей.
Заболел 09.11с появления абдоминально-болевого синдрома, желтушного синдрома, потемнения мочи, ахолии стула, повышения температуры тела до фебрильных цифр. Жалобы сохраняются вплоть до 12.11. Ребенок осмотрен участковым педиатром. Биохимический анализ крови: АЛТ – 484 МЕ/л; АСТ – 398 МЕ/л. 12.11 госпитализирован в стационар. В ГБУЗ НСО «Детская городская клиническая больница № 3». Объективно при поступлении: ЧДД – 22 в минуту; ЧСС – 96 в минуту. Общее состояние средней степени тяжести. Сознание ясное, положение активное. Кожный покров умеренной влажности, желтуха средней интенсивности. Склеры иктеричны. Лимфатические узлы не увеличены. В зеве – неяркая гиперемия небных дужек; гипертрофия небных миндалин 1–2-й степени, налетов нет. Аускультативно в легких дыхание везикулярное, хрипы не выслушиваются. Перкуторно ясный легочный звук. Кашель отсутствует. Аускультативно тоны сердца ясные ритмичные, патологических шумов не выслушивается. Перкуторно границы сердца в пределах возрастной нормы. Живот мягкий, при пальпации безболезненный. Перистальтика выслушивается. Печень +3,5 см из-под края реберной дуги, селезенка – пальпируется край. Стул накануне, однократно осветленный. Дизурические расстройства не определяются, диурез адекватен, моча темного коричневого цвета. Диагноз при поступлении: «Неуточненный гепатит без признаков печеночной комы, манифестная желтушная форма, умеренной степени активности». Лабораторные показатели пациента С. со времени поступления и их последующая динамика приведены в табл. 2.
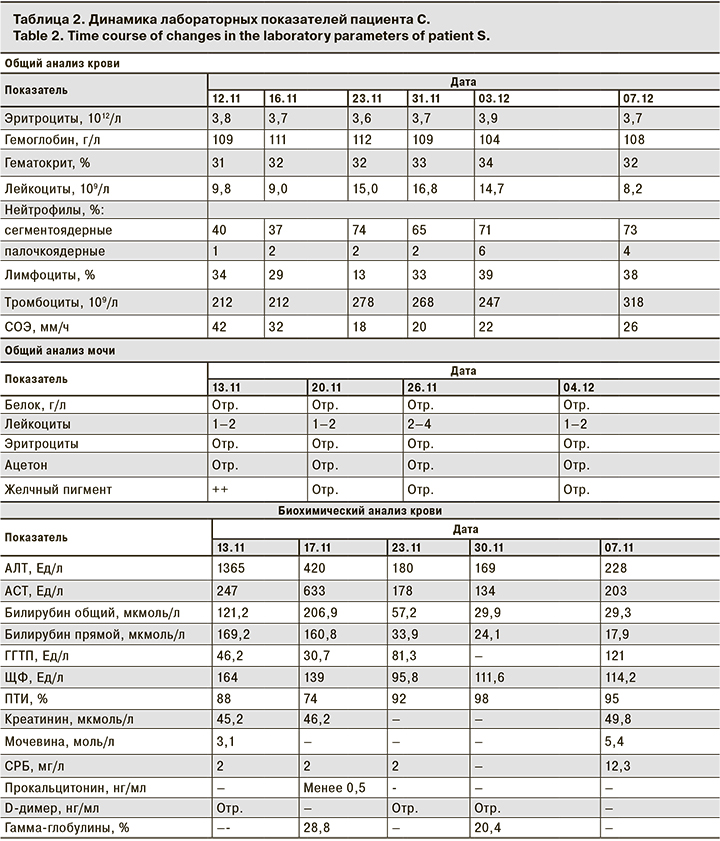
Учитывая выраженность клинических и параклинических проявлений, пациенту С. назначена гепатопротективная терапия препаратами урсодезоксихолевой кислоты в сочетании с эссенциальными фосфолипидами, инфузионная терапия растворами глюкозы. На фоне лечения стабилизации состояния не отмечено, регистрируется прогрессирование цитолитического, холестатического синдромов, прогрессирование гепатоспленомегалии, развитие геморрагического синдрома в виде единичных экхимозов, а также снижение протромбинового индекса, что потребовало назначения гемостатической терапии препаратами витамина К. Серологические маркеры гепатитов А, В, С от 15.11 – отрицательные, ИФА крови на антитела к вирусу Эпштейна–Барр и цитомегаловирусу – маркеры паст-инфекции. При УЗИ органов брюшной полости от 16.11, выявлены признаки выраженной гепатомегалии, спленомегалии, диффузные изменения паренхимы печени. Расширение портальной вены, признаки свободной жидкости в брюшной полости. МСКТ органов брюшной полости от 16.11: гепатоспленомегалия без очаговых изменений паренхимы печени. Лимфаденопатия паракавальных, парааортальных и мезентериальных лимфатических узлов за счет увеличения их размеров и количества. Методом ИФА на антитела к возбудителю описторхоза от 16.11 – антитела не выявлены, что позволило исключить течение острого описторхоза. Учитывая COVID-19 в анамнезе, 18.11 проведено исследование на антитела к SARS-CoV-2, показавшее высокие титры IgG (КП – 14,8). Учитывая прогрессирование заболевания с развитием геморрагического синдрома, асцита, отсутствие положительной динамики на фоне гепатопротективной терапии, гипергаммаглобулинемию в крови, сложилось впечатление о возможном течении аутоиммунного процесса с поражением печени – аутоиммунного гепатита (АИГ). В связи с этим принято решение об ex juvantibus терапии гормональными препаратами по протоколам индукции ремиссии при АИГ, в дозировке 2 мг/кг по преднизолону, а также проведении диагностики АИГ путем определения специфических антител. На фоне проводимой терапии глюкокортикостероидами (ГКС) отмеченаположительная динамика: снижение цитолиза, холестаза, уменьшение гепатоспленомегаии, разрешение асцита и желтушного синдрома. К 04.12пятикратно снизились показателей АЛТ, АСТ. Маркеры АИГ от 02.12: антитела к гладкой мускулатуре (ASMA) 1:160 (референс менее 1:40); антинуклеарные антитела (ANA) 1:60 (референс менее 1:40); антитела к микросомам печени не обнаружены, что позволило верифицировать диагноз АИГ 1-го типа. К 06.12начато постепенное снижение дозы ГКС. Для дальнейшегш лечения, подбора базисной терапии 07.12пациент переведен в профильный гастроэнтерологический стационар. Заключительный диагноз: «АИГ 1-го типа (ASMA от 02.12 – 1:160; ANA от 02.12 – 1:60), манифестная желтушная форма, умеренной степени активности». Сопутствующий диагноз: «Коронавирусная инфекция, вызванная вирусом COVID-19, ПЦР мазков из носа и ротоглотки на РНК SARS-CoV-2 от 05.11 – РНК обнаружена, легкой степени тяжести, период реконвалесценции».
Клинический случай 3.
Пациентка Е., 14 лет. 15.11.2020 у матери ребенка диагностирован COVID-19 (ПЦР на РНК SARS-CoV-2 положительная). 21.11 у ребенка отмечался эпизод респираторной инфекции легкой степени тяжести, к 23.11 симптомы купированы. На COVID-19 не обследовалась
Из детских инфекций перенесла ветряную оспу. Находится на диспансерном наблюдении у ЛОР-врача по поводу хронического тонзиллита. В конце 2019 г. консультирована психологом в связи с напряженными отношениями с родителями. Других хронических патологий не имеет.
Заболела 19.12.2020 с появления редких тикоидных подергиваний головы. 20.12 появилась рвота, лечилась симптоматически. 22.12 в школе произошло резкое усиление тиков, многочисленные навязчивые движения, гримасы, щелчки пальцами, сопровождающиеся посвистыванием При обращении к педиатру в частном медицинском центре, на приеме отмечено повышение температуры тела до 37,8 °С. 22.12. пациентка госпитализирована в ГБУЗ НСО «Детская городская клиническая больница № 3»
Объективно при поступлении ЧДД – 18 в минуту; ЧСС – 86 в минуту. Общее состояние средней степени тяжести. Сознание ясное, на вопросы отвечает адекватно. Отмечаются выраженный гиперкинетический синдром, многочисленные стереотипные движения: щелканье пальцами, навязчивые движения рук, гримасы, тикоидные движения головы в виде частых кивков, наклонов головы. Указанная симптоматика сопровождается вокализацией в виде посвистывания, озвучивания пропевных слогов. Кожный покров умеренной влажности, бледно-розового цвета. Лимфатические узлы не увеличены. В зеве неяркая гиперемия небных дужек; гипертрофия небных миндалин 2–3-й степени, налеты единичные точечные, единичные пробки в лакунах миндалин. Аускультативно в легких дыхание везикулярное, хрипы не выслушиваются. Перкуторно ясный легочный звук. Кашель отсутствует. Аускультативно тоны сердца ясные ритмичные, патологических шумов не выслушивается. Перкуторно границы сердца в пределах возрастной нормы. Живот мягкий, при пальпации безболезненный. Перистальтика выслушивается. Печень не увеличена, селезенка не пальпируется. Стул накануне, однократно оформленный. Дизурических расстройств не определяется, диурез адекватен. Диагноз при поступлении: «Энцефалит, миелит, энцефаломиелит? Гиперкинетический синдром». Лабораторные показатели пациентки Е. со времени поступления и их последующая динамика приведены в табл. 3.
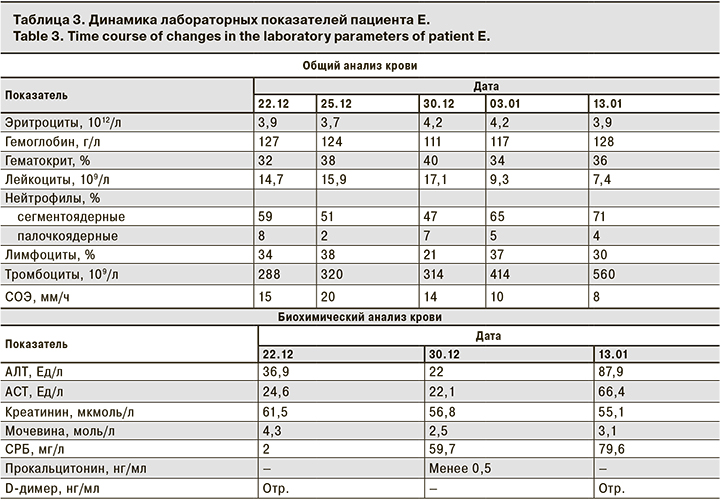
Учитывая выраженность гиперкинетического синдрома, пациентке назначена седативная терапия препаратами бензодиазепинового ряда, диазепам в возрастной дозировке однократно с последующим переходом на плановый прием клонозепама. Для устраненияпроявлений хронического тонзиллита, назначена антибактериальная терапия препаратами широкого спектра действия, ампициллин + сульбактам в возрастной дозировке. 23.12в условиях медикаментозной седации (масочный наркоз с севораном) проведена люмбальная пункция, получен прозрачный ликвор: белок – 0,5 г/л; цитоз – 2 кл./мкл. Геномы герпетической группы вирусов (ВПГ 1-го и 2-го типов, варицелла зостер, вирус Эпштейна–Барр, цитомегаловирус) методом ПЦР не обнаружены. 24.12проведена МРТ головного мозга с контрастированием Заключение: МРТ-данных за наличие изменений очагового и диффузного характера в веществе головного мозга не выявлено. С приема 23.12 пациентка была обследована серологически для выявления маркеров стрептококковой инфекции (АСЛО), от ( 800 МЕ/мл), при этом бактериологическое исследование из зева показало рост условно-патогенной микрофлоры, что не имело этиологического значения. Учитывая прямой контакт по COVID-19 в анамнезе, 24.12 пациентка былаобследована на наличие антител к SARS-CoV-2, выявлены высокие титры IgG (коэффициент позитивности = 17,4). На основании клинической картины заболевания, а также в связи с отсутствием воспалительных изменений по данным люмбальной пункции, отсутствием патологических изменений по данным МРТ исследования головного мозга, в сочетании с наличием маркеров стрептококковой инфекции, нарастающих в динамике (АСЛО от 30.12 – 1000 МЕ/мл), складывалось впечатление о развитии у пациентки педиатрического аутоиммунного нейропсихического расстройства, ассоциированного со стрептококковой инфекцией, или PANDAS. В связи с этим 30.12 была проведена коррекция терапии, пациентка переведена на длительный прием азитромицина (курсом до 21 дня) в возрастной дозировке, назначены плановая противовоспалительная терапия нестероидными противовоспалительными препаратами (ибупрофен в возрастной дозировке), иммуносупрессивная терапия ГКС в дозировке 1,5 мг/кг по преднизолону. С иммунокорригирующей целью проведены трансфузии человеческого иммуноглобулина 30.12.2020 и 03.01.2021. На фоне проводимой терапии к 08.01 отмечена стабилизация состояния, значительно снизилась выраженность гиперкинетического синдрома. Начато ступенчатое снижение дозы ГКС с полной отменой к 15.01. Для дальнейшего обследования и лечения, возможного подбора базисной терапии 17.01подросток переведен в профильный неврологический стационар. Заключительный диагноз: «Педиатрическое аутоиммунное нейропсихическое расстройство, ассоциированное со стрептококковой инфекцией, PANDAS (АСЛО от 23.12.2020 – 800 МЕ/мл; от 30.12 – 1000 МЕ/мл), гиперкинетический, обсессивно-компульсивный синдром». Сопутствующий диагноз: «Коронавирусная инфекция, вызванная вирусом COVID-19 (ИФА крови на антитела к SARS-CoV-2 от 24.12.2020 – IgG обнаружены (коэффициент позитивности – 17,4) легкой степени тяжести, период реконвалесценции».
Обсуждение
Приведенные клинические наблюдения демонстрируют дебют достаточно редких аутоиммунных патологий у детей. Безусловно, роль COVID-19 в развитии подобных аутоиммунных нарушений является дискутабельной, однако обращает на себя внимание тот факт, что до развития COVID-19 у пациентов подобных жалоб и состояний никогда не отмечали.
SARS-CoV-2 является глобальной проблемой, требующей изучения острых и отдаленных патологических изменений в организме человека в разных возрастных группах. В частности представляется актуальным изучение потенциальной роли COVID-19 как триггерного фактора развития аутоиммунных патологий [17]. По всему миру появляются новые сообщения о дебютах аутоиммунных и аутовоспалительных заболеваний, вероятным триггером для которых являлся COVID-19. Описаны случаи развития иммунной гемолитической анемии, ассоциированной с COVID-19 [18], иммунной тромбоцитопенической пурпуры [19], а также синдрома Гийена–Барре [20].
Возможные механизмы, объясняющие связь между аутоиммунитетом и COVID-19, включают молекулярную мимикрию и активацию избыточного иммунного воспаления [21, 22]. Механизм антигенной мимикрии базируется на сходстве между чужеродными и собственными белками, что способствует активации аутореактивных Т- или В-клеток у восприимчивого индивидуума. Протеом SARS-CoV-2 был описан как разделяющий 3 последовательности из 6 аминокислот (GSQASS, LNEVAK и SAAEAS) с 3 белками, а именно DAB1, AIFM и SURF1, которые присутствуют в дыхательном центре головного мозга [23]. Недавно впервые выдвинута гипотеза, что это частичное, но не полное сходство может объяснять аутоиммунную центральную депрессию дыхания. В дальнейшем было обнаружено, что SARS-CoV-2 имеет общие черты с легочным сурфактантом и родственными белками, которые могут объяснять аутоиммунное повреждение легких, наиболее часто регистрирующееся при остром течении тяжелых форм инфекции, вызванной SARS-CoV-2, а также, вероятно, ухудшающее прогноз в периоде восстановления после перенесенного COVID-19 [24]. Более того, недавний отчет показал, что антитело к белку SARS-CoV-2 и тканевые белки, такие как различные формы трансглутаминаз, экстрагируемый ядерный антиген, основной белок миелина, белки митохондрий, ядерный антиген, α-миозин, пероксидаза щитовидной железы, коллаген, различные фракции клаудина, обладают сильными перекрестными иммунными реакциями [25]. Это может указывать на то, что аутоиммунитет через молекулярную мимикрию у восприимчивых людей вероятен и может объяснить некоторые аутоиммунные проявления, встречающиеся у пациентов с COVID-19.
Заключение
Представленные клинические наблюдения демонстрируют сложность проблемы и необходимость мультидисциплинарного подхода к пациентам с COVID-19 и постковидными нарушениями. Складываются предпосылки для рассмотрения COVID-19 как триггера для различных аутоиммунных состояний. Патогенез развития, подходы к диагностике и терапии требуют дальнейшего изучения.


