В настоящее время насчитывается более 2500 серотипов сальмонелл, различающихся по наличию О- и Н-антигенов, однако практическое значение для человека имеют 10–15 серотипов, которые обусловливают до 90% заболеваемости в мире. К ним относятся: S. еnteritidis (S. еnterica), S. typhimurium, S. derbу, S. newport, S. heidelberg, S. panama, S. london, S. infantis, S. аnatum [1, 2].
Одной из патогенетических особенностей сальмонеллеза, в отличие от других острых кишечных инфекций, является способность к генерализации инфекции с поражением брыжеечных лимфатических узлов, бактериемией и возможным вовлечением в патологический процесс внутренних органов, в том числе центральной нервной системы (ЦНС). [3]. К генерализованным формам сальмонеллеза относят тифоподобную и септическую [1]. В группу риска по развитию генерализованных форм сальмонеллеза входят пациенты с хроническими воспалительными заболеваниями кишечника, сахарным диабетом, а также лица с иммунодефицитом, в том числе с ВИЧ-инфекцией [1, 3]. Так, в Португалии описан случай тяжелого сепсиса с поражением печени и селезенки, вызванного резистентной к ципрофлоксацину Salmonella sp. у пациента после трансплантации почек [4]. В Чили зарегистрирован случай менингита, вызванного Salmonella enteritidis, у 11-месячного ребенка с проявлениями выраженной интоксикации и эпилептическим кризом [5]. D.A. Piggott и соавт. [6] описывают летальный исход ишемического инсульта, связанного с субдуральной эмпиемой, вызванной Salmonella enteritidis, у пожилого ВИЧ-инфицированного пациента.
В настоящее время ежегодно растет количество иммунокомпрометированных пациентов, что во многом связано с широким распространением новых высокоэффективных медицинских технологий, таких как трансплантация органов и тканей, применение высокодозной цитостатической химиотерапии. Одной из основных причин развития иммуносупрессии является ВИЧ-инфекция [7, 8]. Заболеваемость ВИЧ-инфекцией и пораженность населения в России в последние годы остаются высокими. По состоянию на 31 декабря 2021 г. в РФ проживают 1 137 596 чел. с подтвержденным диагнозом ВИЧ-инфекции. За 2021 г. в РФ выявлено 61 098 новых случаев болезни, вызванной ВИЧ, и показатель заболеваемости составил 41,7 на 100 тыс. населения [9]. Показано, что у пациентов с продвинутыми стадиями заболевания (4А-В; СПИД) сальмонеллез характеризуется рецидивирующей бактериемией и относительной редкостью желудочно-кишечных проявлений [6].
Учитывая высокий риск развития генерализованных форм сальмонеллеза у иммунокомпрометированных лиц, эта проблема требует дополнительного изучения для разработки методов своевременной диагностики и эффективного лечения.
Приводим клиническое наблюдение случая септической формы сальмонеллеза с поражением ЦНС у больного ВИЧ-инфекцией находившегося на лечении в ГБУЗ НСО «Городская инфекционная клиническая больница № 1» г. Новосибирска.
Пациент Б., 42 года, мужчина, официально не трудоустроен. Диагноз ВИЧ-инфекции установлен 08.08.2018 (результат иммуноблота положительный). Путь инфицирования – половой гетеросексуальный. Предполагаемое время инфицирования – 2010 г., когда было несколько незащищенных половых контактов. Другие возможные пути инфицирования отрицает.
Из плазмы периферической крови пациента была выделена РНК ВИЧ-1 и получены фрагменты гена pol размером 1300 п. н. С помощью секвенирования по Сэнгеру расшифрована нуклеотидная последовательность вирусных фрагментов и выполнен анализ наличия мутаций резистентности ВИЧ к ингибиторам протеазы, нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы с использованием Стэндфордской базы данных (https://hivdb.stanford.edu). Количество CD4+-лимфоцитов в крови составлял 138 клеток/мкл (тяжелый иммунодефицит); выявлена высокая вирусная нагрузка (ВН) – 1 639 000 копий/мл РНК ВИЧ. Антиретровирусная терапия (АРТ) начата 21.08.2018 по схеме: тенофовир + ламивудин + эфавиренз (TDF + 3TC + EFV). Отмечалась вирусологическая и иммунологическая эффективность лечения до прерывания АРТ (табл. 1). В январе 2020 г. пациент прервал АРТ и прекратил диспансерное наблюдение в связи с переездом в другой регион, где в территориальный Центр СПИД не обращался. Вновь прибыл в Новосибирскую область в 2022 г.

Бригадой скорой медицинской помощи 25.02.2022 доставлен в ГБУЗ НСО «Городская инфекционная клиническая больница № 1» с жалобами на слабость, лихорадку до 38,2 ºС в течение 5 дней, жидкий необильный стул зеленого цвета с примесью слизи до 3–5 раз в сутки, умеренные разлитые боли в животе. Рвоты не было.
Объективно: температура тела 37,7 ºС. Кожные покровы бледно-розовые, элементов сыпи нет. Цианоз и нарушения микроциркуляции отсутствуют. На слизистой зева (мягкое небо) – «островчатые» налеты белого цвета (проявления орофарингеального кандидоза). В легких жесткое дыхание, хрипов нет. ЧДД 18 в 1 мин. Тоны сердца приглушены, ритмичные. АД 110/70 мм рт. ст., ЧСС 92 в 1 мин. Живот при пальпации мягкий, болезненный по ходу толстого кишечника. Менингеальных и очаговых неврологических симптомов нет. Диурез, со слов больного, снижен.
В гемограмме выявлены: анемия (гемоглобин 101 г/л, эритроциты – 3,57 × 1012 /л), тромбоцитопения 102 × 109 /л, уровень лейкоцитов в норме – 5,4 × 109/л. Биохимический анализ крови: повышен уровень мочевины – 10,2 ммоль/л; С-реактивный белок (СРБ) – 21 мг/л. Другие показатели в норме: креатинин 118 мкмоль/л, глюкоза 6,2 ммоль/л, АЛТ 40МЕ/л. АСТ 34 МЕ/л. В копрограмме признаки энтероколита: лейкоциты 10–15 неизмененные, слизь++, мышечные волокна+. Иммуноферментный анализ (ИФА) и иммуноблот на ВИЧ положительные. Маркеры вирусных гепатитов В (HbsAg, IgMHbcor) и С (анти-ВГС) в ИФА отрицательные. ЭКГ: синусовый ритм, тахикардия 86 в 1 мин. Рентгенография органов грудной клетки без особенностей. Количество CD4+-лимфоцитов в крови – 39 клеток/мкл (тяжелый иммунодефицит). Выявлена высокая ВН РНК ВИЧ – 3 400 200 копий/мл.
С учетом клинических и лабораторных данных, сформулирован предварительный диагноз: «ВИЧ-инфекция, стадия вторичных заболеваний 4В, фаза прогрессирования на фоне прерывания АРТ. Орофарингеальный кандидоз. Острая кишечная инфекция, энтероколит средней степени тяжести. Подозрение на сальмонеллез».
Больному назначены антибактериальная терапия (ципрофлоксацин 400 мг внутривенно капельно 2 раза в сутки), противогрибковая терапия (флуконазол 100 мг 1 раз в сутки), диета № 4, энтеросорбенты, инфузионная терапия (раствор Рингера внутривенно капельно). Учитывая низкое количество CD4+-лимфоцитов, начата терапия по схеме: сульфаметоксазол + триметоприм в поддерживающей дозе для профилактики пневмоцистной инфекции. Согласно клиническим рекомендациям «ВИЧ-инфекция у взрослых» [8]. АРТ возобновлена по неотложным показаниям по альтернативной схеме с учетом уровня ВН и сопутствующих заболеваний: абакавир + ламивудин + ралтегравир (ABC + 3TC + RAL). Генотипирование ВИЧ-1 показало, что выделенный вирус относится к широко распространенной в России популяции ВИЧ-1 субтипа А6, мутационный анализ не выявил специфических мутаций или мутаций, связанных с развитием резистентности вируса к препаратам, входившим в схему терапии. На фоне проводимой АРТ признаков синдрома восстановления иммунитета не отмечено.
На фоне терапии на 3-е сутки госпитализации (27.02) регрессировали гастроинтестинальные симптомы (диарея и боли в животе), однако сохранялся субфебрилитет с периодическими подъемами температуры тела до фебрильных цифр. Усилились проявления интоксикационного синдрома: выраженная слабость, миалгии. Выявлены повышение уровня прокальцитонина до 5,29 нг/ мл, нарастание СРБ до 101 мг/л, лейкоцитоз (лейкоциты – 14,3 х 109/л); нейтрофилез, сдвиг лейкоцитарной формулы влево (палочкоядерные нейтрофилы 13%, сегментоядерные – 69%), лимфопения (уровень лимфоцитов 12%). Посев крови на стерильность был в работе. При бактериологическом исследовании кала выделена S. enteritidis.
Учитывая клиническую картину и результаты лабораторных исследований, заподозрено развитие септической формы сальмонеллеза на фоне тяжелого иммунодефицита. Антибактериальная терапия была скорректирована на цефтриаксон 2,0 г х 2 раза в день внутримышечно + амикацин внутривенно капельно (суточная доза 1,0 г), увеличен объем инфузионной терапии.
На 5-е сутки госпитализации (01.03) состояние пациента резко ухудшилось за счет остро возникшей неврологической симптоматики: появились выраженная заторможенность, дезориентация в месте и времени, нарушения речи. Объективно: температура тела 37,3 ºС, АД 130/85 мм рт. ст., ЧДД 18 в 1 мин, ЧСС 97 в 1 мин, StO2 97%. В неврологическом статусе: уровень сознания – оглушение (13–14 баллов по шкале комы Глазго); дезориентирован; симптомы поражения черепно-мозговых нервов отсутствуют; менингеальные знаки: сомнительная ригидность затылочных мышц, симптом Кернига – сомнительный; очаговая неврологическая симптоматика отсутствует. Рвоты и диареи за минувшие сутки не было. Пациент был переведен в отделение реанимации и интенсивной терапии для дальнейшего наблюдения и лечения. Из крови выделена S. enteritidis, резистентная к ципрофлоксацину и амикацину (табл. 2).
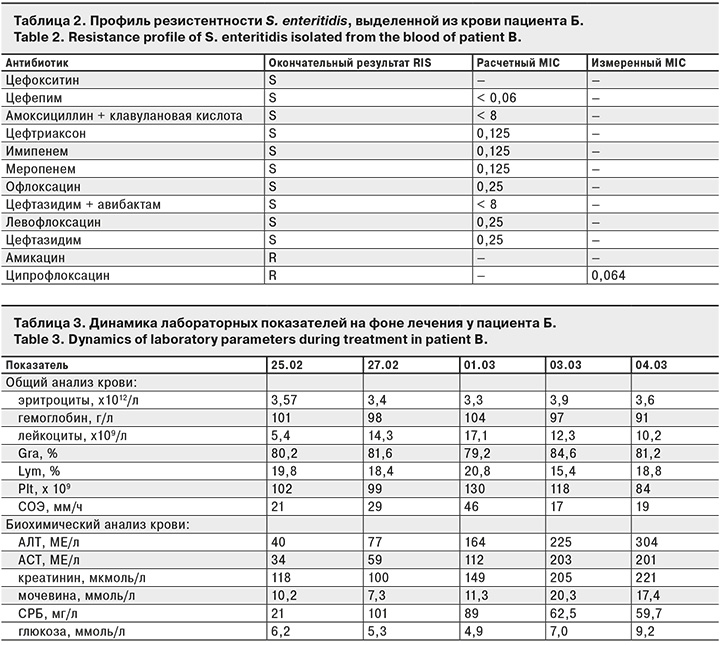
В связи с возникновением симптомов поражения ЦНС с диагностической целью выполнена люмбальная пункция: получен ликвор желтого цвета, высокий плеоцитоз /3 = 1086 в 1 мм3 с преобладанием нейтрофилов (80%), лимфоцитов 20%, уровень белка повышен до 2,2 г/л, глюкозы – снижен до 1,1 ммоль/л, реакция Панди+++. Результат РАЛ (реакции агглютинации латекса) на антигены менингококка и пневмококка в ликворе отрицательный. Результаты ПЦР ликвора на ДНК вируса простого герпеса 1, 2, цитомегаловирус, вирус Эпштейна–Барр, микобактерии туберкулеза; Тoxoplasma gondii отрицательные. Экспресс-тест (иммунохроматографический анализ) на наркотические вещества в моче отрицательный. Антибактериальная терапия скорректирована с учетом чувствительности возбудителя: меропенем 2,0 г 3 раза в день внутривенно капельно + офлоксацин 200 мг 2 раза в сутки внутривенно капельно. Проводилась патогенетическая терапия для протезирования витальных функций организма и церебропротекции. С учетом дальнейшего прогрессирования церебрального дефицита (11 баллов по шкале комы Глазго – глубокое оглушение) по жизненным показаниям переведен на ИВЛ. АД 110/70 мм рт. ст. без вазопрессоров, ЧДД 16 в 1 мин, ЧСС 87 в 1 мин, температура тела 37,1 ºС. В гемограмме отмечено нарастание лейкоцитоза до 17,1 х 109 /л. СРБ 89 мг/л. Из ликвора бактериологическим методом выделена S. enteritidis. При КТГ головного мозга патологических изменений в веществе мозга не выявлено. Рентгенография органов грудной клетки повторно – без очаговых и инфильтративных изменений.
На 8-е сутки госпитализации (04.03), несмотря на проводимую терапию, сохранялись лихорадка до фебрильных цифр и прогрессирование церебрального дефицита до 9 баллов по шкале комы Глазго. В биохимическом анализе крови и гемограмме регистрировались изменения, характерные для развития полиорганной недостаточности (табл. 3).
На 9-е сутки госпитализации (05.03) по кардиомонитору зафиксирована асистолия. Реанимационные мероприятия в течение 30 мин. без эффекта. Констатирована биологическая смерть.
Заключительный клинический диагноз.
Основное заболевание: ВИЧ-инфекция, стадия вторичных заболеваний 4В, фаза прогрессирования на фоне прерывания АРВТ. Тяжелый иммунодефицит (количество СD4+-лимфоцитов – 39 клеток/мкл). Сальмонеллез, септическая форма (S. enteritidis из крови; ликвора): менингоэнцефалит; нефрит тяжелой степени тяжести.
Вторичные заболевания: орофарингеальный кандидоз.
Осложнения основного заболевания: синдром полиорганной недостаточности (церебральная; сердечно-сосудистая; почечно-печеночная; дисфункция поджелудочной железы). ИВЛ от 01.03.2022. Катетеризация подключичной вены справа.
Сопутствующее заболевание: хроническая анемия средней степени тяжести.
При морфологическом исследовании выявлены признаки септического поражения почек и головного мозга на фоне ВИЧ-инфекции. При макроскопическом исследовании отмечено выраженное полнокровие мягких мозговых оболочек с формированием очаговых периваскулярных фокусов до 0,3 см в диаметре и отек-набухание вещества головного мозга. Микроскопическая картина в веществе головного мозга и мягких мозговых оболочках (рис. 1, см. на вклейке) представлена отеком мягкой мозговой оболочки с диффузным содержанием лимфоцитов. Тромбоз сосудов, с преобладанием страдания на уровне микроциркуляторного русла. Отек нейропиля. Картина в почечной паренхиме (рис. 2, см. на вклейке) представлена некрозом канальцевого эпителия и страданием гломерулярного эпителия. В строме рассеянная лимфоцитарная инфильтрация.
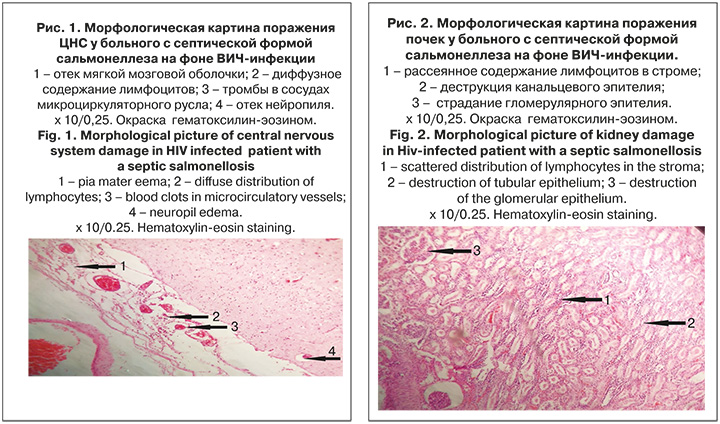
Результаты морфологического исследования подтвердили клинический диагноз.
Обсуждение
В представленном клиническом случае мы наблюдали развитие септической формы сальмонеллеза на фоне тяжелого иммунодефицита у пациента с ВИЧ-инфекцией, с быстрым возникновением симптомов поражения ЦНС. Это согласуется с литературными данными о том, что у пациентов с иммунодефицитом, в том числе с ВИЧ-инфекцией, сальмонеллез характеризуется рецидивирующей бактериемией и высоким риском генерализации инфекции с поражением внутренних органов и тканей, включая ЦНС [6]. Несмотря на возобновление АРТ и проводимую антибактериальную (с учетом чувствительности) и патогенетическую терапию, состояние пациента стабилизировать не удалось. Необратимое поражение S. enteritidis ЦНС и почек на фоне тяжелого иммунодефицита привело к грубому нарушению витальных функций с последующим летальным исходом.
Приведенный клинический случай септической формы сальмонеллеза демонстрирует сложность ее диагностики и выбора антибактериальной терапии на начальном этапе. Серьезной проблемой, требующей отдельного изучения, является распространение штаммов сальмонелл, резистентных к основным видам антибиотиков [10].
Заключение
Таким образом, при диагностике сальмонеллеза у больных ВИЧ-инфекцией необходима настороженность к высокому риску развития генерализованных форм заболевания. Клиническим критерием неблагоприятного прогноза септической формы сальмонеллеза у таких больных является сохранение лихорадки на фоне проводимой антибактериальной терапии и регресса гастроинтестинальных симптомов. В реальной клинической практике требуется исследование профиля лекарственной устойчивости сальмонелл для выбора эффективной антибактериальной терапии.


