В соответствии с действующими отечественными и международными рекомендациями в настоящее время антиретровирусная терапия (АРТ) показана всем больным ВИЧ-инфекцией, вне зависимости от наличия или отсутствия клинических проявлений заболевания, количества CD4+-лимфоцитов и уровня РНК ВИЧ [1–4]. Схемы АРТ, которые могут быть назначены абсолютному большинству пациентов, относят к предпочтительным режимам. Также выделяют альтернативные схемы АРТ, которые, как правило, используют у пациентов особых групп. Выбор такого режима зависит от наличия у пациента на момент назначения АРТ тех или иных вторичных или сопутствующих заболеваний, а также возможных лекарственных взаимодействий между антиретровирусными препаратами и лекарственными средствами, которые пациент уже получает. В связи с этим ряду пациентов необходим индивидуальный подход при составлении схемы АРТ [4].
В 2017 г. в Российской Федерации был зарегистрирован препарат элсульфавирин (ESV) – новый ненуклеозидный ингибитор обратной транскриптазы ВИЧ (ННИОТ). При проведении регистрационных исследований схема АРТ, включавшая ESV в сочетании с 2 препаратами из группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ (НИОТ) – тенофовиром (TDF) и эмтрицитабином (FTC), показала высокую вирусологическую и иммунологическую эффективность и хорошую безопасность по сравнению со схемой, содержавшей TDF/FTC и эфавиренз (EFV) в течение 48 нед. терапии [5]. Продолжение исследования до 96 нед. подтвердило полученные результаты. В течение второго года исследования использовали схему, включавшую ESV и 2 НИОТ (по выбору врачей) [6]. В настоящее время продолжается пострегистрационное исследование безопасности («ПРИБ») схемы АРТ ESV + 2 НИОТ как у пациентов, ранее не получавших терапии, так и у больных, получающих эффективный режим АРТ, но предъявляющих жалобы на наличие нежелательных явлений (НЯ), связанных с лечением. Проводимое сотрудниками специализированного научно-исследовательскиого отдела по профилактике и борьбе со СПИДом Центрального НИИ эпидемиологии исследование по применению отечественной схемы АРТ, включающей ESV + фосфазид (Ф-АЗТ) и ламивудин (3ТС), является частью исследования «ПРИБ». Ранее проведенные исследования показали сопоставимую эффективность и безопасность комбинации Ф-АЗТ + 3ТС + EFV и схемы TDF + FTC + EFV [7]. Использование в составе режима АРТ Ф-АЗТ может быть альтернативой препаратам TDF и абакавир (АВС), особенно для пациентов, страдающих патологий почек, сердечно-сосудистой системы, снижением минеральной плотности костной ткани, а также при наличии положительного результата теста на HLA B*5701.
Целью исследования была оценка эффективности и безопасности отечественной схемы АРТ, включавшей Ф-АЗТ, 3ТС и ESV, в течение 96 нед. лечения больных ВИЧ-инфекцией, ранее не получавших терапии.
Материалы и методы
В исследование были включены 102 больных ВИЧ-инфекцией, ранее не получавших АРТ. Всем пациентам была назначена схема АРТ: Ф-АЗТ (400 мг 2 раза в сутки) + 3ТС (150 мг 2 раза в сутки) + ESV (20 мг в сутки). Применяли MITT-анализ (модифицированный анализ – Modified Intention-to-treat), предусматривающий включение всех пациентов, получивших хотя бы 1 дозу препаратов и имеющих хотя бы 1 исследование ВИЧ РНК после визита на неделе «0». Поскольку 4 пациента на 1-й визит (4 нед. АРТ) не явились, они были исключены из исследования. Таким образом, анализ был проведен по данным, полученным от 98 больных. На 01.04.2021 90 пациентов завершили 24 нед. лечения, 80 пациентов – 48 нед. и 72 пациента – 60 нед. Исследование продолжается.
73,5% пациентов составили мужчины. Медиана возраста пациентов – 35 лет. 65,7% пациентов заразились ВИЧ при гетеросексуальных контактах. У абсолютного большинства (87,8%) была установлена 3 (субклиническая) стадия ВИЧ-инфекции. У 10 (10,2%) больных имела место стадия вторичных заболеваний (у 9 – 4А и у 1 – 4Б). Среди вторичных заболеваний преобладали кандидоз слизистых оболочек ротовой полости, герпетические инфекции (Herpes simplex, Herpes zoster), рецидивирующие респираторные инфекции и снижение массы тела (у 1 пациента более чем на 10%). У всех 10 пациентов вторичные заболевания были в анамнезе. На момент включения в исследование вторичных заболеваний у пациентов не было. До начала терапии медиана числа CD4+-лимфоцитов составляла 449 клеток/мкл, у 27,6% больных количество CD4+-лимфоцитов было < 350 клеток/мкл. Иммунорегуляторный индекс (соотношение CD4/CD8-лимфоцитов) был равен 0,458. Медиана РНК ВИЧ – 15 286 копий/мл, у 20,6% пациентов РНК ВИЧ превышала 100 000 копий/мл.
10 пациентов имели сопутствующие заболевания органов желудочно-кишечного тракта и печени (ХГС, хронический гастрит, хронический панкреатит, язвенную болезнь 12-перстной кишки), 4 – заболевания сердечно-сосудистой системы (гипертоническую болезнь, ИБС), 2 – болезни почек (хронический гломерулонефрит, пиелонефрит).
До начала исследования, через 4, 12 нед. и далее каждые 12 нед. (24, 36, 48 и 60 нед.) методом проточной цитометрии определяли количество CD4+- и CD8+-лимфоцитов, методом ПЦР – уровень РНК ВИЧ (чувствительность теста – 50 копий/мл).
Безопасность схемы АРТ оценивали по частоте развития НЯ различной степени тяжести по данным субъективных жалоб, физикального осмотра, жизненных показателей, лабораторных исследований. Параметры анализа периферической крови и биохимического анализа крови исследовали до лечения, через 4, 12, 24, 36, 48 и 60 нед. терапии. Показатели обмена липидов крови [общий холестерин (ОХ), липопротеиды высокой плотности (ЛПВП), липопротеиды низкой плотности (ЛПНП), триглицериды] определяли до начала АРТ, через 24 и 48 нед. лечения. Также оценивали индекс атерогенности (ОХ/ЛПВП).
Внутригрупповые изменения параметра оценивали с помощью t-теста Стьюдента (для нормально распределенных данных) или знакового критерия Вилкоксона (Манна–Уитни) (для данных, не имеющих нормального распределения). В качестве теста на нормальность распределения использовали тест Шапиро–Вилка. Для обработки результатов использовали компьютерную программу Biostat.
Результаты
Исходные характеристики пациентов представлены в табл.1.
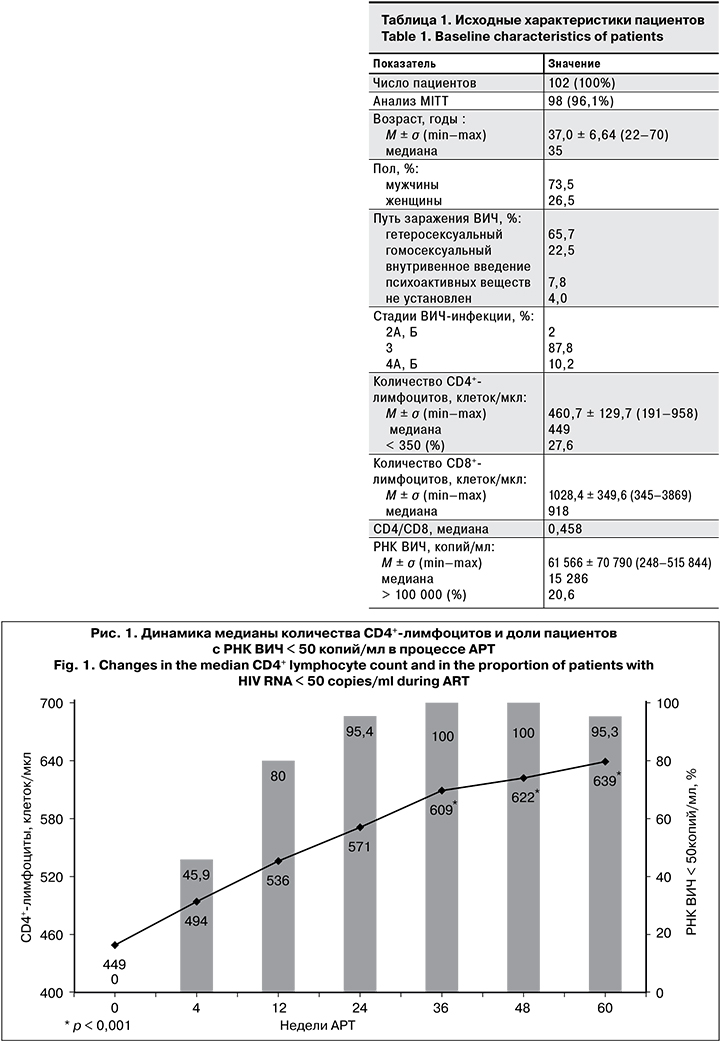
Уже через 4 нед. после начала АРТ уровень РНК ВИЧ < 50 копий/мл был у 45,9% больных, а через 12 нед. – у 80%, что свидетельствовало о быстром подавлении репликации ВИЧ (рис. 1). Доля пациентов с неопределяемым уровнем РНК ВИЧ через 24, 48 и 60 нед. была равна 95,4, 100 и 95,3%. Через 60 нед. АРТ у 3 пациентов уровень РНК ВИЧ был > 50, но < 500 копий/ мл. Ни у одного пациента не наблюдали повышения уровня РНК ВИЧ > 1000 копий/ мл. Таким образом, в течение 60 нед. лечения вирусологической неэффективности терапии отмечено не было. Высокий уровень приверженности лечению (пациенты принимали > 95% назначенных доз препаратов) имел место у 92, 97,4 и 98,5% больных соответственно через 24, 48 и 60 нед. АРТ. Начиная с 24 нед. лечения достоверно увеличивалось количество CD4+-лимфоцитов (p < 0,001). Прирост медианы количества CD4+-лимфоцитов через 24, 48 и 60 нед. исследования составил 62, 173 и 190 клеток/мкл соответственно (см. рис. 1). По мере увеличения медианы количества CD4+-лимфоцитов регистрировали заметное увеличение медианы иммунорегуляторного индекса с 0,458 (до лечения) до 0,724 (24 нед. АРТ) и 0,828 (60 нед. АРТ). Кроме того, ни у одного из пациентов не наблюдали клинических симптомов вторичных заболеваний, что свидетельствовало об отсутствии клинической прогрессии ВИЧ-инфекции.
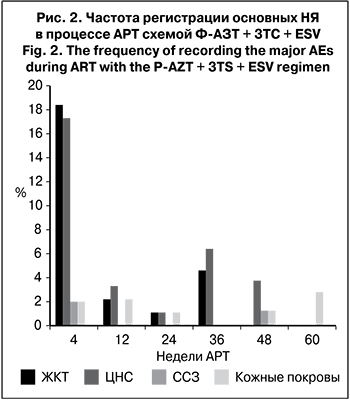 Переносимость схемы АРТ была хорошей: – 92,5–95% пациентов никаких НЯ, связанных с терапией, не отмечали (рис. 2). В течение первых 4 нед. терапии частота НЯ была максимальной, что свидетельствовало об адаптации пациентов к режиму АРТ. Так, 18,4% больных предъявляли жалобы на чувство тошноты после приема Ф-АЗТ, а 17,3% – на головную боль и головокружение, вероятно, связанные с приемом ESV. Единичные пациенты предъявляли жалобы на сухость кожных покровов и кожный зуд. Эти НЯ были легкой степени и у большинства пациентов не требовали коррекции схемы АРТ или назначения дополнительной терапии. После 3 мес. лечения НЯ регистрировали у единичных больных. У 1 пациента через 12 нед. АРТ в связи с сохраняющимися жалобами на тошноту доза Ф-АЗТ была снижена до 200 мг 2 раза в сутки, после чего НЯ было полностью купировано. Через 36 нед. АРТ у 1 пациентки Ф-АЗТ заменен на TDF из-за тошноты, а еще у 2 пациентов схема АРТ изменена полностью (в одном случае из-за нарушений сна и памяти, во втором – в связи с тошнотой и головной болью). В течение первых 12 нед. лечения регистрировали небольшое снижение медианы содержания Hb: неделя 0 – 146 г/л, 12-я нед. – 135 г/л (в 6,5% случаев – менее 110 г/л). Через 24 и 48 нед. медиана уровня Hb увеличилась до 142 г/л, а к 60-й нед. – до 144 г/л. У 1 пациентки через 24 нед. АРТ Ф-АЗТ был заменен на TDF в связи с анемией (неделя 0 – 126 г/л, 12-я нед. – 105 г/л, 24-я нед. – 86 г/л). Лишь у 2 (3%) больных через 60 нед. АРТ уровень Hb был < 110 г/л. У всех пациентов коррекция или изменение схемы АРТ не отразились на ее эффективности (РНК ВИЧ < 50 копий/мл).
Переносимость схемы АРТ была хорошей: – 92,5–95% пациентов никаких НЯ, связанных с терапией, не отмечали (рис. 2). В течение первых 4 нед. терапии частота НЯ была максимальной, что свидетельствовало об адаптации пациентов к режиму АРТ. Так, 18,4% больных предъявляли жалобы на чувство тошноты после приема Ф-АЗТ, а 17,3% – на головную боль и головокружение, вероятно, связанные с приемом ESV. Единичные пациенты предъявляли жалобы на сухость кожных покровов и кожный зуд. Эти НЯ были легкой степени и у большинства пациентов не требовали коррекции схемы АРТ или назначения дополнительной терапии. После 3 мес. лечения НЯ регистрировали у единичных больных. У 1 пациента через 12 нед. АРТ в связи с сохраняющимися жалобами на тошноту доза Ф-АЗТ была снижена до 200 мг 2 раза в сутки, после чего НЯ было полностью купировано. Через 36 нед. АРТ у 1 пациентки Ф-АЗТ заменен на TDF из-за тошноты, а еще у 2 пациентов схема АРТ изменена полностью (в одном случае из-за нарушений сна и памяти, во втором – в связи с тошнотой и головной болью). В течение первых 12 нед. лечения регистрировали небольшое снижение медианы содержания Hb: неделя 0 – 146 г/л, 12-я нед. – 135 г/л (в 6,5% случаев – менее 110 г/л). Через 24 и 48 нед. медиана уровня Hb увеличилась до 142 г/л, а к 60-й нед. – до 144 г/л. У 1 пациентки через 24 нед. АРТ Ф-АЗТ был заменен на TDF в связи с анемией (неделя 0 – 126 г/л, 12-я нед. – 105 г/л, 24-я нед. – 86 г/л). Лишь у 2 (3%) больных через 60 нед. АРТ уровень Hb был < 110 г/л. У всех пациентов коррекция или изменение схемы АРТ не отразились на ее эффективности (РНК ВИЧ < 50 копий/мл).
В табл. 2 представлена динамика медианы биохимических показателей и доли пациентов, у которых значения превышали верхнюю границу нормы (глюкоза, креатинин) или были повышены до 2–4-й степени токсичности (АсАТ, АлАТ, ГГТ). Существенных колебаний уровней креатинина, АсАТ и АлАТ в процессе лечения зарегистрировано не было. Отмечено некоторое увеличение уровня глюкозы и активности ГГТ, а также доли пациентов, у которых показатели были повышены (до 2–4-й степени токсичности), но в большинстве случаев эти отклонения не имели статистической достоверности. Лишь через 60 нед. АРТ средний уровень ГГТ повысился значимо (р = 0,044), при этом ни у одного пациента не было клинических проявлений панкреатита.
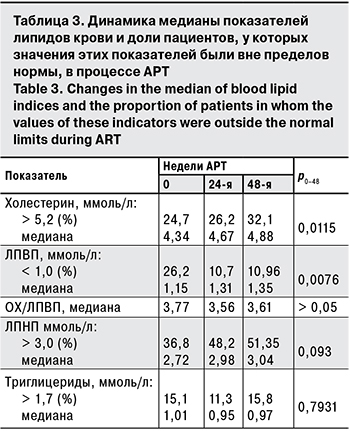 Показатели обмена липидов крови (ОХ и ЛПВП) существенно повышались к 60-й неделе терапии (табл. 3; р = 0,0115 и 0,0076 соответственно), однако эти изменения практически не отразились на значениях медианы индекса ОХ/ЛПВП: неделя 0 – 3,77, 60-я нед. – 3,61. Для коррекции изменений уровней липидов крови пациентам не потребовалось назначения липидоснижающих препаратов. Повышения медианы уровней ЛПНП и триглицеридов обнаружено не было.
Показатели обмена липидов крови (ОХ и ЛПВП) существенно повышались к 60-й неделе терапии (табл. 3; р = 0,0115 и 0,0076 соответственно), однако эти изменения практически не отразились на значениях медианы индекса ОХ/ЛПВП: неделя 0 – 3,77, 60-я нед. – 3,61. Для коррекции изменений уровней липидов крови пациентам не потребовалось назначения липидоснижающих препаратов. Повышения медианы уровней ЛПНП и триглицеридов обнаружено не было.
Заключение
Назначение отечественной схемы АРТ, включавшей Ф-АЗТ, 3ТС и ESV, больным ВИЧ-инфекцией было высокоэффективным в течение 60 нед. терапии. Через 48 и 60 нед. АРТ снижение уровня РНК ВИЧ < 50 копий/мл регистрировали у 95–100% пациентов, а прирост медианы количества CD4+-лимфоцитов составил 173 и 190 клеток/ мкл соответственно. При этом отмечено увеличение иммунорегуляторного индекса в 1,8 раза. Результаты эффективности схемы АРТ вполне сопоставимы с результатами, полученными в регистрационном исследовании при применении схемы ТDF + FTC + ESV. Через 48 нед. АРТ РНК ВИЧ < 50 копий/мл имела место у 91,7% больных, а медиана прироста количества CD4+-лимфоцитов составила 176 клеток/мкл [5]. Ни у одного пациента схема Ф-АЗТ + 3ТС + ESV не была изменена из-за неэффективности лечения. Большинство НЯ были выявлены в начале терапии, как правило, легкой степени и не требовали коррекции схемы лечения или назначения дополнительной терапии. При сохранении НЯ, связанных с приемом Ф-АЗТ, в течение 12 нед., возможно уменьшение его суточной дозы в 2 раза без снижения эффективности терапии. Только у 4 пациентов через 24–36 нед. АРТ схема была изменена частично (у 2 пациентов) или полностью, из-за развития НЯ, которые, возможно (вероятно), были связаны с получаемой терапией, при этом во всех случаях эффективность лечения сохранялась.
Изменения биохимических показателей крови у большинства пациентов были легкой степени и не требовали коррекции. Отмечена некоторая тенденция к повышению уровней глюкозы и ГГТ, а также показателей обмена холестерина. Поскольку в процессе исследования зарегистрировано повышение уровня не только ОХ, но и ЛПВП, значения индекса атерогенности практически не изменились. Развитие анемии легкой степени, связанное с приемом Ф-АЗТ, регистрировали у 6,5% больных преимущественно в течение первых 12 нед. лечения, что соответствует ранее опубликованным данным [7].
Таким образом, можно рекомендовать применение в схемах АРТ первой линии препарата ESV в комбинации не только с ТDF и FTC, но и с Ф-АЗТ и 3TC.


