Вирусные гепатиты с парентеральным типом заражения (острые и хронические) становятся серьезной международной медицинской проблемой, поскольку быстро распространяются в разных странах, трудны для выявления и чреваты тяжелым исходами [1]. Инфекция, вызванная вирусом гепатита С (HCV), является серьезной проблемой здравоохранения, поскольку в большинстве случаев (до 85%) приобретает хроническое течение и повышает риск развития цирроза печени (ЦП), гепатоцеллюлярной карциномы (ГЦК) и выраженных внепеченочных осложнений [2]. В РФ зарегистрировано около 5 млн граждан, инфицированных HCV, из них около 2 млн больны ХГС, и в 65% случаев это пациенты активного трудоспособного возраста от 30 до 50 лет [3]. В настоящее время считается, что каждый больной хроническим гепатитом С (ХГС) должен получить лечение, а успешное лечение снижает риск развития ЦП и ГЦК [4, 5]. По-прежнему актуален поиск таких схем лечения хронических вирусных гепатитов, которые бы сочетали в себе предельную дешевизну и отсутствие значимых побочных эффектов [6–8].
Цель данной работы – разработка модели прогнозирования ответа на терапию хронического гепатита С (ХГС) у детей и подростков.
Материалы и методы
В исследовании приняли участие 116 детей и подростков в возрасте от 3 до 18 лет, которые находились на лечении в детском инфекционном отделении ГКБ № 2 им. Н.А.Семашко (Самара) и не получали ранее противовирусной терапии (ПВТ). В нашем исследовании не было разделения на группы по возрастному признаку, так как общепринятый «Стандарт медицинской помощи больным хроническим гепатитом В, хроническим гепатитом С»1 не предусматривает различия в критериях диагностики, лечения, дозах и курсе препаратов для разных возрастов. Критериями отбора пациентов было установление диагноза ХГС, длительность наблюдения не менее 1 года. Кроме того, определяли показатели иммунного статуса: клеточного (СD3+, СD4+, СD8+, СD16+, СD95+, HLA-DR) и гуморального звеньев иммунитета (IgG, IgА, IgМ, ЦИК), цитокиновый профиль (ИЛ-1β, ИЛ-4, ИЛ-6, ИЛ-10, ФНО-α, ИФН-γ).
Были рассмотрены 2 варианта назначения ПВТ ХГС. В результате многофакторного регрессионного анализа подготовлена математическая модель для определения оптимального варианта терапии ХГС у детей, охватившая основные признаки заболевания пациентов.
Анализ проводили при помощи программ STATGRAPHICS Plus for Windows версии 4.0 и STATISTICA for Windows версии 8.0. Для оформления результатов применяли пакет программ Microsoft Office-2010. Достоверность различий между данными в группах проверяли на основе расчета t-критерия Стьюдента.
Результаты и обсуждение
116 больных ХГС были разделены на 2 группы (СI и СII) по 58 человек. На данном этапе исследования мы наблюдали 58 пациентов группы СI, получавших ПВТ с последующей оценкой эффективности. Согласно Протоколу (2010), каждый больной ХГС с виремией является потенциальным кандидатом для проведения противовирусного лечения, поэтому всем пациентам с положительным результатом анализа на РНК HCV была назначена ПВТ. Основная цель лечения – достижение устойчивого вирусологического ответа (УВО) (отсутствие РНК HCV в плазме крови через 12 и/или 24 нед. после завершения терапии), который обеспечивает снижение смертности и улучшение качества жизни пациентов, позволяя избежать затрат на лечение осложнений и остановить глобальную эпидемию HCV-инфекции [9, 10].
Стандартная ПВТ включала ИФН-α-2b и ребетол. Несмотря на создание высокотехнологичных препаратов для этиотропной терапии ХГС, ИФН-содержащие схемы не утратили актуальности в настоящее время, что находит отражение в действующих рекомендациях по лечению пациентов с ХГС [11, 12]. Оптимальная продолжительность лечения зависит от генотипа HCV: при инфицировании генотипом 1 продолжительность лечения составляет 48 нед., при генотипах 2 и 3 – 24 нед. Если через 24 нед. лечения больные с генотипами 2а и 3а не достигли УВО, комбинированная ПВТ, включающая рекомбинантный ИФН-α-2b в дозе 3 млн МЕ 3 раза в неделю и ребетол 15 мг/кг/сутки в 2 приема (утром и вечером), была продлена до 48 нед.
На фоне ПВТ у абсолютного большинства детей проявлялись нежелательные явления (НЯ), которые, согласно литературным данным, при интерферонотерапии наблюдаются довольно часто (см. рисунок).
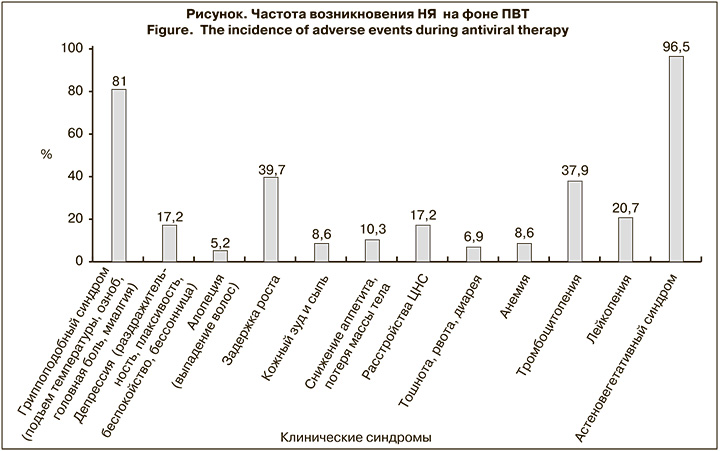
Были установлены высокая частота и степень выраженности побочных эффектов интерферонотерапии ХГС у детей, что в ряде случаев обусловливало необходимость коррекции дозы препаратов [13]. Среди НЯ наблюдали гриппоподобный (81%) и астеновегетативный (96,5%) синдромы. Гриппоподобный синдром (лихорадка) купировался приемом нестероидных противовоспалительных средств и не требовал отмены ПВТ. Среди прочих НЯ у детей отмечали изменения кожных покровов (сухость, зуд, покраснение в месте инъекций), тошноту, рвоту, диарею. Побочные явления ПВТ у большинства детей были обратимы, при возникновении необратимых НЯ больных исключали из исследования. В этой группе пациенты с высокой степенью репликации HСV (от 2 000 до ≥ 20 000 МЕ/мл) составили 72,4%, с низкой степенью (менее 2 000 МЕ/мл) – 27,6%. Результаты применения стандартной схемы ПВТ у детей представлены в табл. 1.
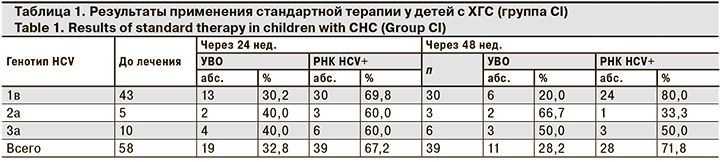
Больным с генотипами HСV 2а и 3а, достигшим УВО через 24 нед., ПВТ не продолжали. 13 (30,2%) больным с генотипом HСV 1в и УВО продлили лечение до 48 нед. При отсутствии эффекта от этиотропной терапии через 24 нед. всем пациентам были назначены ПэгИФН-α-2 и ребетол в течение еще 24 нед. Через 48 нед. после окончания стандартной терапии УВО был достигнут суммарно у 30 (51,7%) больных.
В обеих группах мы наблюдали снижение частоты клинических симптомов, однако при достижении полного вирусологического ответа этот процесс был более выражен.
Вне зависимости от ответа на ПВТ в обеих группах достоверно снижалась активность АЛТ и АСТ, их уровень оставался повышенным только у 9 (32,1%) больных с РНК HCV+ и у 3 (10,0%) – с РНК HCV- после ПВТ.
После проведения лечения высокая степень репликации была выявлена у 27,1% пациентов, низкая – у 21,2%; у 51,7% больных РНК HCV не обнаружена.
Проведенные исследования показали, что при ХГС в половине случаев стандартная ПВТ не позволяет достичь отрицательного результата теста на РНК HCV, несмотря на улучшение клинической симптоматики и биохимических показателей. Это создает предпосылки для прогрессирования воспалительного процесса в печени и развития осложнений. Очевидно, для достижения лучшего эффекта в ряде случаев необходимо интенсифицировать стандартную схему терапии.
В группе из 25 детей, больных ХГС, до начала ПВТ было исследовано состояние иммунной системы, определены показатели клеточного и гуморального звеньев иммунитета, а затем проанализированы результаты лечения в зависимости от показателей иммунного статуса.
При анализе иммунограммы мы определили дисбаланс хелперного и супрессорного звеньев иммунитета. Отмечено угнетение Т-клеточной системы иммунитета. Повышение показателей иммуноглобулинов является признаком нарушения функциональной способности печени.
Для характеристики иммунного ответа у больных детей был изучен спектр цитокинов. Повышенное содержание провоспалительных цитокинов ФНО-ά (16,9 ± 5,78 пг/мл) и ИЛ-6 (35,0 ± 3,16 пг/мл) и снижение уровня противовоспалительного цитокина ИФН-γ (1,81 ± 0,38 пг/мл) свидетельствуют об изменении соотношения Th-1/Th-2-лимфоцитов с преобладанием Th-2-типа, что подтверждает длительное нахождение вируса в организме, которое приводит к хронизации процесса. Отклонение показателей, характеризующих нарушения в иммунной системе при ХГС, наблюдалось у 62,1% больных, а изменения цитокинового профиля – у 70,6%.
В настоящее время установлен целый ряд факторов, позволяющих прогнозировать ответ на терапию и контролировать естественное течение болезни, что, безусловно, расширяет возможности успешного лечения [14]. Мы постарались спрогнозировать оптимальный вариант терапии ХГС у детей и подростков. Использование предложенного дифференцированного подхода к назначению лечения позволяет достоверно увеличить количество ранних вирусологических ответов и уменьшить вероятность развития ЦП. У детей в группе СII были обнаружены нарушения в иммунной системе, из которых выделили наиболее значимые для компьютерной программы показатели.
В результате многофакторного регрессионного анализа (Multiple regression) была разработана математическая модель, охватившая основные признаки ХГС у обследованных. При построении модели были сохранены коэффициенты с доверительной вероятностью ≥ 0,95 или с уровнем значимости р < 0,05. Отбор эффектов проводили по F-критерию Фишера с достоверностью р < 0,05. Было задано значение F = 2,5.
Наиболее значимым является цитокин ИЛ-1 (F = 3,83), затем идут показатели АЛТ (F = 2,93), ИЛ-10 (F = 2,46), ЦИК (F = 1,99), СD8+ (F = 1,77), ФНО-α (F = 1,61).
Модель можно представить в виде уравнения регрессии:
ПП = 7,44 + P1 х 0,045 – P2 х 0,33 + P3 х 0,066 + P4 х 0,0021 – P5 х 0,19 – P6 х 0,15,
где ПП – прогностический показатель;
P1 – ИЛ-1; P2 – АЛТ; P3 – ИЛ-10; P4 – ЦИК; P5 – СD8+; P6 – ФНО-α.
При значении < 2,5 вероятен положительный эффект схемы терапии ИФН-α-2b + ребетол, а при значении > 2,5 – отрицательный. В этом случае назначают ПегИФН-α-2b + ребетол. В соответствии с величиной ПП группа СII была разделена на 2 подгруппы – СIIа и СIIв. В подгруппе СIIа (п = 25) ПП составил < 2,5. Генотип 1в был выявлен у 17 (29,3%) больных, 3а – у 5 (8,6%), 2а – у 3 (5,2%).
В этой подгруппе астеновегетативный синдром встречался в 39,8% случаев, диспепсический – в 22,7%, болевой – в 36,1%, гемморагический – в 7,9%, гепатомегалия – в 63,8%.
Уровень АЛТ у больных в подгруппе СIIа составил в среднем 1,62 ± 0,54 ммоль/л (р < 0,05). Следует отметить, что до начала ПВТ этот показатель был ниже, чем в группе СI (3,73 ± 0,87 ммоль/л; р < 0,05).
В расчет результирующей математической модели были включены следующие средние показатели, полученные до начала ПВТ при обследовании детей подгруппы СIIа: ИЛ-1 – 14,7 ± 1,8 пг/мл (р < 0,01); ИЛ-10 – 33,9 ± 2,5 пг/мл (р < 0,01); ЦИК – 109,1 ± 6,7 мкг/мл (р < 0,01); СD8+ – 21,9 ± 1,2% (р < 0,01); ФНО-α – 12,5 ± 1,23 пг/мл (р < 0,01). В группе СI – соответственно: ИЛ-1 – 21,9 ± 2,8 пг/мл (р < 0,01); ИЛ-10 – 42,5 ± 3,1 пг/мл (р < 0,01); ЦИК – 131,8 ± 7,4 мкг/ мл (р < 0,01); СD8+ – 18,5 ± 1,1% (р < 0,01); ФНО-α – 16,9 ± 5,78 пг/мл (р < 0,01).
Результаты дифференцированной терапии у детей с ХГС представлены в табл. 2.

Больным подгруппы СIIа была назначена ПВТ: ИФН-α-2b + ребетол в течение 24 нед. Пациенты, не достигшие УВО, продолжили терапию ПэгИФН-α-2b + ребетол в течение еще 24 нед.
В подгруппе СIIв (п = 33) ПП был > 2,5. У этих больных прогнозировали вероятность достижения УВО, им сразу назначали ПэгИФН-α-2b + ребетол. Пациенты обеих подгрупп продолжили прием препаратов до 48 нед.
Всего в подгруппе СIIа через 48 нед. больные с УВО составили 37,9%, в подгруппе СIIв – 43,1%.
Через 48 нед. стандартной терапии неопределяемую вирусную нагрузку (РНК HСV-) имели 30 (51,7%) больных, после дифференцированной терапии – 47 (81,0%).
Заключение
Таким образом, согласно результатам проведенного анализа, более оптимальным вариантом ПВТ ХГС у детей и подростков является дифференцированная терапия, в которой используются прогностические показатели предложенной математической модели. Эффективность такой терапии по сравнению со стандартной схемой лечения составляет 29,3%.
Применение дифференцированного подхода к назначению ПВТ при ХГС является не только клинически, но и экономически целесообразным и обоснованным.


