В последние годы в мире отмечается рост количества антибиотикорезистентных штаммов, в том числе относящихся к Staphylococcus aureus [1, 2]. Согласно материалам IX (2016) и X (2017) Всероссийских конгрессов инфекционистов, в Российской Федерации выявлено большое число пациентов с бактериальными инфекциями (до 75–90% от общего числа пациентов), ситуация осложняется трудностью подбора антибактериальной терапии в осложненных случаях, возрастающей долей больных с тяжелой сопутствующей патологией. Кроме того, с 2010 г. зарегистрирована новая волна инфекционных заболеваний, вызванных грамположительными бактериями Staphylococcus aureus, причиной которой, по-видимому, является снижение популяционного иммунитета жителей Российской Федерации1. Мультирезистентность, наблюдаемая у бактерий, свидетельствует о том, что при эволюции в направлении устойчивости к одному препарату происходит отбор по резистентности ко многим лекарствам. Устойчивость к антибиотикам продолжает распространяться не только среди внутрибольничных патогенов, но и среди некоторых видов микроорганизмов, заражение которыми происходит при обычных социальных контактах [2, 3].
Цель исследования – изучение антибиотикочувствительности и особенностей персистентного потенциала бактериальных культур Staphylococcus aureus, выделенных при острых кишечных заболеваниях у детей и взрослых.
Материалы и методы
Было проанализировано 236 историй болезни взрослых и 559 историй болезни детей в возрасте от 3 до 11 лет, поступивших в ГБУЗ «Центр по борьбе со СПИДом и другими инфекционными заболеваниями» Минздрава Кабардино-Балкарской Республики (Нальчик) с диагнозом «острый энтероколит». Все пациенты поступили на 1–3-й день болезни с диспепсическим синдромом и синдромом интоксикации разной степени выраженности. В большинстве случаев в эпидемиологическом анамнезе был указан пищевой путь заражения. Посев кала на дизентерийную группу, сальмонеллез и условно патогенную флору с определением чувствительности к антибиотикам проводили в приемном отделении до назначения антибактериальной терапии.
Выделение бактерий из исследуемого материала и их идентификацию производили общепринятыми бактериологическими методами. Чувствительность микроорганизмов к антимикробным препаратам оценивали в соответствии с МУК 4.2.1890.-042. Была исследована чувствительность к препаратам пенициллинового ряда, цефалоспоринам, макролидам, тетрациклинам, фторхинолонам.
Для характеристики персистентного потенциала выделенных в 2017 г. штаммов исследовали антилизоцимную, каталазную и супероксиддисмутазную активности. Антилизоцимную активность (АЛА) бактерий изучали по методу О.В. Бухарина [4, 5]. Для оценки уровня АЛА были приняты следующие критерии: низкий уровень АЛА – 1–2мкг/ мл, средний – 3–5мкг/мл, высокий – свыше 5 мкг/мл. Активность каталазы штаммов S. aureus определяли спектрофотометрическим методом. К 0,2 мл взвеси S. saureus, стандартизованной до оптической плотности 0,2 усл. ед., добавляли 1 мл свежеприготовленного 0.0125М раствора Н2О2 и инкубировали 10 мин при комнатной температуре. Реакцию разложения Н2О2 каталазой бактерий останавливали добавлением 20 мкл 2Н раствора HCl. Затем добавляли 0,5 мл свежеприготовленного 0,025М раствора KI, тщательно перемешивали и осаждали клетки S. aureus центрифугированием в течение 15 мин при 3000 g, после чего измеряли оптическую плотность не позднее чем через 10 мин после центрифугирования. Активность каталазы бактерий оценивали по калибровочной кривой, полученной с использованием коммерческого препарата каталазы (Sigma, США). Для определения супероксиддисмутазной активности штаммов Staphylococcus aureus использовали метод, основанный на образовании адренохрома при автоокислении адреналина, которое регистрировали по образованию адренохрома при 480 нм. Стандартные определения проводили в 3 мл 0,05М Na-карбонатного буфера (рН 10,2), содержащего 10-4 М ЭДТА (Sigma, США), 50 мкл суспензии бактерий, доведенной до оптической плотности 0,2 (соответствует 1,5 млн клеток/мл), или раствора коммерческой СОД (Sigma, США) в сантиметровой кювете, термостатируемой при 25 оС. Реакцию начинали с добавления 50 мкл 10-2 М раствора адреналина (Sigma, США). Пробы непрерывно спектрофотометрировали при 480 нм в течение 3 мин при комнатной температуре. Активность СОД штаммов Staphylococcus aureus оценивали по калибровочной кривой, полученной с использованием коммерческого препарата СОД, с учетом разведений всех образцов.
Для статистической обработки результатов исследований применяли расчет средних значений и доверительный интервал, рассчитанные по данным n измерений. Доверительный интервал оценивали с использованием t-критерия Стъюдента для р < 0,05.
Результаты и обсуждение
Введение в практику каждого нового антибиотика, действующего на возбудителей инфекционных заболеваний, приносит временный успех. Кишечные инфекции стафилококковой этиологии остаются одними из наиболее распространенных в структуре инфекционных заболеваний, в то же время штаммы стафилококков являются наиболее изменчивыми в отношении целого ряда антибиотиков [2, 3].
Обнаружено, что штаммы Staphylococcus aureus, выделенные у взрослых, достаточно чувствительны к цефалоспоринам, тетрациклинам, фторхинолонам (табл. 1). В то же время обращает на себя внимание постепенное снижение числа штаммов, чувствительных к амоксициллину и азитромицину. Схожая динамика выявлена и у детей с диагнозом «острое кишечное заболевание». Так как применение фторхинолонов у детей имеет ограниченный характер [6], препаратами выбора в 82,8–93,7% случаев остаются цефалоспорины. К препаратам пенициллинового ряда чувствительны 54,4% штаммов S. aures, и только у 52,9% штаммов выявлена чувствительность к азитромицину.
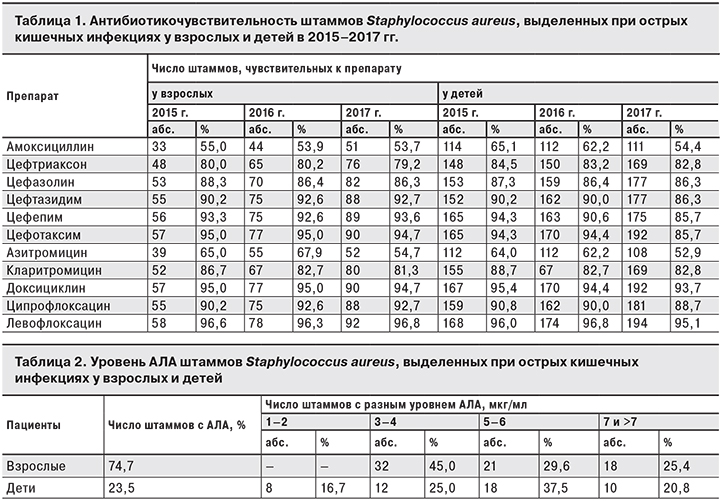
В хронизации инфекционного заболевания ведущая роль принадлежит свойствам микроба, в частности, его персистентному потенциалу [4, 5]. Взаимодействие микроорганизма с лейкоцитом является одним из ключевых звеньев в патогенезе инфекционных заболеваний. АЛА обладало 74,7% (71 культура из 95 изолятов) штаммов, выделенных у взрослых, и 23,5% (48 штаммов из 204) – у детей. Чаще встречались культуры со средними показателями АЛА (табл. 2).
Одним из способов выживания стафилококков в процессе фагоцитоза, является синтез антиоксидантных ферментов. Каталазной активностью обладали 100% штаммов, выделенных у взрослых, и 34,3% штаммов, выделенных у детей. При этом штаммы, выделенные у взрослых, были достоверно более каталазоактивными (2,9 ± 0,5 и 1,1 ± 0,5 ед/20 млн бактерий соответственно). Следовательно, бактериальные штаммы S. aureus, выделенные у взрослых, обладают более выраженной способностью противостоять видовому иммунитету, что создает условия для хронизации инфекционного заболевания.
Заключение
Изменившаяся чувствительность микроорганизмов, тем не менее, определяет общие препараты выбора для лечения инфекций, вызванных S. aureus у детей и взрослых. Обращает на себя внимание практически идентичная чувствительность возбудителя к цефалоспоринам I и III поколения, что создает новые возможности использования уже «забытого» цефазолина для лечения стафилококковых инфекций.
Высокий персистентный потенциал стафилококка у взрослых, по-видимому, связан с вторичными иммунодефицитными состояниями, чаще развивающимися у этой группы пациентов. Внедрение в практику клинико-микробиологической службы методов оценки персистентного потенциала возбудителей бактериальных инфекций позволит прогнозировать риски хронизации инфекционного процесса и своевременно усиливать этиотропную терапию, в том числе специфическими биологическими препаратами, в частности, бактериофагами, применение которых может привести к полной санации.
Еще раз хочется обратить внимание на необходимость контроля за антибиотикорезистентностью не только в рамках целой страны или области, но и в отдельно взятых специализированных стационарах для создания внутренних протоколов этиотропной терапии бактериальных инфекций. Подобные исследования представляют интерес для практического здравоохранения при обосновании разных схем и протоколов лечения инфекционных заболеваний как у взрослых, так и у детей, так как одним из приоритетных направлений борьбы с инфекционной патологии являются поиск и внедрение высокоэффективных антибактериальных средств для оптимизации терапии.


