В 1942 г. М.Д. Итон сообщил о некоем инфекционном агенте, предположительно являющемся вирусом, вызывающим атипичную пневмонию у людей. Он проводил экспериментальные заражения крыс, материалом от больных атипичной пневмонией. Позднее, в 1962 году R. Chenock и соавт. выделили чистую культуру Mycoplasma pneumoniae (M. pneumoniae). В последующем, благодаря культивированию в бесклеточной среде, содержащей 2,5% дрожжевого экстракта и 20% лошадиной сыворотки, возбудитель был идентифицирован как бактерия. Однако, для признания «агента Итона» причиной атипичной пневмонии потребовалось почти 20 лет [1].
Некоторые представители рода Mycoplasma патогенны для человека. Mycoplasma genitalium вызывает поражение мочеполовой системы; Mycoplasma pneumoniae – поражение респираторного тракта. Однако, большинство их являются условно-патогенными. К ним относятся M. buccale, M. hominis, M. urealiticum, M. faucium и т.д. [2].
В зависимости от вида возбудителя и топики поражения, согласно МКБ-10, различают такие варианты микоплазменной инфекции, как: J20.0 Бронхит, вызванный Mycoplasma pneumoniae; J15.7 Пневмония, вызванная Mycoplasma pneumoniae; В96.0 Mycoplasma pneumoniae, как причина болезней, классифицированных в других рубриках и А49.3 Инфекция, вызванная микоплазмой, неуточненная. В клинической практике инфекции, вызванные Mycoplasma pneumoniae, протекающие с поражением различных отделов респираторного тракта, ряд авторов объединяют термином «респираторный микоплазмоз» (РМ) [3]. Кроме того, выделяют микоплазмоз урогенитального тракта, внутриутробный микоплазмоз и другие редкие формы заболевания (гемолитическая анемия, поражение ЦНС, ДВС-синдром, перикардит и т. д.). Инфекция, вызванная M. pneumoniae, протекает в различных клинических формах: как с респираторными симптомами, так и внелегочными проявлениями (менингоэнцефалит, синдром Гийена–Барре, миокардит, нефрит, синдром Стивенса–Джонсона и т. д.), связанными с аутоиммунными реакциями и прямой инвазией возбудителя [4]. Число детей с тяжелой микоплазменной пневмонией с каждым годом увеличивается. Тяжелое течение пневмонии по-прежнему остается одной из основных причин смерти детей в возрасте до 5 лет в развивающихся странах, особенно среди детей грудного и раннего возраста [5].
РМ является одной из наиболее частых причин стойкого кашля и рецидивирующих респираторных инфекций у детей [5]. Существует связь обострений бронхиальной астмы у детей с инфицированием M. pneumoniae [6]. По данным проведенного в 2021 г. метаанализа [7], РМ рассматривается в качестве возможного фактора риска возникновения и прогрессирования бронхиальной астмы.
Для микоплазменной инфекции, протекающей с поражением органов респираторного тракта, характерен ежегодный эпидемический подъем в осенне-зимний период. Наибольшее число заболеваний приходится на период с октября по февраль, но в организованных коллективах эпидемические вспышки могут возникать и летом. Для Европейского региона характерен эпидемический подъем заболеваемости каждые 3–4 года. В связи с внедрением ограничительных мер во время пандемии COVID-19 отмечалось снижение заболеваемости. Это произошло благодаря разобщению детских коллективов в садах и школах, а также использованию средств индивидуальной защиты. Таким образом, передача инфекции предупреждалась и уровень циркуляции возбудителя в популяции снизился. Однако спустя 4 года, прошедшие с начала пандемии, существует вероятность эпидемического подъема [8]. По данным BIOFIRE Diagnostics 2023, за период с февраля 2021 по июнь 2023 г. наблюдались подъемы заболеваемости РМ в июле 2021 г., июле 2022 г., январе 2023 г. [9].
В период пандемии COVID-19 бактериальные осложнения были одной из основных причин смертности, поэтому ко-инфекции M. pneumoniae и SARS-CoV-2 как у взрослых, так и у детей в настоящее время является предметом изучения [10–11].
Опубликованы данные о том, что из 174 детей с COVID- 19, госпитализированных в отделение детской больницы Ухани, ко-инфекция с M. рneumoniae была подтверждена в 32% случаев [12].
Ряд исследований продемонстрировали, что ко-инфекция M. pneumoniae и коронавирус SARS-CoV-2 связана с более тяжелым течением заболевания, повышением уровня прокальцитонина и, как следствие, с более высокой смертностью [13].
Сложность клинической диагностики связана с неспецифическими проявлениями заболевания. Известно, что такие клинические признаки, как головная боль и одышка, указывают на инфекцию, вызванную M. pneumoniae [14], однако на основании клинических симптомов или рентгенологических признаков достоверно говорить о микоплазменной инфекции невозможно [15]. Подтверждение лабораторными методами имеет ряд особенностей. Диагностика инфекции, вызванной M. pneumoniae, складывается из клинических проявлений, данных рутинного лабораторно-инструментального обследования, и специальных методов, направленных на верификацию этиологии заболевания. К прямым методам, с помощью которых происходит выделение непосредственно M. pneumoniae, генетического материала или антигенов относятся: ПЦР, реакция непрямой иммунофлуоресценции и бактериологический метод, который крайне трудоемок и неприменим в рутинной практике из-за сложного состава культуральной среды. К косвенным методам, основанным на определении уровня специфических антител к возбудителю, относятся иммуноферментный анализ, реакция агрегатгемагглютинации. «Золотым стандартом» является выделение ДНК возбудителя методом ПЦР в материале от больного. Однако, исследование крови методом ПЦР малоинформативно, так как инфекция, вызванная M. pneumoniae, имеет короткий период антигенемии. При исследовании мазков из ротоглотки, детекция микоплазмы возможна и при здоровом носительстве [10]. Исследование материала аспиратов из нижних дыхательных путей методом ПЦР является наиболее информативным, но травматичным методом, поэтому не всегда оправдан при среднетяжелом течении инфекции и неосуществим в амбулаторных условиях.
Выявление M. pneumoniae в разных странах прямыми методами в период с апреля 2020 по март 2021 г. было значительно ниже уровней неэпидемических периодов РМ. Однако снижения случаев регистрации M. pneumoniae непрямыми методами (исследования уровней специфических антител) после введения ограничительных мер не наблюдалось. Это объясняется длительным характером циркуляции антител против M. pneumoniae (IgM и IgG) и подтверждает более высокую точность непрямых методов диагностики в случае инфекции, вызванной M. pneumoniae. Специфические антитела к M. pneumoniae сохраняются в течение месяцев или лет после заражения и значительно дольше, чем ДНК M. pneumoniae в верхних дыхательных путях [16].
Длительность обнаружения ДНК M. pneumoniae в мазках из ротоглотки составляет в среднем 4–7 нед., но может увеличиваться и до 2–3 мес. IgМ выявляются не ранее 7-го дня, циркулируют до 6 нед. У детей раннего возраста в ряде случаев наработка специфических IgM не происходит или они появляются поздно. IgG появляются на 2–3-й неделе от начала болезни, длительно сохраняются на низком уровне [4]. Для подтверждения этиологии непрямым методом необходимо использовать парные сыворотки для выявления четырехкратного нарастания уровня IgG. В связи с этим в настоящий момент для верификации этиологического диагноза необходимо использовать сочетание прямых и непрямых методов исследования.
Несвоевременная диагностика инфекции, вызванной M. pneumoniae, приводит к увеличению как числа, так и длительности курсов антибактериальной терапии. Стартовое назначение бета-лактамных антибиотиков детям с ВП микоплазменной этиологии способствует развитию у них антибиотик-ассоциированного синдрома, а также приводит к формированию устойчивости возбудителей респираторных инфекций к антибактериальным препаратам.
Для лечения заболеваний, вызванных внутриклеточными возбудителями, применяют препараты из групп фторхинолонов (противопоказаны до 18 лет), тетрациклинов (разрешены в педиатрической практике с 8 лет) и макролидов (являются препаратами выбора). Широкое использование антибактериальных препаратов (АБП) из группы макролидов в Китае привело к высокому уровню резистентности M. pneumoniae к ним, что способствовало увеличению уровня смертности в последние годы. Резистентные к макролидам штаммы ассоциированы с большим количеством внелегочных осложнений, и более тяжелым клиническим течением и увеличением длительности госпитализации [17].
В постпандемийный период актуальна разработка методик для определения чувствительности M. pneumoniae к противомикробным препаратам, недоступная сейчас в повседневной клинической практике.
Существует перспектива разработки и внедрения специфической профилактики инфекций, вызванных M. pneumoniae. Наиболее изученными являются инактивированные, живые аттенуированные, субъединичные и ДНК-рекомбинантные вакцины для подкожного и интраназального введения. Перспективными вариантами считаются вакцины на основе белков адгезии микоплазмы (Р30, Р116 и Р1). Однако и они в настоящий момент имеют ряд недостатков: низкий уровень иммуногенности, необходимость многократной иммунизации и возможность развития иммунных нарушений при повторном заражении M. pneumoniae [12]. Исследования в этом направлении ведутся учеными разных стран [18–22].
Существует необходимость международной стандартизации (метод лабораторного подтверждения и клинические критерии) определения случая инфекции M. pneumoniae. На данный момент нет международных руководств по требованиям к эпиднадзору за этой инфекцией. Существуют отчеты о зарегистрированных случаях инфекции, вызванной M. pneumoniae, на основании данных национальных референс-лабораторий (Великобритания), в некоторых странах осуществляется национальный эпиднадзор (Дания) [19]. В Российской Федерации на данный момент статистический учет и анализ заболеваемости РМ находятся на этапе совершенствования.
Таким образом, дальнейшее изучение инфекции, вызванной M. pneumoniae у детей в постпандемийный период является актуальной проблемой педиатрии и инфектологии.
Исходя из вышеизложенного, целью нашего исследования явилось изучение клинического течения РМ у детей в возрасте от 5 мес. до 16 лет, госпитализированных в детское инфекционное отделение Химкинской областной больницы (ДИО ХОБ). Верификацию диагнозов «J20.0 Бронхит вызванный Mycoplasma pneumoniae», «J15.7 Пневмония, вызванная Mycoplasma pneumoniae», «В96.0 Mycoplasma pneumoniae, как причина болезней, классифицированных в других рубриках» проводили на основании клинической картины заболевания и выявления специфических IgM к M. pneumoniae в сыворотке крови пациентов.
Материалы и методы
Обследовано 74 ребенка, госпитализированных с острой респираторной инфекцией (ОРИ), вызванной M. pneumoniae, за период с января по июнь 2023 г. Основную группу составили 42 ребенка с внебольничной пневмонией (ВП) микоплазменной этиологии, медиана (Ме) возраста в этой группе составила 4,5 года. В группу сравнения вошли 32 ребенка с РМ, протекающим по типу ОРИ (острые бронхиты в том числе с обструктивным синдромом – 84,4% случаев; острые ларинготрахеиты в том числе со стенозом гортани – 15,6%), Ме возраста составила 3 года. Помимо рутинного лабораторно-инструментального обследования, всем детям проводили исследование крови на уровень специфических IgM и IgG к M. pneumoniae методом ИФА–БЕСТ («Вектор-Бест», Россия). Статистический анализ проводили с использованием программы StatTech v. 3.1.8 (разработчик – ООО «Статтех», Россия).
Результаты
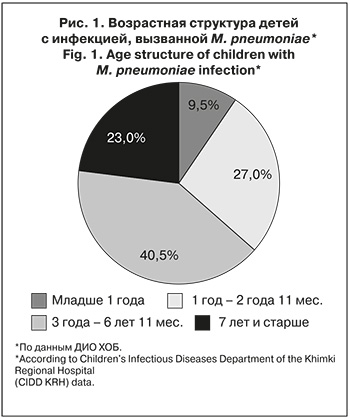
Среди обследованных детей доля пациентов с ВП микоплазменной этиологии составила 56,8%, а по типу ОРИ заболевание протекало у 43,2%.
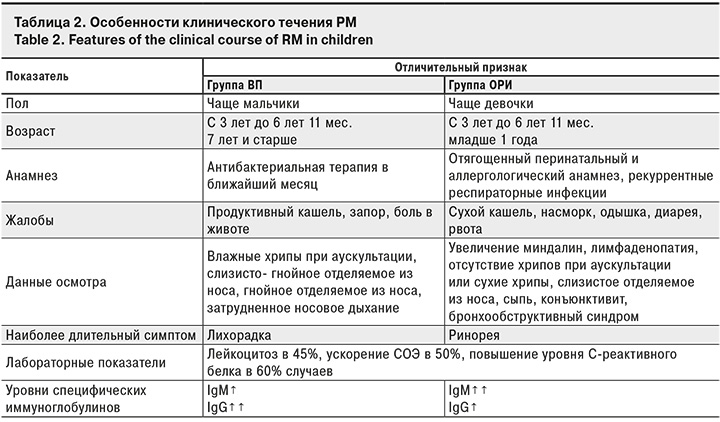
Инфекцией, вызванной M. pneumoniae, протекающей по типу ОРИ, мальчики болели в 1,5 раза чаще, чем девочки (62,5 и 37,5%; р = 0,203). ВП, вызванная M. pneumoniae, несколько чаще встречалась у девочек (52,4 и 47,6%; р = 0,203). Чаще РМ болели дети в возрасте от 3 лет до 6 лет 11 мес. как в группе ВП, так и ОРИ соответственно (43,7% и 38,0% соответственно).
Важно отметить, что у пациентов младше 1 года преобладал РМ по типу ОРИ (18,8 и 2,4%; р = 0,009), а в возрастной группе 7 лет и старше – РМ по типу ВП (31,0 и 12,5%; р = 0,009). Ме возраста в группе ВП составила 4,45 года, в группе ОРИ – 3,0 года (p = 0 ,019).
Мы проанализировали ранний анамнез в обследованных группах. Перинатальный и аллергологический анамнез были отягощены в большей степени у детей из группы ОРИ: соответственно 22,6 и 16,7% (р = 0,560) и 28,1 и 14,3% (р = 0,664). У детей в обеих группах было указание на рекуррентные респираторные инфекции (9,4 и 7,1%; р = 1,000) и наличие предшествующей антибактериальной терапии в ближайшем месяце (15,6 и 16,7%; р = 1,000).
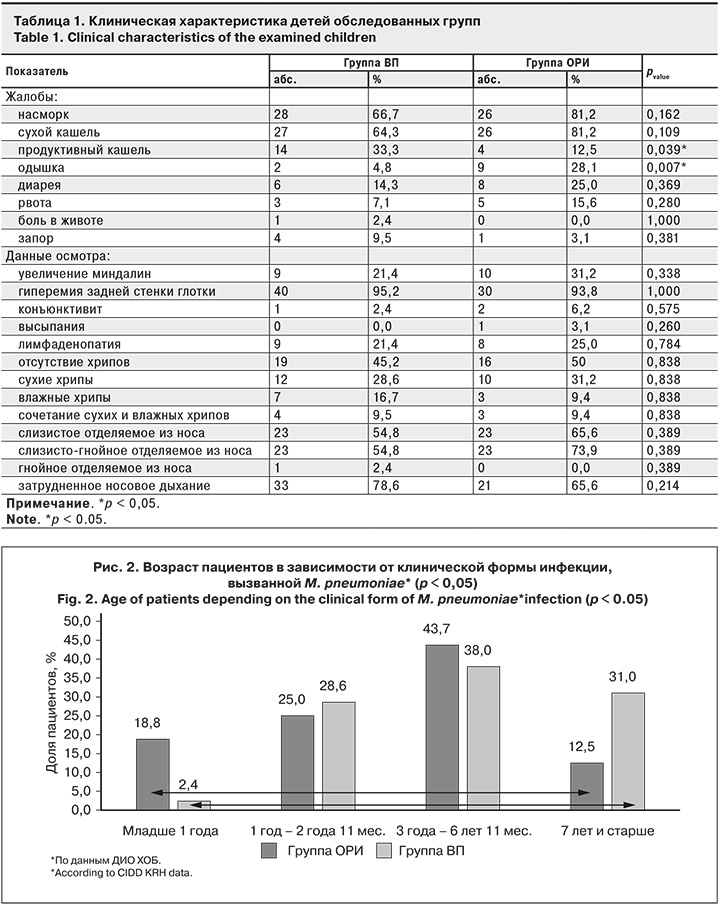
В группе ВП достоверно чаще регистрировали жалобы на продуктивный кашель (33,3 и 12,5%; р = 0,039), в группе ОРИ – на одышку (28,1 и 4,8%; р = 0,007). Бронхообструктивный синдром чаще регистрировали в группе ОРИ (25,0 и 2,4%; р = 0,004. Клиническая характеристика обследованных детей представлена в табл. 1.
Длительность лихорадки была выше в группе ВП: Ме составила 5,0 дней, в группе ОРИ – 4,0 дня (р = 0,153). Средняя длительность кашля в обеих группах составила 11 ± 5 дней (р = 0,818). Длительность ринореи была выше в группе ОРИ: Ме – 8,0 дней против 7,0 дней в группе ВП (р = 0,285). Дети с ВП находились в отделении дольше, в среднем 7 ± 2 дня, дети с ОРИ – 6 ± 2 дня (р = 0,064).
Результаты рутинного лабораторного исследования в группах ВП и ОРИ были сопоставимы: частота лейкоцитоза – 45,2 и 40,6% (р = 0,256), повышение СОЭ – 50,0 и 40,6% (р = 0,423), уровня С-реактивного белка – 59,5 и 56,2% (р = 0,625).
При оценке уровня специфических иммуноглобулинов к M. pneumoniae установлено, что Ме уровня IgM в группах ВП и ОРИ также была сопоставима и составила 1,9 и 1,83 УЕ соответственно (р = 0,844). Ме уровня IgG была выше в группе ВП по сравнению с ОРИ (0,14 и 0,08 УЕ; р = 0,081). Выявленные изменения, по нашему мнению, связаны с более длительным сроком инфицирования до установления этиологии заболевания. Представленные данные демонстрируют сложности этиологической верификации диагноза РМ.
Обсуждение
В ходе исследования установлено, что дети, перенесшие РМ по типу ВП, были старше, чем дети из группы ОРИ. В литературе также отмечены клинические особенности течения инфекции, вызванной M. pneumoniae, в зависимости от возраста. O. Gordon и соавт. [20] считают, что для развития ВП микоплазменной этиологии по сравнению с ОРИ наиболее характерен возраст пациентов от 6 лет и старше (66 и 52%; p = 0,009), в то время как дети младше 6 лет чаще переносили микоплазменную инфекцию по типу ОРИ (37 и 25%; p = 0,017). По данным С.А. Царьковой и соавт. [21], 89,3% детей с ВП микоплазменной этиологии были старше 5 лет, а 10,7% – младше (р < 0,05). По данным M. Almasri и соавт. [22], у детей младше 3 лет был зарегистрирован только 1 случай пневмонии, вызванной M. pneumoniae (1,1% от 15 случаев пневмонии). Статистически значимо более высокая доля случаев пневмонии, вызванной M. pneumoniae, была выявлена у детей в возрасте 8–14 лет (16,3%). По результатам исследования В. Biljana Medjo и соавт. [14], 75% детей с ВП микоплазменной этиологии относились к возрастной группе старше 5 лет, а 25% были младше 5 лет (р < 0,05). Представленные данные подтверждают и результаты нашего исследования.
Ряд материалов свидетельствует о том, что и микоплазменная инфекция и по типу ОРИ (острый назофарингит, трахеит, острый стенозирующий ларинготрахеит, острый бронхит, в том числе с обструктивным синдромом), и по типу ВП протекают с одновременным поражением верхних и нижних дыхательных путей. По данным Т.В. Спичак [3], изолированное поражение верхних дыхательных путей наблюдается реже, чем одновременное вовлечение в воспалительный процесс и верхних, и нижних дыхательных путей (35,2 и 64,8% соответственно). В наших наблюдениях в группе ОРИ 43,2% составлял такие нозологические формы РМ, как острый ларинготрахеит, в том числе со стенозом гортани, и острый бронхит, в том числе с обструктивным синдромом. В клиническом течении заболевания для детей в обеих группах были также характерны симптомы поражения верхних дыхательных путей.
В литературе обсуждается гендерная характеристика пациентов с РМ. По данным ряда авторов [11, 17], микоплазменную инфекцию с поражением органов респираторного тракта регистрируют у мальчиков в 1,8 раза чаще, чем у девочек. Данные других исследований этого не подтверждают [16]. По нашим данным, суммарно мальчиков было несколько больше, чем девочек (54,1 и 45,9%; р = 0,203). Однако в группе детей с РМ, протекающим по типу ОРИ, мальчиков было в 1,5 раза больше (62,5 и 37,5%; р = 0,203).
Резистентность M. pneumoniae к макролидам увеличивается во всем мире, в особенности в странах Азии. T.Т. Jiang и соавт. [23] опубликовали данные об уровне резистентности M. pneumoniae к макролидам, достигающем 92,7% в Китае (г. Баодин). Особое значение этот факт приобретает в постпандемийный период. Сообщалось, что общий уровень применения антибиотиков у детей с ВП в Китае составил 89,08%, при этом макролиды наиболее часто использовали в качестве препаратов первой линии для лечения ВП микоплазменной этиологии [24].
По нашим данным, 2 и более АБП получали 66,2% детей. В группах ВП и ОРИ их было 59,2 и 40,8% соответственно (р = 0,555). 1 АБП получали 14 (33,3%) и 11 (34,4%) детей, 2 препарата – 19 (45,2%) и 18 (56,2%), 3 препарата – 8 (19,0%) детей и 3 (39,4%) ребенка (р = 0,503). 4 препарата получал только 1 (2,4%) ребенок из группы ВП. Боль в животе была зарегистрирована всего у 1 ребенка (из группы ВП), он получал более 1 АБП (р = 1,000). Диарея развивалась чаще у детей, получавших 2 и более АБП, чем у тех, кто получал 1 АБП – 24,5 и 8,0% (р = 0,120).
На основании проведенного исследования были сформулированы клинические особенности течения РМ у детей (табл. 2).
Заключение
Таким образом, РМ у детей протекает в форме не только ВП, но и ОРИ практически в половине случаев. Чаще РМ в обеих группах болели дети в возрасте от 3 до 6 лет 11 мес. У пациентов младше 1 года преобладал РМ по типу ОРИ, а у детей 7 лет и старше – по типу ВП. В группе ВП Ме возраста была выше, а бронхообструктивный синдром чаще регистрировали в группе ОРИ. РМ может сопровождаться поражением как нижних, так и верхних дыхательных путей или одновременным их поражением. Недооценка врачами роли инфекции, вызванной M. pneumoniae, в развитии ОРИ с поражением как нижних, так и верхних дыхательных путей приводит к несвоевременной диагностике, увеличению курсов неэффективной антибактериальной терапии и развитию антибиотик-ассоциированного синдрома.


