Средиземноморская пятнистая лихорадка (СПЛ), или марсельская лихорадка – основные названия риккетсиоза из группы клещевой пятнистой лихорадки, впервые описанного в 1910 г. в Тунисе французскими учеными A. Conor и A. Bruch. В 20-х годах прошлого столетия другие французские исследователи D. Olmer и J. Olmer предположили, что эта болезнь передается через укус собачьих клещей Rhipicephalus sanguineus. А в 1932 г. J.Caminopetros и B.Contos открыли возбудителя клещевой инфекции – Rickettsia conorii1. Позже было установлено, что заражение может происходить не только при присасывании, но и при раздавливании клеща, попадании инфекционного материала на участки поврежденной кожи, слизистые оболочки, при вдыхании [1].
Распространена СПЛ главным образом в Средиземноморском регионе, а также в бассейнах Черного и Каспийского морей, Индии, Пакистане, Африке [1]. Имеются данные о том, что кроме клещей Rhipicephalus sanguineu, переносчиками возбудителя Rickettsia conorii могут быть клещи Rhipicephalus (R. appendiculatus, R. evertsi, R. simus), Hyalomma (H. aegiptium), Haemaphysalis (H. leachi), Amblyomma (A. hebraeum) [1, 2]. Нужно учитывать, что в современных условиях расширение границ распространенности и встречаемости СПЛ напрямую связано с увеличением туристических потоков во всем мире, в том числе в эндемичные районы, и ростом популярности экотуризма в последние годы. Однако истинная заболеваемость неизвестна ввиду низкой обращаемости населения при легком течении болезни и постановке ошибочных диагнозов при среднетяжелом течении. Важным диагностическим этапом для постановки правильного диагноза и, соответственно, выбора тактики лечения является сбор эпидемиологического анамнеза: пребывание в эндемической местности, род деятельности заболевшего, факт присасывания клеща, сезонность (весенне-осенний период), контакт с животными.
Патогномоничной клинической триадой СПЛ является наличие первичного аффекта, сыпи и регионарного лимфаденита. Первичный аффект выявляется у 50–90% пациентов [1, 3]. При проникновении возбудителя через слизистую оболочку глаз классического первичного аффекта может не быть, и в таком случае следует обращать внимание на наличие у пациента конъюнктивита. Сыпь полиморфная (макуло-папулезная, розеолезная, геморрагическая). По данным D. Matthew Shoemaker [3], в 2021 г., у пациентов из Африки была обнаружена папуловезикулезная сыпь, и в этом случае возникают трудности дифференциальной диагностики с вирусными экзантемами (например, при ветряной оспе) [3]. Экзантема наблюдается у 95–100% больных. [1, 3, 4]. Регионарный лимфаденит в виде увеличения и болезненности лимфатических узлов, расположенных близко к месту укуса, развивается у части больных.
СПЛ имеет преимущественно доброкачественное течение и заканчивается выздоровлением [1], возможны случаи тяжелого течения с поражением жизненно-важных органов (почек, печени, сердца, центральной нервной системы) [1, 5] и летальным исходом. Описаны клинические случаи в Израиле (2020), Великобритании (2006), Португалии (2003), Хорватии (2000) с такими последствиями, как синдром Гийена–Барре, полинейропатия, изменение психического статуса, гепатомегалия, острая почечная недостаточность, тромбоцитопения, гипоксемия, гемофагоцитарный лимфогистиоцитоз, сепсис и летальный исход [3, 6, 7].
Крымский полуостров находится в пределах природного ареала СПЛ [8]. Впервые заболевание было описано в г. Севастополе в 1936 г. А.Я. Алымовым [5, 9]. В 1962 г. А.Л. Лейбман и Е.А. Клюшкина в Крыму подтвердили ведущее значение клещей Rhipicephalus sanguineus в формировании антропургических и природных очагов СПЛ [10]. На Крымском полуострове клещи Rh. sanguineus распространены повсеместно. Крымские биологи И.Л. Евстафьев и соавт., кроме собак, крупного и мелкого рогатого скота, называют птиц как возможных участников-прокормителей личиночной и нимфальной фаз клещей [11]. В разные годы были описаны вспышки численности клещей Rh. sanguineus, что было связано с увеличением количества безнадзорных собак и благоприятными погодными условиями для клещей [12]. Рост заболеваемости СПЛ отмечали в послевоенный период 1947–1949 гг. , в 1980-х гг. и с 1991 по 1996 г. [5, 13, 14].
В последние годы увеличилось число сообщений об утяжелении клинического течения СПЛ с развитием злокачественных форм, заканчивающихся в 1–5% случаев летальным исходом [15–17]. Профессор Д. Рауль первый автор в работе С. Rovery [17] наблюдал тяжелые формы с летальностью до 33% у пациентов, страдающих сахарным диабетом, глюкозо-фосфатдегидрогеназной недостаточностью, хроническим гепатитом, алкоголизмом.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) – зоонозное природно-очаговое вирусное инфекционное заболевание. Для него характерны цикличное течение, синдром интоксикации, лихорадка, геморрагические проявления и развитие у большинства больных острой почечной недостаточности. В Российской Федерации ГЛПС занимает одно из первых мест по заболеваемости среди природно-очаговых инфекций. [18–20]. Единственным источником заражения человека возбудителями ГЛПС, которое происходит без участия членистоногих переносчиков, являются мышевидные грызуны – носители хантавирусов. Инфицированные грызуны выделяют вирус во внешнюю среду со слюной, мочой, экскрементами. Основными путями заражения человека ГЛПС являются воздушно-капельный, воздушно-пылевой и контактный, при котором возбудитель, содержащийся в биологических выделениях зверьков, в виде аэрозоля попадает через верхние дыхательные пути в легкие человека, где условия для его размножения наиболее благоприятны, и затем с кровью переносится в другие органы и ткани. Заражение возможно также через поврежденную кожу при контакте с экскрементами инфицированных грызунов или со слюной в случае покуса зверьком человека.
Заболеваемость СПЛ в Крыму регистрируется ежегодно, а случаи заболевания людей ГЛПС носят единичный характер. По данным государственных докладов Межрегионального управления Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Республике Крым и городу федерального значения Севастополю, природные очаги с циркуляцией хантавирусов располагаются в горно-предгорной части Крымского полуострова. Основными носителями вирусов являются серые полевки рода Microtus. На территории Республики Крым за период 2015–2020 гг. зарегистрировано 3 случая заболеваний людей ГЛПС [21, 22]. Сочетание СПЛ и ГЛПС для Крымского полуострова – совершенно незаурядный диагноз. Цель исследования – анализ клинического случая редкого тяжелого течения микст-инфекции СПЛ и ГЛПС с летальным исходом.
Молекулярно-биологическим (генетическим) методом ПЦР исследованы образцы биологического материала пациента на присутствие генетических маркеров возбудителей СПЛ, Крымской-Конго геморрагической лихорадки, ГЛПС, иксодового клещевого боррелиоза, анаплазмоза и эрлихиоза, лептоспироза и лихорадки Западного Нила. Лабораторную диагностику проводили на базе Центра гигиены и эпидемиологии в Республике Крым и городе федерального значения Севастополе в лаборатории особо опасных инфекций. Использовали: «АмплиСенс® Rickettsia conorii-FL» – набор реагентов для выявления ДНК Rickettsia conorii в биологическом материале от людей и клещах методом ПЦР-РВ (РУ от 11.04.2019 г. № РЗН 2018/7219); набор реагентов для выявления PНК вируса Крымской-Конго геморрагической лихорадки в биологическом материале методом ПЦР с гибридизационно-флуоресцентной детекцией «АмплиСенс® CCHFV-FL» (РУ от 13.03.2019 г. № ФСР 2012/12997); «ОМ-Скрин-ГЛПС-РВ» – набор реагентов для выявления РНК хантавирусов – возбудителей ГЛПС, позволяющий определить каждый из 4 видов рода Hantavirus (Puumala, Dobrava, Hantaan, Seoul), производства НПК «Синтол»; набор реагентов для выявления РНК/ДНК возбудителей инфекций, передающихся иксодовыми клещами TBEV, Borrelia burgdorferi sl, Anaplasma phagocytophilum, Ehrlichia chaffeensis/Ehrlichia muris в биологическом материале методом ПЦР с гибридизационно-флуоресцентной «АмплиСенс® TBEV», B. burgdorferi sl., A. phagocytophilum, E. chaffeensis/E.muris-FL» (РУ от 22.02.2019 г. № ФСР 2010/09026); «АмплиСенс®ЛПС» – тест-систему для выявления 16S РНК патогенных лептоспир в биологическом ПЦР с ГФЛ-детекцией в режиме реального времени (Декларация соответствия); «АмплиСенс® WNV-FL» – набор реагентов для выявления РНК вируса Западного Нила (WNV) в клиническом и аутопсийном материале от людей, материале от животных, в комарах и клещах методом ПЦР-РВ (РУ от 05.03.2019 г. № ФСР 2011/11503). Дополнительных методов для диагностики ГЛПС – реакции непрямой иммунофлуоресценции (РНИФ) и иммуноферментного анализа (ИФА) – не применяли. .
Приводим клинический пример.
Больной В, 1979 г. р., поступил в инфекционное отделение ГБУЗ РК «Алуштинская центральная городская больница» 04.09.2021 г. Заболел остро 30.08. когда появились сильная слабость, повышение температуры тела до 40 оС, трехкратно – жидкий стул и рвота, а с 02.09 появилась сыпь по всему телу.
Пациент – уроженец Республики Саха (Якутия), в течение последних трех лет проживает в пос. Никита (городской округ Ялта) в частном секторе, имеет домашних животных (кошка, собака). Официально не трудоустроен (предположительно работает на стройке). Контактировал с братом и племянником, у которых проявлялись подобные симптомы (гипертермия, диарея, сыпь), однако на момент госпитализации родственники находились в Якутии. Со слов супруги, пациент несколько дней назад упоминал о наползании «неизвестного насекомого» в область правой лопатки во время разбора старого строения. Новой коронавирусной инфекцией не болел, не привит, за последние 14 календарных дней за пределы города и страны не выезжал. Со слов пациента, страдает хроническим бронхитом. На учете у узких специалистов не состоит.
На 3-й день болезни (01.09.) обратился к терапевту в г. Ялта. Были взяты мазки из зева и носа на антиген SARS-CoV-2 методом ПЦР (№ 267093) и назначено лечение в амбулаторных условиях: цефиксим, амиксин, симптоматическое лечение. На 4-й день болезни (02.09) отмечает появление сыпи на теле. В связи с продолжающейся гипертермией 04.09 (6-й день болезни) повторно обратился за медицинской помощью; выполнена КТ органов грудной полости без контраста (изменений легочной паренхимы не отмечено). Был госпитализирован в инфекционное отделение ГБУЗ РК «Алуштинская ЦГБ» с диагнозом: «острый гастроэнтерит».
Состояние при поступлении расценено как среднетяжелое. Назначена антибактериальная (цефтриаксон 2,0 г в сутки в/в капельно), дезинтоксикационная терапия. На ее фоне 08.09 (10-й день болезни) состояние больного ухудшилось, развился генерализованный эпиприступ, купированный введением сибазона 5 мг/мл – 2,0 мл двукратно. Со слов супруги, приступ эпилепсии развился впервые и ранее подобных эпизодов не было. Вербальный контакт с пациентом был потерян.
Объективно: состояние больного на момент осмотра 08.09 тяжелое. Отмечается психомоторное возбуждение, вербальному контакту не доступен, команды не выполняет. По шкале комы Глазго (ШКГ) в баллах уровень сознания – умеренное оглушение – 13 баллов, глазные щели и зрачки симметричные справа и слева (D=S), фотореакция сохранена, носогубные складки симметричны, сухожильные и периостальные рефлексы живые симметричные справа и слева (D=S), мышечный тонус сохранен, движение в конечностях в полном объеме. Менингеальных знаков и патологических рефлексов не выявлено. Кожные покровы смуглые, отеков нет. На 10-й день болезни (08.09) склеры и слизистые оболочки приобрели иктеричную окраску. Отмечена мелкопятнистая сыпь на передней поверхности грудной клетки, живота, конечностей, поверхностях стоп и ладоней. Сыпь не исчезает при надавливании. Время рекапилляризации ногтевого ложа более 3 с. Зев умеренно гиперемирован. Слизистая оболочка губ сухая. Лимфоузлы не увеличены, пальпируются размером 1,0×1,0 см. Дыхание спонтанное эффективное, ЧД 20–22 в 1 мин., SpO2 96% без кислородной поддержки. Аускультативно в легких выслушивается жесткое дыхание во всех полях. Тоны сердца приглушены, ритмичные, АД 130/80 мм. рт. ст., пульс 90 ударов в 1 мин., удовлетворительного наполнения. Живот мягкий, на пальпацию не реагирует, перистальтика выслушивается. При пальпации печень выступает из-под реберной дуги на 4 см, селезенка у края реберной дуги. Симптомы раздражения брюшины, поколачивания отрицательные. При ректальном исследовании: тонус сфинктера сохранен, ампула прямой кишки пустая, на перчатке следы кала желтого цвета.
Учитывая тяжесть состояния и отрицательный результат ПЦР на антиген SARS-CoV-2 от 04.09. больной переведен в отделение анестезиологии, реанимации и интенсивной терапии, где ему проводили инфузионную терапию, а также дополнительные исследования. После совместного осмотра заведующего инфекционным отделением с врачом-реаниматологом поставлен диагноз: «сепсис неясного генеза. Синдром выраженной эндогенной интоксикации Явления выраженной печеночно-почечной недостаточности на фоне обезвоживания и выраженного ацидоза. Дисметаболическая энцефалопатия. Острый респираторный дистресс синдром I стадии».
На 12-й день болезни (10.09.) состояние больного оставалось крайне тяжелым, без положительной динамики, в связи с чем проконсультирован специалистами по линии санавиации. Осмотрен врачом-инфекционистом. который отметил: на коже головы, туловища, конечностей, в том числе на ладонях и стопах, макуло-папулезная сыпь, не возвышающаяся над поверхностью кожи, не исчезающая при надавливании, до 3 мм в диаметре. В области правой лопатки – первичный аффект в виде струпа до 9 мм в диаметре. Учитывая клинические данные, была заподозрена СПЛ. Рекомендовано исследовать кровь на выявление ДНК риккетсии методом ПЦР, а в проводимой терапии в качестве этиотропного препарата (с учетом чувствительности риккетсий к антибиотикам тетрациклинового ряда) добавлен антибактериальный препарат доксициклин по 0,1 г 2 раза в день.
Результаты лабораторных исследований: анализ крови на ВИЧ-инфекцию от 04.09 отрицательный; исследование мазка из зева и носа методом ПЦР на антиген SARS-CoV-2 от 04.09 и 08.09 отрицательные; исследование крови на малярию, лептоспироз, лихорадку Западного Нила, иерсиниоз от 08.09 отрицательные.
В связи с крайне тяжелым состоянием больной ночью 10.09 (12-й день болезни) переведен на третий уровень оказания медицинской помощи в Республиканскую клиническую больницу им. Н.А. Семашко и госпитализирован в отделение анестезиологии и реанимации с палатами реанимации и интенсивной терапии № 1. Состояние при поступлении: по ШКГ в баллах уровень нарушения сознания – глубокое оглушение – 11–12 баллов, оценка органной недостаточности по шкале SOFA (Sepsis-related Organ Failure) – 10 баллов, зрачки симметричные справа и слева (D=S), фотореакция сохранена. Бульбарный синдром не выражен. Менингеальные знаки отрицательные. Дыхание в легких спонтанное, аускультативно жесткое, ослабленное в нижних отделах, хрипы не выслушиваются. ЧД 18–20 в 1 мин., SpO2 98–100% на кислородной поддержке через лицевую маску. Гемодинамика стабильная, АД 130/80 мм рт. ст., пульс 90–98 ударов 1 в мин. На 12-й день болезни отмечена иктеричность кожных покровов. По всей поверхности тела, включая подошвы и ладони, сохраняется мелкопятнистая сыпь с элементами до 3 мм в диаметре, не возвышающаяся над поверхностью кожи, не исчезающая при надавливании, не склонная к слиянию (рисунок см. на вклейке).
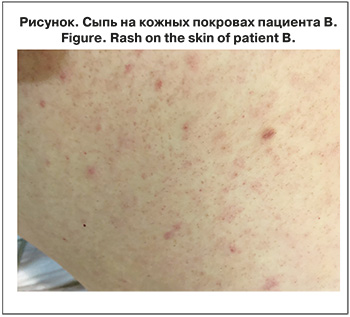
На кожных покровах в области правой лопатки визуализируется первичный аффект в виде эрозии, покрытый темной корочкой до 9 мм в диаметре. Периферические лимфатические узлы не увеличены. Живот мягкий, безболезненный.
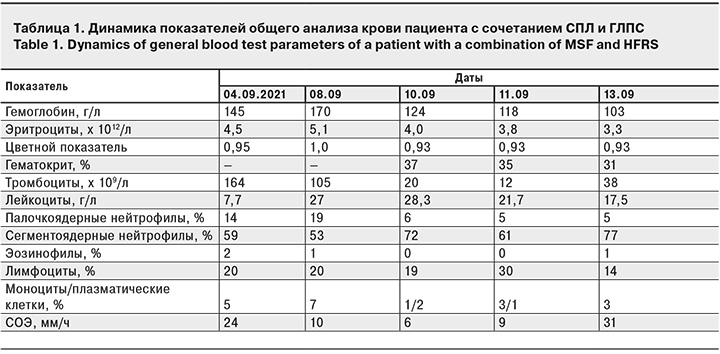
Нарастание отрицательной динамики в течении болезни подтверждают результаты лабораторных исследований крови пациента: выявлены признаки нарастания анемии, критического снижения количества тромбоцитов, воспаления (табл. 1).
Результат исследования спинномозговой жидкости (СМЖ) от 08.09.2021 г.: бесцветная, прозрачная, белок 0,066 г/л, сахар 3,3 ммоль/л, цитоз 6 клеток (70% лимфоциты).
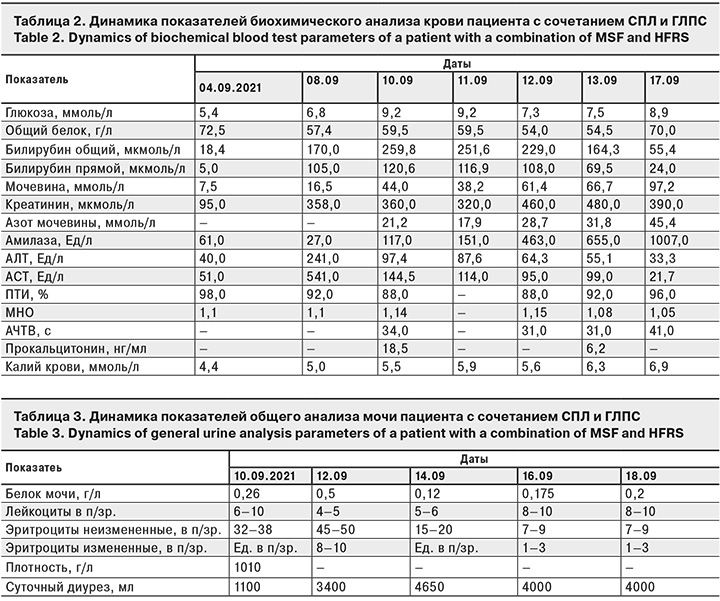
Динамика биохимических показателей крови пациента представлена в табл. 2. Она отражают нарастание почечно-печеночной недостаточности и развитие сепсиса.
Результаты лабораторных исследований мочи пациента указывают на наличие мочевого синдрома различной интенсивности.
10.09 в образце крови, исследованной методом ПЦР на СПЛ, обнаружена ДНК Rickettsia conorii (цикл обнаружения Ct – 30,38; тест-система «АмплиСенс® Rickettsia conorii-FL»).
Результаты дополнительных исследований: микроскопия мазка-отпечатка из первичного аффекта на лейшманиоз от 11.09 – результат отрицательный; микроскопия пунктата костного мозга – лейшмании не обнаружены; исследование крови методом ПЦР от 13.09 присутствия генома вируса Крымской-Конго геморрагической лихорадки, Borrelia burgdorferi, Anaplasma phagocytophyllum, Ehrlichia Chaffeensis/muris не выявило.
13–14.09 пациент осмотрен и проконсультирован врачами-инфекционистами Крымского республиканского центра медицины катастроф и скорой медицинской помощи. Состояние больного крайне тяжелое, уровень сознания – кома 2. Кожные покровы иктеричные, слизистая оболочка ротоглотки эрозирована, налетов нет. Язык влажный, обложен коричневым налетом. Склерит, конъюнктивит. По всей поверхности тела, включая подошвы и ладони, – макулопапулезная сыпь, мелкая, с элементами до 3–4 мм в диаметре, геморрагического характера, не возвышающаяся над поверхностью кожи, не исчезающая при надавливании, не склонная к слиянию. При осмотре в области правой лопатки – первичный аффект в виде эрозии, без корочки, окруженный венчиком гиперемии до 8–9 мм в диаметре, с ровными, плотными краями. Периферические лимфатические узлы не увеличены, подвижные, безболезненные. Живот мягкий, безболезненный. Печень пальпируется у края реберной дуги, обычной эластичности, на пальпацию не реагирует. Селезенка не пальпируется. Симптомы раздражения брюшины, поколачивания отрицательные. Мочеиспускание по катетеру – моча интенсивно окрашена в желтый цвет, по назогастральному зонду наблюдается содержимое в умеренном количестве по типу «кофейной гущи». Стул полуоформленный, коричневого цвета, без патологических примесей. Отмечается пастозность лица, верхних и нижних конечностей.
Учитывая наличие у больного почечно-печеночной недостаточности, умеренного геморрагического синдрома, проведено исследование крови на хантавирусы методом ПЦР 14.09, обнаружен геном хантавируса (цикл обнаружения Ct–20,38)
Установлен диагноз: «микст-инфекция: СПЛ и ГЛПС, (ПЦР-подтвержденная), тяжелое течение. Сепсис. Полиорганная недостаточность. Энцефалопатия смешанного генеза».
Пациенту рекомендовано продолжить антибактериальную (доксициклин в комбинации с ципрофлоксацином), дезинтоксикационную, органопротективную терапию (свежезамороженная плазма, альбумин, концентрат тромбоцитов), увеличить дозу глюкокортикоидов, мочегонных препаратов, усилить гемостатическую терапию. Консультация– гематолога, ревматолога, нефролога, хирурга в динамике, при необходимости – повторная консультация инфекциониста. Лабораторный мониторинг. Эфферентные методы детоксикации не применяли из-за отсутствия в отделении необходимого медицинского оборудования.
На фоне проводимой терапии состояние пациента несколько стабилизировалось, однако оставалось крайне тяжелым. 20.09. (22-й день болезни) на фоне прогрессирующей острой сердечно-сосудистой недостаточности наступила внезапная остановка эффективного кровообращения. Реанимационные мероприятия оказались не эффективны. Констатирована биологическая смерть.
Патологоанатомическое вскрытие не выявило расхождения клинического и патологоанатомического диагнозов. Обращают на себя внимание гистологически подтвержденные некротический нефроз и миелоз селезенки, отек легких и головного мозга, двусторонняя фибринозно-гнойная пневмония. При бактериологическом исследованиия крови отмечен рост Acinetobacter baumannii.
Это первый в Крыму описанный случай редкого сочетания СПЛ и ГЛПС – двух природно-очаговых инфекций с разными механизмами передачи.
Из-за неоднозначности клинических проявлений, что усугубилось развитием микст-инфекции, возникли значительные трудности в дифференциальной диагностике. Диагноз не был своевременно поставлен, следствием стало отсутствие этиотропной терапии ГЛПС в начальном периоде, а затем и в разгар заболевания, и позднее (на 12-й день болезни) начало этиотропной терапии (доксициклином) СПЛ. Проводимая патогенетическая терапия была направлена на уменьшение интоксикации, профилактику специфических осложнений (инфекционно-токсического шока, острой почечной недостаточности, отеков легких и мозга, ДВС-синдрома), коррекцию нарушений водно-электролитного баланса, восстановление резистентности сосудистой стенки, устранение нарушений со стороны сердечно-сосудистой системы и антибактериальную терапию бактериальных осложнений. Пациент получал антибактериальную (доксициклин в комбинации с ципрофлоксацином), дезинтоксикационную, органопротективную терапию (в том числе свежезамороженную плазму, альбумин, концентрат тромбоцитов), глюкокортикоиды, мочегонные препараты и гемостатическую терапию.
Представленный клинический случай демонстрирует важность тщательного сбора эпидемиологического анамнеза, настороженности и более углубленного изучения эпидемиологии и полиморфизма клинической картины эндемичных заболеваний в повседневной работе врачей всех специальностей. Необходимо обратить внимание на важность привлечения узких специалистов, проведение консилиумов, консультаций телемедицины в сложных случаях при постановке диагноза. Нужно учесть, что и риккетсиозы, и геморрагические лихорадки могут скрываться под маской других инфекционных заболеваний, а в условиях сложившейся неблагополучной эпидемической ситуации по новой коронавирусной инфекции (загруженность работников сферы здравоохранения, доступность медицинской помощи и позднее обращение за ней) затрудняют установление истинного диагноза и, соответственно, несвоевременное начало этиотропного лечения [23, 24], что, в свою очередь, отрицательно влияет на исход заболевания. Поэтому важное значение на пути выявления риккетсиозов и геморрагических лихорадок имеет лабораторная диагностика с применением современных молекулярных методов с доказанной достоверностью. Применение тест-систем для ПЦР позволяет обнаружить генетический материал возбудителя в биологических образцах (лейкоцитарной фракции крови, моче, смывах из первичного аффекта и других), определить этиологический агент при моно- или микст-инфекции, что важно при выборе тактики лечения. В описанном случае пациенту была назначена антибактериальная терапия, а после консультации специалистов санавиации и подозрения на СПЛ добавлен препарат выбора доксициклин.
Необходимо знать, что профилактические мероприятия при СПЛ и ГЛПС представлены только блоком неспецифической профилактики, поскольку меры специфической профилактики не разработаны. Неспецифическая профилактика СПЛ включает комплекс противоклещевых мероприятий [санитарно-экологическое преобразование окружающей среды, дератизационные мероприятия, обработку акарицидными (инсектоакарицидными) средствами участков территорий природных и антропургических очагов]; меры индивидуальной противоклещевой защиты [соблюдение правил поведения на опасной в отношении клещей территории, применение специальных химических средств (акарицидных и акарицидно-репеллентных) для обработки верхней одежды и использование (ношение) специальной защитной одежды] и информационно-разъяснительную работу с населением. Местное население и миллионы ежегодно приезжающих в Крым туристов должны быть проинформированы о возможных последствиях контакта с клещами, мерах профилактики и симптомах инфекций, передаваемых клещами.
Неспецифическая профилактика при ГЛПС включает комплекс методов и средств дератизации и дезинфекции и проведение мероприятий по уничтожению грызунов в очагах ГЛПС; защите населения от соприкосновения с грызунами или предметами, загрязненными их выделениями; недопущению образования и ликвидации свалок мусора, сухостоя вблизи населенных пунктов, дачных массивов, оздоровительных учреждений; снос ветхих строений; использование средств индивидуальной защиты при выполнении этих работ и информирование населения об условиях заражения, проявлениях и мерах профилактики ГЛПС.
Заключение
Для установления правильного диагноза ключевую роль играют возможности лабораторной диагностики. В соответствии с действующими нормативными документами для лабораторной диагностики СПЛ и ГЛПС используют иммунологические и молекулярно-генетические методы исследования, для ГЛПС – еще и вирусологический.
Лабораторная диагностика СПЛ включает методы выделения возбудителя и серологические методы определения специфических антител. До сравнительно недавнего времени методы выделения возбудителя были доступны лишь в специальных условиях определенных лабораторий, что не позволяло применять их в рутинной работе практикующих врачей и при таких обстоятельствах серологические методы – реакция связывания комплемента, реакция непрямой гемагглютинации, реакция непрямой иммунофлюоресценции, иммуноферментный анализ – получили широкое распространение. Недостатками серологических тестов являются неэффективность использования в начале заболевания, поскольку антитела к СПЛ появляются не ранее 5–7-го дня, а иногда только к 10-му дню болезни, а также невозможность проведения внутригрупповой идентификации возбудителя. Новым витком прогресса в области лабораторной диагностики стало внедрение методик применения моноклональных антител, вестерн-блот. На современном этапе лидируют достижения молекулярной биологии – метод ПЦР с множеством разновидностей, технологией амплификация нуклеиновых кислот и секвенированием.
Лабораторную диагностику ГЛСП проводят методами флуоресцирующих антител, иммуноферментного анализа, иммуноблота с целью выявления специфических суммарных антител или антител класса IgМ и класса IgG, а также методом ПЦР для выявления РНК возбудителя ГЛПС.
Описанный нами клинический пример подтверждает актуальность проведения исследований природно-очаговых инфекций на Крымском полуострове, необходимость повышения информированности врачей и внедрения комплексного лабораторного обследования пациентов с лихорадкой неясной этиологии на природно-очаговые инфекции в частности, на клещевые риккетсиозы, а также предназначен для врачей разных специальностей как возможный инструмент в сложном диагностическом поиске.


