Углубленное изучение патогенетических механизмов геморрагической лихорадки с почечным синдромом (ГЛПС) имеет огромное значение, так как адекватная этиотропная терапия не разработана и главная роль в лечении отводится коррекции основных клинических симптомов заболевания. Вирус ГЛПС обладает вазотропным действием и наиболее значительным повреждениям подвергаются органы, имеющие развитую микроциркуляторную сеть. Именно в них развиваются воспалительные и деструктивно-некробиотические процессы. Поражение эндотелиальной выстилки сосудов является одним из ранних и ведущих патогенетических звеньев в развитии ГЛПС [1–4]. Одним из методов оценки выраженности эндотелиальной дисфункции является изменение содержания в крови медиаторов повреждения эндотелия, в частности гомоцистеина – серосодержащей аминокислоты, промежуточного продукта метаболизма метионина. Метаболизм гомоцистеина происходит с участием ряда ферментов, основными из которых являются метилентетрагидрофолатредуктаза и цистатион-β-синтетаза. Важную роль выполняют также витамины В6, В12 и фолиевая кислота [5–7]. Более чем 99,5% гомоцистеина реабсорбируется и подвергается обменным превращениям в клетках канальцев нефрона [7–9]. В норме уровень гомоцистеина в плазме крови у взрослых составляет 5–15 мкмоль/л. В патогенезе почечной недостаточности, наряду с изменениями внутрипочечной гемодинамики, значительная роль принадлежит и поражению эндотелия с последующим развитием склерозирования нефронов [8]. Повышение концентрации гомоцистеина в крови всего на 2–3 мкмоль/л от верхней границы нормы может привести к дисфункции эндотелия с увеличением соотношения вазоконстрикторов и вазодилататоров, что влечет за собой снижение почечного кровотока и ишемию клубочков [5, 7–9].
Цель исследования – провести анализ содержания гомоцистеина в сыворотке крови больных ГЛПС в зависимости от формы и периода заболевания.
Материалы и методы
Нами обследованы 53 пациента-мужчины с ГЛПС в возрасте от 18 до 50 лет. 20 человек составили контрольную группу, которая соответствовала исследуемой группе по полу, возрасту и данным анамнеза. Обследуемые были разделены на 3 группы в зависимости от тяжести заболевания и наличия осложнений [инфекционно-токсический шок (ИТШ), синдром диссеминированного внутрисосудистого свертывания (ДВС), острая почечная недостаточность (ОПН)]. Среднетяжелая форма была выявлена у 26 (49%) больных, тяжелая – у 19 (36%), осложненная – у 8 (15%). Степень тяжести заболевания оценивали в соответствии с классификацией Б.З. Сиротина [10]. Концентрацию гомоцистеина в сыворотке крови определяли иммуноферментным методом при помощи тест-системы Axis® Homocysteine EIA производства фирмы «Axis-Shield Diagnostics, Ltd» (Великобритания). Данные о содержании гомоцистеина были подвергнуты двухфакторному параметрическому дисперсионному анализу [11].
Результаты и обсуждение
Контролируемыми факторами являются степень тяжести заболевания (среднетяжелая, тяжелая и тяжелая с осложнениями) и его период (лихорадочный, олигоурический, полиурический и реконвалесцентный). Наиболее сильное влияние на содержание гомоцистеина оказывает фактор тяжести заболевания (η²=68%, F=425, p<0,0001). Оно проявляется в выраженных статистически значимых различиях среднего уровня гомоцистеина при всех рассматриваемых формах заболевания для каждого периода (см. рисунок). Было выявлено, что чем тяжелее форма заболевания, тем выше содержание гомоцистеина в одном и том же периоде.
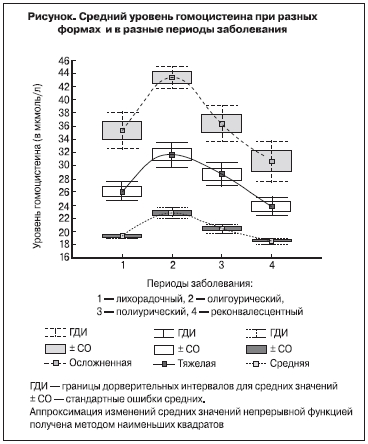
На этом фоне менее выраженным, хотя и статистически значимым, оказалось влияние фактора периода заболевания (η²=14%, F=56, p<0,0001; см. рисунок). При всех формах тяжести заболевания выявлено статистически значимое изменение концентрации гомоцистеина в разные периоды. При переходе от лихорадочного к олигоурическому периоду наблюдается достоверное (p<0,0001) увеличение средней концентрации гомоцистеина с 19,2 ± 0,8 до 22,7 ± 2,3 мкмоль/л при среднетяжелой форме, с 26,0 ± 2,3 до 31,6 ± 4,1 мкмоль/л при тяжелой форме и с 35,3 ± 4,0 до 45,3 ± 2,4 мкмоль/л при осложненной форме. При наступлении полиурической стадии повышение уровня гомоцистеина сменяется его снижением. В этот период средний уровень гомоцистеина составляет 20,4 ± 1,6, 28,6 ± 4,0 и 36,4 ± 3,9 мкмоль/л при среднетяжелой, тяжелой и осложненной формах соответственно. В реконвалесцентный период средний уровень гомоцистеина снова значимо снижается, достигая 18,5 ± 0,9, 27,7 ± 3,0 и 30,6 ± 4,5 мкмоль/л соответственно. Следует отметить, что указанное снижение уровня гомоцистеина в реконвалесцентный период все же многократно превышает содержание такового в контрольной группе, где среднее его значение составляет 8,8 ± 1,44 мкмоль/л с доверительными границами варьирования от 8,1 до 9,4 мкмоль/л (при β>0,95). Отметим также, что указанные изменения уровня гомоцистеина при всех формах тяжести заболевания оказались статистически значимыми: влияние фактора стадии заболевания во всех трех случаях оказалось высоким и статистически значимым, составляя от 40 до 62% (p<0,0001).
Полученные результаты свидетельствуют о том, что у всех исследуемых нами больных ГЛПС уровень гомоцистеина в сыворотке крови повышается, причем самые высокие показатели обнаружены в олигоанурический период заболевания. Основная мишень гомоцистеина – эндотелиоциты сосудов. Стойкая гипергомоцистеинемия может способствовать развитию системной дисфункции эндотелия, предрасполагающей к тромбогенезу.
Механизмы повреждающего действия гомоцистеина [3, 6–9] на сосудистую стенку следующие:
• образование реактивных субстанций кислорода;
• интенсификация перекисного окисления липопротеинов низкой и очень низкой плотности;
• индукция экспрессии провоспалительных медиаторов эндотелиоцитами;
• ускорение катаболизма NO и нарушение эндотелийзависимой вазодилатации;
• активация факторов V и XII;
• блокада активации протеина С;
• торможение экспрессии тромбомодулина;
• индукция образования комплекса липопротеин–фибрин.
Поражение эндотелиальных клеток кровеносных сосудов является одним из ранних и ведущих патогенетических проявлений ГЛПС. Таким образом, можно предположить, что гомоцистеин играет важную роль в повреждении эндотелия сосудов микроциркуляторного русла при ГЛПС. Гомоцистеин и его метаболиты влияют на целый ряд факторов свертывания, включая тромбоциты, тканевой фактор, протеин С, тромбомодулин, тромбоксан, а также факторы V, VII и XII [3, 9]. Вследствие этого гипергомоцистеинемия может являться одним из участников патогенетических механизмов развития геморрагического синдрома при ГЛПС. Развитие гипергомоцистеинемии определяется прежде всего дефицитом коферментов катаболизма гомоцистеина – фолиевой кислоты, а также витаминов В6 и В12. Коррекция уровня гомоцистеина в крови больных ГЛПС представляет актуальную проблему [12, 13]. Необходимо дальнейшее изучение этого вопроса и возможности применения препаратов, регулирующих уровень гомоцистеина в периферической крови. Это, в свою очередь, может привести к повышению эффективности комплексного лечения больных ГЛПС.
Выводы
Впервые было выявлено повышение концентрации гомоцистеина у больных ГЛПС.
Уровень гомоцистеина статистически значимо повышается в зависимости от степени тяжести заболевания: чем она тяжелее, тем выше концентрация гомоцистеина в крови больных ГЛПС.
Концентрация гомоцистеина статистически значимо изменяется в зависимости от периода заболевания. При всех трех рассматриваемых формах заболевания уровень гомоцистеина увеличивается уже в лихорадочный период, достигая максимума в олигоурический, и снижается в полиурическом и реконвалесцентном периодах, оставаясь выше значений контрольной группы и общепринятой физиологической нормы.
* * *
Работа отмечена призом конкурса молодых ученых, прошедшего в рамках IV Ежегодного Всероссийского конгресса по инфекционным болезням (Москва, 26–28 марта 2012 г.)


