На сегодняшней день Chlamydia trachomatis является одной из наиболее распространенных бактериальных инфекций, передаваемых половым путем (ИППП) во всем мире. По оценкам ВОЗ, в 2020 г. насчитывалось около 129 млн новых случаев инфицирования урогенитальным хламидиозом (Х) [1]. По оценкам, в 2018 г. в США им заразились 2,4 млн людей в возрасте от 15 до 39 лет, из них 1,1 млн мужчин и 1,3 млн женщин; 1,6 млн случаев отмечены среди лиц от 15 до 24 лет [2].
Х часто протекает с минимальными проявлениями (выделения из половых органов и жжение при мочеиспускании), но, как правило, бессимптомно. Несмотря на легкое или бессимптомное течение заболевания, Х может являться одной из основных причин воспалительных заболеваний малого таза, бесплодия и внематочной беременности у женщин, а также эпидидимита и орхита у мужчин. Нелеченая инфекция в перинатальном периоде может привести к неблагоприятным исходам беременности, а также вызывать конъюнктивит и пневмонию у новорожденных.
Лечение лиц с C. trachomatis предотвращает неблагоприятные осложнения репродуктивного здоровья и передачу инфекции половым путем. Кроме того, лечение половых партнеров может предотвратить повторное заражение и заражение других партнеров. Лечение беременных женщин обычно предотвращает передачу C. trachomatis новорожденным во время родов [3].
Chlamydia trachomatis также может поражать конъюнктиву глаза взрослого человека, вызывая трахому, которая является эндемичным заболеванием в развивающихся странах.
На данный момент существует несколько методов профилактики. Самый эффективный из них – барьерная контрацепция. При правильном и последовательном использовании презервативы предлагают один из самых эффективных методов защиты от ИППП, включая ВИЧ [1]. Также важную роль играет скрининг групп риска: он рекомендуется всем женщинам моложе 25 лет, всем беременным и женщинам, которые подвергаются повышенному риску заражения. Мужчинам скрининг в настоящее время не рекомендуется [3]. Менее эффективны консультирование и поведенческий подход. К сожалению, недостаточные осведомленность населения и подготовка работников здравоохранения, а также давняя широко распространенная стигма в отношении ИППП остаются препятствиями для более широкого и эффективного использования этих методов. Исследования вакцин против Х, гонореи, сифилиса и трихомониаза на сегодняшний день находятся на ранних этапах [1].
Цель исследования – изучение особенностей территориального распределения заболеваемости урогенитальным Х в Российской Федерации.
Материалы и методы
Анализ заболеваемости проведен на основе материалов статистических сборников «Ресурсы и деятельность медицинских организаций дерматовенерологического профиля. Заболеваемость инфекциями, передаваемыми половым путем, заразными кожными болезнями и заболеваниями кожи: статистические материалы» [4]. В основу эпидемиологического анализа положены описательно-оценочные и аналитические методы. Для выявления многолетней тенденции проводили выравнивание кривой заболеваемости с использованием уравнения линейной регрессии. Выраженность тенденции (темп прироста/снижения) оценивали как отношение коэффициента регрессии к среднемноголетнему показателю заболеваемости. Доверительные интервалы с уровнем значимости 95% (ДИ 95%) к показателям заболеваемости принимались как ±1,96 стандартной ошибки показателя (метод Вальда).
Для изучения особенностей территориального распределения заболеваемости Х данные о годовой заболеваемости в субъектах РФ разделили на квартили. Заболеваемость 1 квартиля (Q1) классифицировали как низкую, 2 квартиля (Q2) – ниже средней, 3 квартиля (Q3) – выше средней и 4 квартиля (Q4) – как высокую. Затем просчитывали, сколько лет каждая территория оказывалась в одном из 4 квартилей, и среднее значение квартиля. Территории, заболеваемость на которых попадала в Q4 не менее 13 раз и при этом ни разу не оказывалась в Q1, классифицировали как территории с устойчиво высокой заболеваемостью. Территории, заболеваемость на которых ни разу не оказывалась в Q4 и не менее 13 раз попадала в Q1, классифицировали как территории с устойчиво низкой заболеваемостью. Остальные территории делились на 2 группы: с преобладанием низкой (чаще встречаются Q1 и Q2) или высокой (чаще встречаются Q3 и Q4) заболеваемости.
Взаимосвязь между показателями оценивали с помощью коэффициента ранговой корреляции Спирмена. Статистическую обработку проводили с использованием программ Microsoft Excel 2010 и IBM SPSS Statistics 22.
Результаты
Урогенитальная хламидийная инфекция является второй по распространенности ИППП после трихомониаза.
В 2021 г. в Российской Федерации заболеваемость трихомониазом и Х составила 24,6 и 17,8 на 100 тыс. населения соответственно. На эти инфекции приходилось около половины всех регистрируемых в Российской Федерации в 2021 г. случаев ИППП (трихомониаз – 27,5%, хламидиоз – 19,9%).
Заболеваемость урогенитальным Х в Российской Федерации в целом в период 2005–2021 гг. характеризуется тенденцией к снижению со среднегодовым темпом снижения -9,86% (рис. 1, см. на вклейке) и хорошо описывается уравнением линейной регрессии с уровнем достоверности аппроксимации R2 = 0,98. Снижение происходило равномерно, признаков цикличности не обнаружено. В 2005 г. показатель заболеваемости составил 95,4 (95% ДИ 95,91–94,89), а в 2021 г. – 17,8 (95% ДИ 18,02–17,58), а на 100 тыс. населения, то есть снизился почти в 5 раз.

Снижение заболеваемости наблюдалось в 81 (95,3%) субъекте Российской Федерации и происходило неравномерно. Наибольшие показатели зарегистрированы в Ненецком АО, Красноярском крае, Ленинградской и Московской областях (среднегодовой темп снижения составил -18,2%, -16,9%, -16,4% и -16,4% соответственно). В 4 (4,7%) субъектах – Чувашской Республике, Республике Алтай, Тульской области и Республике Северная Осетия – Алания – заболеваемость выросла (среднегодовой темп прироста составлял 2,1%, 2,2%, 1,9% и 2,4% соответственно).
Самые высокие показатели заболеваемости в 2021 г. зарегистрированы в Дальневосточном и Северо-Западном федеральных округах (ФО) – 35,1 (95% ДИ 36,39–33,81) и 25,4 (95% ДИ 26,24–24,56) на 100 тыс. населения соответственно, а самые низкие – в Южном, Северо-Кавказском и Центральном ФО – 9,9 (95% ДИ 10,38–9,42), 14,9 (95% ДИ 15,66–14,14) и 14 (95% ДИ 14,37–13,63) на 100 тыс. населения соответственно.
С 2005 по 2008 г. по заболеваемости лидировали Уральский и Северо-Западный ФО, но уже с 2009 по 2021 г. максимальный показатель зарегистрирован в Дальневосточном ФО. На протяжении всего анализируемого периода самые низкие показатели заболеваемости регистрировали в Северо-Кавказском и Южном ФО.
На рис. 2 (см. на вклейке) представлены результаты классификации территорий по уровню заболеваемости Х с использованием деления на квартили. Из рисунка следует, что территориальное распределение является довольно устойчивым и незначительно меняется по годам. Как правило, происходит перемещение между соседними квартилями.
Анализ территориального распределения по субъектам показал, что устойчиво низкую заболеваемость за период 2005–2021 гг. имели 9 (10,6%) из них: Псковская область, Республика Ингушетия, Алтайский край, Республика Дагестан, Нижегородская область, Ненецкий АО, Кабардино-Балкарская и Карачаево-Черкесская Республики, Ростовская область, показатели заболеваемости в которых ни разу не оказывались в Q3 или Q4 и не менее 13 раз попадали в Q1.
Устойчиво высокую заболеваемость в 2005–2021 гг. регистрировали в 9 (10,6%) субъектах Российской Федерации: Удмуртской Республике, Сахалинской области, Санкт-Петербурге, Еврейской автономной и Астраханской областях, Республиках Тыва и Саха (Якутия), Камчатском крае. Показатели заболеваемости в них попадали в Q4 не менее 13 раз и при этом ни разу не оказывались в Q1.
Из числа остальных 67 субъектов Федерации 32 (37,6%) были отнесены к территориям с преобладанием низкой заболеваемости (чаще встречались Q1 и Q1), а 35 (41,2%) – к территориям с преобладанием высокой заболеваемости (чаще встречались Q3 и Q4) (см. рис. 2).
Устойчиво низкую заболеваемость преимущественно регистрировали в субъектах, расположенных на юге и юго-западе страны, а чем дальше на восток, тем заболеваемость была выше. В Сибирском и Дальневосточном ФО находится 6 из 9 территорий с устойчиво высокой заболеваемостью.
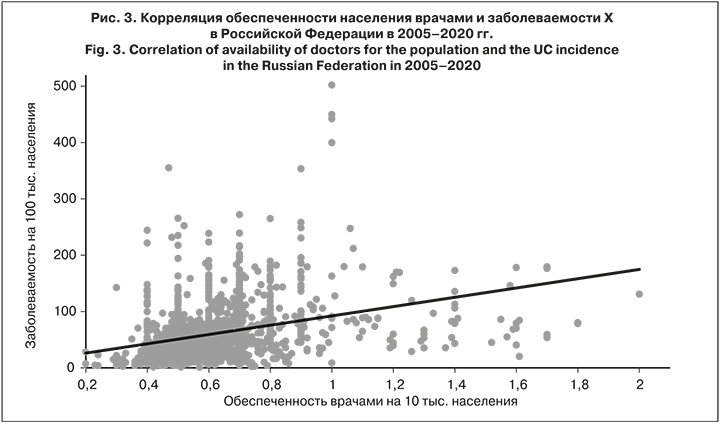
Существует разрыв между фактической и регистрируемой заболеваемостью [5–8]. В свою очередь, уровень регистрируемой заболеваемости зависит от качества учета, одним из факторов которого является доступность специализированной помощи, в том числе обеспеченность населения врачами-дерматовенерологами. Поэтому мы решили взять за относительный показатель благополучия субъектов РФ обеспеченность населения врачами-дерматовенерологами в 2005–2020 гг. [4]. Коэффициент корреляции равен 0,450 (95% ДИ 0,402–0,498) (рис. 3), отмечена слабая положительная корреляция.
Обсуждение
Согласно официальной статистике, в Российской Федерации в целом отмечается тенденция к снижению заболеваемости урогенитальным Х; за период с 2005 по 2021 г. она снизилась почти в 5 раз. В большинстве субъектов отмечается такая же тенденция
Уровень и многолетняя тенденция заболеваемости в Российской Федерации существенно отличаются от европейских стран. Так, по данным ECDC [9], в 2019 г. в Дании, Норвегии, Англии и Финляндии показатели заболеваемости составили 614,53, 533,88, 388,47, 293,24 на 100 тыс. населения соответственно и имеют тенденцию к росту. Таким образом, в этих странах по сравнению с РФ (25 на 100 тыс. населения) заболеваемость выше в 25, 21, 16, 12 раз соответственно. В то же время распространенность урогенитального Х, по данным отдельных исследований [5–8, 10], в Российской Федерации равна или выше, чем в странах Европы и Северной Америки [11– 20] и составляет приблизительно 5%, но крайне сложно адекватно сопоставить данные, полученные в разных исследованиях, так как в них оценивалась распространенность Х среди отдельных групп населения, таких как секс-работники, лица, проходящие лечение в клиниках, и мужчины, имеющие секс с мужчинами. Такая большая разница в показателях заболеваемости может быть связана с низкой выявляемостью и регистрацией случаев урогенитального Х в Российской Федерации, что приводит к занижению истинной заболеваемости.
Территориальное распределение характеризовалось устойчивостью: были выделены территории с устойчиво низкой и устойчиво высокой заболеваемостью. Территории с устойчиво низкой заболеваемостью находились преимущественно в субъектах, расположенных на юге и юго-западе страны (6 из 9), а территории с устойчиво высокой заболеваемостью – в субъектах, расположенных на востоке страны (6 из 9). Такие различия могут быть связаны как с объективными факторами, так и с особенностями регистрации. Отмечена тенденция к обращению за медицинской помощью части пациентов в коммерческие медицинские организации, не имеющие надлежащего статистического учета и находящиеся как в самом субъекте, так и в других ФО. Наряду с этим имеют место случаи обращений пациентов после самолечения, после неполноценного лечения у специалистов других профилей, которые, как правило, не подают сведений о таких больных, что, соответственно, ведет к недоучету числа случаев заболеваний и искажению истинной заболеваемости. Поэтому признать в некоторых субъектах показатели заболеваемости Х ниже среднероссийских как состояние эпидемиологического благополучия не представляется возможным.
В пользу этой гипотезы говорит коэффициент корреляции заболеваемости с обеспеченностью населения врачами, равный 0,45. Это может быть связано как с тем, что в регионах с низкой заболеваемостью сокращают число врачей из-за отсутствия необходимости, так и с невозможностью для населения обратиться к специалистам, это ведет к снижению регистрации случаев Х, а не к снижению заболеваемости.
Выводы
1. В структуре ИППП Х занимает 2-е место после трихомониаза, и его доля в 2021 г. составила 19,9% всех ИППП. Так логичнее
2. По данным официальной статистики, в Российской Федерации в целом эпидемическая ситуация по Х улучшается, заболеваемость равномерно снижается с каждым годом. Снижение произошло также в 81 (95,3%) субъекте РФ. Самый высокий показатель заболеваемости в 2021 г. зарегистрирован в Дальневосточном ФО. Изменения динамики заболеваемости в 2005–2021 гг. в ФО по отношению друг к другу не выявлено. Территориально заболеваемость распределена неравномерно, четко выделяются территории с устойчиво низкой и устойчиво высокой заболеваемостью.
3. Сравнивая заболеваемость в РФ с таковой в экономически развитых странах Европы и учитывая снижение обеспеченности населения врачами-дерматовенерологами, можно сделать вывод, что снижается не истинное количество заболевших, а их выявляемость. Это подтверждается результатами исследований, в которых распространенность Х в Российской Федерации была сопоставима с таковой в европейских странах, и спецификой Х, легкостью его течения, что может привести к самолечению и, соответственно, к недоучету числа случаев заболевания.


