Острые зоонозные природно-очаговые заболевания, такие как геморрагическая лихорадка с почечным синдромом (ГЛПС) и лептоспироз, поражающие преимущественно лиц трудоспособного возраста, представляют одну из важнейших медико-социальных проблем [1–3]. Полиморфизм клинических проявлений от легких бессимптомных и гриппоподобных форм до тяжелой молниеносной фатальной инфекции обусловливает значительный интерес к этим инфекциям исследователей и практикующих врачей [4, 5]. Тяжесть течения и прогноз при этих инфекциях связаны с осложнениями, в число которых входят инфекционно-токсический шок, острая почечная недостаточность, печеночно-почечная недостаточность, геморрагический синдром [6–10].
В литературе достаточно хорошо освещены вопросы этиологии и патогенеза, патологической анатомии, методов диагностики и лечения ГЛПС и лептоспироза [11, 12]. Однако патологии верхних отделов желудочно-кишечного такта (ВО ЖКТ), возникающей при данных инфекциях, уделяется недостаточно внимания [13].
У больных ГЛПС и лептоспирозом, особенно протекающими в тяжелой форме, выраженные симптомы общей интоксикации, развитие тромбогеморрагического синдрома, различной степени почечная и печеночно-почечная недостаточность, инфекционно-токсический шок, а также значительное расстройство микроциркуляции обусловливают полиорганную патологию с неизбежным вовлечением в патологический процесс ЖКТ и развитие острой эрозивно-язвенной патологии ВО ЖКТ [14].
Несмотря на важность обсуждаемой проблемы, патология ВО ЖКТ у больных ГЛПС и лептоспирозом по ряду причин своевременно не диагностируется. В частности, она не имеет четкого симптомокомплекса и на фоне общего тяжелого состояния больного маскируется симптоматикой основного заболевания. Наличие указанной патологии, как правило, констатируют только при возникновении осложнений в виде желудочных кровотечений или перфорации полого органа.
Кроме того, нельзя отрицать возможное участие Нelicobacter pylori в развитии эрозивно-язвенной патологии ВО ЖКТ у больных, в том числе ГЛПС и лептоспирозом [15].
Своевременная диагностика эрозивно-язвенной патологии ВО ЖКТ у больных ГЛПС, лептоспирозом и другими инфекционными заболеваниями не может быть основана только на клинической симптоматике и должна базироваться на результатах эндоскопического обследования.
Целью настоящего исследования явилось изучение эрозивно-язвенной патологии ВО ЖКТ по данным эндоскопического обследования у больных ГЛПС и лептоспирозом, ее взаимосвязи с этиологическим фактором, тяжестью течения и сроками основного заболевания.
Материалы и методы
В работе использованы результаты фиброэзофагогастродуоденоскопий (ФЭГДС), гастробиопсий, а также клинико-лабораторные данные 126 больных обоего пола в возрасте от 15 до 78 лет.
В зависимости от нозологической формы заболевания были выделены 3 группы больных: в 1-ю вошли 65 больных ГЛПС, во 2-ю – 29 пациентов с лептоспирозом, в 3-ю – 32 пациента с инфекцией мочевыводящих путей (ИМВП) неуточненной этиологии (группа клинического сравнения).
При поступлении всех больных обследовали в соответствии со «Стандартами ведения больных»: проводили общеклинические, биохимические, серологические исследования и дополнительно ФЭГДС. Эндоскопическое обследование проводили в течение 1–7 сут. от момента поступления в стационар по стандартной методике с забором материала на цитоморфологическое исследование и диагностику хеликобактериоза.
Лечение проводили в соответствии со стандартами терапии основного заболевания, язвенной болезни или пилорического хеликобактериоза.
Для выявления Н. pylori применяли биохимический (быстрый уреазный тест) и морфологический (цитологический и гистологический) методы, полимеразную цепную реакцию (ПЦР). Наличие Н. pylori признавали, если хотя бы один из тестов давал положительный результат.
Расчеты проводили с использованием статистического раздела электронной таблицы Microsoft Office Excel и программы Biostatistica. Рассчитывали среднюю арифметическую (М), среднюю ошибку средней арифметической (m), t-критерий Стьюдента. При оценке различий между средними величинами вычисляли коэффициент достоверности по критерию Стьюдента. За уровень достоверности была принята вероятность различия р > 95,0%, то есть р < 0,05.
Результаты
 У всех больных ГЛПС, лептоспирозом и ИМВП закономерно выявлялись различные формы гастритов и эрозивно-язвенные повреждения слизистой оболочки ВО ЖКТ: небольшие по размерам дефекты слизистой оболочки, от точеных до 0,5 см в диаметре, округлой или овальной формы, небольшой глубины со слабо выраженными перифокальными воспалительными изменениями (отек, гиперемия). На поверхности эрозий определялся солянокислый гематин (стигмы кровотечения давностью не более 24–48 ч). Выявляли как одиночные изолированные повреждения, затрагивающие 1 отдел, так и множественные сочетанные, затрагивающие 2 или 3 анатомических образования.
У всех больных ГЛПС, лептоспирозом и ИМВП закономерно выявлялись различные формы гастритов и эрозивно-язвенные повреждения слизистой оболочки ВО ЖКТ: небольшие по размерам дефекты слизистой оболочки, от точеных до 0,5 см в диаметре, округлой или овальной формы, небольшой глубины со слабо выраженными перифокальными воспалительными изменениями (отек, гиперемия). На поверхности эрозий определялся солянокислый гематин (стигмы кровотечения давностью не более 24–48 ч). Выявляли как одиночные изолированные повреждения, затрагивающие 1 отдел, так и множественные сочетанные, затрагивающие 2 или 3 анатомических образования.
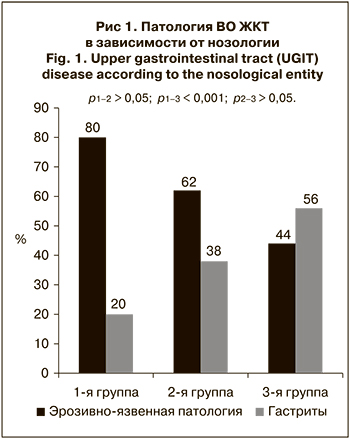
Установлено, что эрозивно-язвенная патология достоверно чаще регистрируется при ГЛПС, чем при ИМВП: выявляемость эрозивно-язвенных повреждений ВО ЖКТ в 1-й группе составила 80 ± 4,96%, во 2-й – 62 ± 9,17%, в 3-й – 44 ± 8,92% (p < 0,001) (рис. 1).
Установлено, что внутри каждой группы больных эрозивно-язвенные поражения ВО ЖКТ достоверно чаще регистрируются при более тяжелом течении основного заболевания (табл. 1). При ГЛПС, лептоспирозе и ИМВП они были связаны с почечным синдромом и уровнем азотемии (табл. 2) как одним из основных и наиболее стабильных показателей почечной недостаточности и, соответственно, тяжести течения основного заболевания. Вероятно, выявленная взаимосвязь обусловлена системными нарушениями микроциркуляции, которые лежат в основе как почечного синдрома, так и эрозивно-язвенных поражений ВО ЖКТ [8].
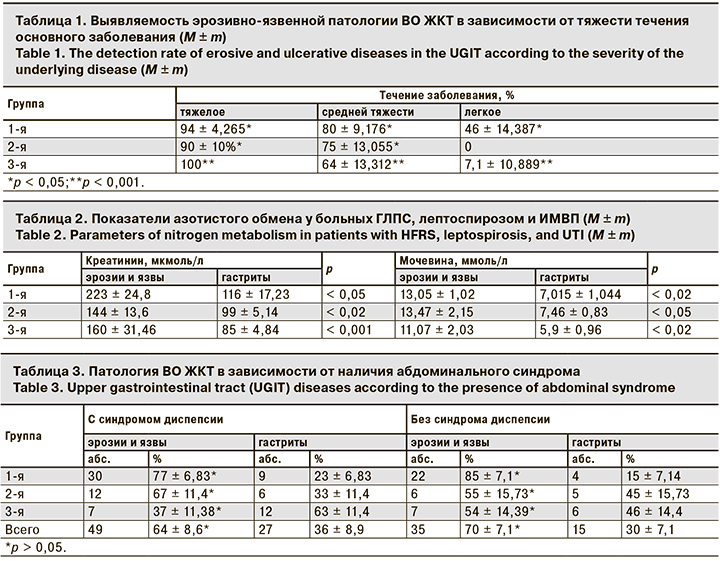
Таким образом, тяжесть течения инфекционного заболевания является одним из факторов, определяющих развитие острой эрозивно-язвенной патологии ВО ЖКТ. Следовательно, для определения группы риска больных по эрозивно-язвенной патологии ВО ЖКТ необходимо ориентироваться на традиционные клинико-лабораторные критерии тяжести заболевания. У больных изучаемыми заболеваниями, особенно с тяжелым течением, необходимо расширить показания для проведения ФЭГДС и ввести эндоскопическое обследование в стандарт обследования.
Варианты течения острой эрозивно-язвенной патологии ВО ЖКТ мы анализировали независимо от этиологии, так как в целом они не отличаются от вариантов ее течения внутри каждой группы.
У 49 (66,2%) из 74 больных с синдромом диспепсии (тошнота, рвота, боли в эпигастрии и правом подреберье) была выявлена эрозивно-язвенная патология. В то же время у 35 (70%) из 50 пациентов без абдоминального синдрома также выявлены эрозивно-язвенные изменения ВО ЖКТ (табл. 3).
Таким образом, неспецифичность клинической симптоматики острой эрозивно-язвенной патологии ВО ЖКТ и ее «маскировка» симптомами основного заболевания не позволяют ориентироваться только на клиническую диагностику. Полученные данные подчеркивают решающее значение ФЭГДС в диагностике патологии ВО ЖКТ у больных ГЛПС и лептоспирозом.
Выявленные эрозивно-язвенные поражения ВО ЖКТ регистрировали на 2–17-й день с максимальным количеством случаев на 7–8-е сутки от начала заболевания. Гастриты в те же сроки регистрировали реже (рис. 2).
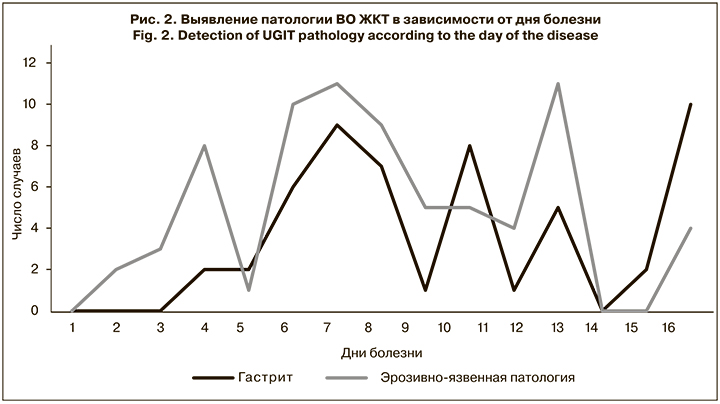
Признаки кровотечения из острых эрозий желудка и язв луковицы двенадцатиперстной кишки выявлены у 25 (29%) больных и по временным параметрам совпадали с пиком регистрации эрозивно-язвенных поражений.
У 24 больных благодаря своевременно проведенной гемостатической и противоязвенной терапии не было отмечено клинических проявлений развившегося кровотечения благодаря своевременно проведенной гемостатической и противоязвенной терапии. Одна больная с тяжелым течением ГЛПС и анурией умерла в постгеморрагическом периоде при нарастании почечной и сердечно-сосудистой недостаточности. Еще у одной пациентки в ранние сроки заболевания возникло желудочно-кишечное кровотечение, что потребовало первичной госпитализации в хирургический стационар.
Обсуждение
Полученные результаты согласуются с результатами исследований при других патологических состояниях, в которых показана высокая частота регистрации острой эрозивно-язвенной патологии ВО ЖКТ, в том числе с признаками кровотечения [14].
Практически важным является своевременная эндоскопическая диагностика патологии ВО ЖКТ с целью выявления признаков кровотечения до возникновения их клинических проявлений у больных ГЛПС и лептоспирозом.
При оценке общей структуры эрозивно-язвенной патологии ВО ЖКТ у больных изолированные и сочетанные изменения наблюдали практически с одинаковой частотой: в 51 ± 5,45 и 49 ± 5,45% случаев соответственно (р > 0,05).
Эрозивно-язвенная патология локализовалась в антральном отделе желудка у 51 (61 ± 5,32%) больного, в других отделах – у 16 (19 ± 4,31%), то есть значительно реже. Это, вероятно, связано с особенностями кровоснабжения слизистой оболочки ВО ЖКТ и согласуется с данным литературы по локализации эрозивных повреждений слизистой оболочки ВО ЖКТ при других патологических состояниях [14].
Пилорический хеликобактериоз был выявлен у 39% пациентов эрозивно-язвенными поражениями ВО ЖКТ.
Частота ассоциированности эрозивно-язвенных поражений с Н. pylori при различных заболеваниях существенно не различалась и составила в 1-й группе 33+ 6,52% во 2-й – 44 ± 12,04%, в 3-й – 57 ± 13,37%.
Выявляли как спиральные, так кокковые и распадающиеся формы бактерии.
При наличии Н. pylori воспалительный инфильтрат имеет полиморфноклеточный состав, кроме того образуются крупные лимфоидные фолликулы в собственной пластинке и в подслизистом слое, что может свидетельствовать о предшествующей инфицированности Н. pylori.
Контаминация Н. pylori слизистой оболочки желудка имеет определенное значение в развитии острой эрозивно-язвенной патологии ВО ЖКТ у больных ГЛПС и лептоспирозом. У таких больных наличие Н. pylori следует рассматривать как инфекцию, активизирующуюся в условиях общей и местной иммуносупрессии, которая занимает существенное место в патогенезе как инфекционных заболеваний, так и эрозивных поражений слизистой оболочки ВО ЖКТ, что совпадает с мнением других исследователей [16].
При морфологическом исследовании у больных в каждой группе выявляли острые эрозии слизистой оболочки с пигментом на поверхности, в дне эрозий и в собственной пластинке слизистой оболочки – воспалительная инфильтрация. В некоторых случаях она в строме сочетается с разрушением клеток эпителия желез и формированием крипт-абсцессов, большим количеством апоптозных тел и одновременно с дисплазией эпителия желез.
Изменения сосудов микроциркуляторного русла проявлялись в полнокровии, утолщении стенок капилляров, расширении их просвета, стазом кровотока в них, сладжированием, микротромбозами, кровоизлияниями от очаговых до инфильтрирующих поверхностные отделы слизистой оболочки и строму.
Наиболее выраженные изменения, такие как секвестрация крови в МЦР, полнокровие капилляров, парез, стаз на вершинах желез, ямок, микротромбозы и кровоизлияния, набухание стенок сосудов, а также отек, набухание волокнистых элементов стромы с их разволокнением наблюдались при ГЛПС.
Можно полагать, что острые эрозии ГДСО у больных ГЛПС и лептоспирозом являются неспецифической реакцией и морфологическим эквивалентом глубоких расстройств гомеостаза, реализующихся через изменения обмена веществ, иммунореактивности и процессов микроциркуляции. Таким образом, более уместно говорить не об эрозивных дефектах как таковых, а скорее об эрозивных состояниях гастродуоденальной области. Иначе говоря, острые эрозивно-язвенные поражения слизистой оболочки ВО ЖКТ являются своеобразным «зеркалом», отражающим степень выраженности изменений метаболизма, иммунореактивности и микроциркуляции при различных патологических состояниях. Таким образом, ВО ЖКТ следует рассматривать как орган-мишень и уделять повышенное внимание состоянию слизистой оболочке пищевода, желудка и двенадцатиперстной кишки в условиях «инфекционного стресса».
Заключение
У больных ГЛПС, лептоспирозом и ИМВП закономерно и с высокой частотой наблюдается острая эрозивно-язвенная патология слизистой оболочки ВО ЖКТ, в том числе с признаками кровотечения, которая встречается достоверно чаще при тяжелом течении заболевания и взаимосвязана с почечной недостаточностью (уровнем азотемии).
Эрозивно-язвенная патология ВО ЖКТ выявляется преимущественно на 7–8-е сутки болезни, чаще локализуется в антральном отделе желудка и протекает как с синдромом диспепсии, так и без него.
Морфологические изменения слизистой оболочки ВО ЖКТ при эрозивно-язвенной патологии характеризуются признаками нарушения микроциркуляции и изменениями сосудов МЦР (стаз, парез, кровоизлияния различной выраженности и протяженности) и соответствуют различным стадиям острого геморрагического эрозивного гастрита.
Выявленный пилорический хеликобактериоз при эрозивно-язвенной патологии встречался с одинаковой частотой у пациентов всех трех групп.
Раннее эндоскопическое обследование пациентов с названными инфекционными заболеваниями позволит своевременно выявить, морфологически верифицировать патологию ЖКТ и назначить адекватную терапию, позволяющую уменьшить вероятность развития осложнений в виде желудочного кровотечения.


