В конце 80-х и в 90-е годы в Краснодарском крае всем больным лептоспирозом, проходившим этап лечения в отделении реанимации и интенсивной терапии, традиционно назначали пульс-дозы глюкокортикостероидов (ГКС) (как правило, 1,5–2 г по преднизолону в сутки) [1]. Позднее, с учетом утвердившихся представлений о тяжелом лептоспирозе как классической модели сепсиса [2, 3], подход к использованию ГКС существенно изменился. Была выбрана общемировая рекомендация по применению ГКС в интенсивной терапии сепсиса, суть которой – предпочтительное использование гидрокортизона 200–300 мг в сутки (то есть в режиме средних доз) в виде постоянной внутривенной инфузии только при септическом шоке с адреналовой недостаточностью и не более 5–7 сут. [4]. Трендом последнего десятилетия в мире (и в Краснодарском крае) стало резкое нарастание летальности при лептоспирозе [5, 6] за счет появления тяжелого легочного геморрагического синдрома (SPHS). В нескольких зарубежных исследованиях по применению ГКС при лептоспирозе с острым повреждением легких и SPHS показано, что назначение ГКС в мощном пульс-режиме (первые 12 ч внутривенно болюсно 4 г метилпреднизолона, далее в течение 3 дней по 1 г 4 раза в день, затем – пероральный прием препарата в дозе 1 мг/кг в день в течение 4 дней) статистически значимо улучшало выживаемость [6–9]. Недостатками этих исследований, на наш взгляд, были отсутствие групп сравнения и учета осложнений ГКС-терапии. Не изучено влияние ГКС на систему гемостаза, поэтому не определены механизмы снижения летальности при SPHS с фатальным легочным кровотечением. Кроме того, сами авторы признавали, что в комплексе усовершенствованной интенсивной терапии «вклад» пульс-доз ГКС остался неясным [9].
Учитывая противоречия и недостатки немногочисленных исследований, целью нашей работы явилось создание концепции применения ГКС при тяжелом лептоспирозе. Для достижения ее были поставлены следующие задачи: сравнить эффективность и определить безопасность различных режимов ГКС-терапии, оценить целесообразность применения ГКС при тяжелом лептоспирозе в целом.
Материалы и методы
ГКС (парентеральный преднизолон, дексаметазон, сочетание преднизолона с дексаметазоном; в единичных случаях – метилпреднизолон и гидрокортизон) использовали в терапии 231 больного тяжелым лептоспирозом. Суточную и курсовую дозы ГКС оценивали в пересчете на преднизолон. ГКС назначали с первого дня поступления в стационар. Основными показаниями к применению ГКС были полиорганная недостаточность (ПОН): шок в сочетании с острым печеночно-почечным повреждением, нарушениями гемостаза и острым респираторным дистресс-синдромом.
Больных разделили на 2 группы. 1-ю группу составили 45 больных тяжелым лептоспирозом (из них 10 – с летальным исходом), получавших пульс-терапию ГКС. Критерием включения было назначение ГКС в суточной дозе > 10мг/кг в течение 1–5 дней. У 9 пациентов этой группы развилось желудочно-кишечное кровотечение (ЖКК).
Во 2-ю группу вошли 186 пациентов с лептоспирозом тяжелого течения (из них 13 – с летальным исходом), в лечении которых использовали режим средних доз ГКС. Критерий включения – применение ГКС в суточной дозе < 10 мг/кг (чаще 300–420 мг в сутки) от 1 до 14 дней. ЖКК развилось у 18 пациентов этой группы. Следует подчеркнуть, что всем больным лептоспирозом с развившимся ЖКК применяли профилактику стресс-язв желудка.
Всем пациентам, включенным в исследование, определяли основные лабораторные параметры шкалы SOFA: уровни общего билирубина крови, сывороточного креатинина, количество тромбоцитов, а также комплекс значимых параметров гемостазиологических нарушений: уровень фибриногена; активированное частичное тромбопластиновое время (АЧТВ); протромбиновый индекс (ПТИ); площадь агрегации тромбоцитов (Sаг); ристомицин-кофакторную активность фактора Виллебранда (ФВ); минимальную амплитуду (А0) и время существования сгустка (Тсс) электрокоагулограммы (ЭкоГ); уровни растворимых комплексов фибрин-мономера (РКФМ) и D-димера, свободного гемоглобина плазмы крови (Hbсв); активность глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) [10].
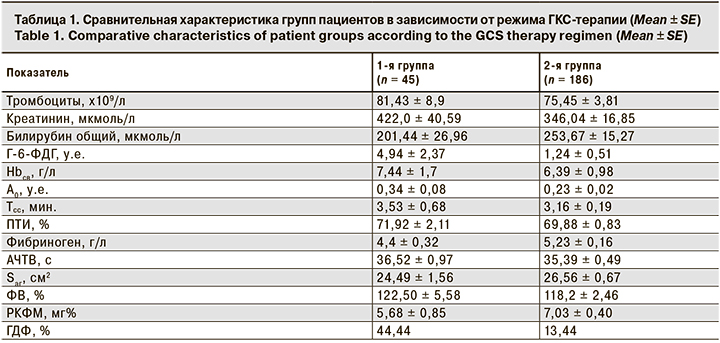
Как видно из табл. 1, группы больных с разными режимами применения ГКС по основным показателям тяжести ПОН и оценке гемостаза статистически значимо не различались. Однако в 1-й группе процент проведения почечно-заместительной терапии (ПЗТ) в виде гемодиафильтрации (ГДФ) был выше, чем во 2-й.
 Для определения целесообразности применения ГКС выделили группу А, в которую вошли 53 пациента, в лечении которых ГКС не применяли. В группу В вошли 67 человек, получавшие ГКС, из них 19 человек с пульс-режимом введения (группа В1) и 48 пациентов, получавших режим средних доз ГКС (группа В2). Критерием включения в группу В была тяжелая ПОН – более 16 баллов по шкале SOFA (табл. 2). Баллы SOFA регистрировали при поступлении пациентов в стационар, затем на 2–3-й день пребывания. В группы были включены только те пациенты, у которых до 2–3 сут. еще не применяли методов экстракорпоральной детоксикации (ПЗТ, плазмообмен, гемосорбция и др.). Сопоставление групп по тяжести ПОН представлено в табл. 2.
Для определения целесообразности применения ГКС выделили группу А, в которую вошли 53 пациента, в лечении которых ГКС не применяли. В группу В вошли 67 человек, получавшие ГКС, из них 19 человек с пульс-режимом введения (группа В1) и 48 пациентов, получавших режим средних доз ГКС (группа В2). Критерием включения в группу В была тяжелая ПОН – более 16 баллов по шкале SOFA (табл. 2). Баллы SOFA регистрировали при поступлении пациентов в стационар, затем на 2–3-й день пребывания. В группы были включены только те пациенты, у которых до 2–3 сут. еще не применяли методов экстракорпоральной детоксикации (ПЗТ, плазмообмен, гемосорбция и др.). Сопоставление групп по тяжести ПОН представлено в табл. 2.
Статистическую обработку полученных данных проводили при помощи программного обеспечения Statistica 10. Для оценки характера распределения (нормальное и ненормальное) в совокупности по выборочным данным использовали критерий Лиллиефорса. При нормальном распределении количественные величины были представлены как среднее ± ошибка средней (Mean ± SE). При распределениях, не являющихся нормальными, использовали медиану и интерквартильный размах (в виде 25-й и 75-й процентилей) (Me [CI]). Сравнения двух групп из совокупностей с нормальным распределением и равенством генеральных дисперсий проводили с помощью t-критерия Стьюдента. Для анализа выборочных данных из совокупностей, отличающихся от нормального распределения, использовали критерий Колмогорова–Смирнова. Статистически значимыми считались различия данных при р < 0,05. Анализ выживаемости проводили по методу Каплана–Мейера с моделью пропорциональных интенсивностей Кокса. Рассчитывали отношение рисков (RR [CI]) и отношение шансов (ОR [CI]) с 95% доверительным интервалом.
Результаты
Проведя сравнение выживаемости пациентов при применении двух схем ГКС-терапии методом Каплана–Мейера, мы увидели, что по 8 временным интервалам (точкам) выживаемость больных во 2-й группе была выше, чем 1-й группе. Однако с 9-й точки выживаемость во 2-й группе резко снижалась и становилась меньше, чем в 1-й (рис. 1, см. на вклейке). Метод Каплана–Мейера является описательным средством. Поэтому лишь с некоторой долей уверенности мы можем заключить, что выживаемость пациентов с режимом пульс-доз в долгосрочном периоде выше. Необходимо было оценить достоверность различий кривых выживаемости и значимость нашей гипотезы в регрессионной модели Кокса. Преимуществом этого метода была возможность включить в расчеты целый набор предикторов, которые могли бы повлиять на исход в одной из групп больше, чем в другой.
В результате такой оценки RR ни в одном из периодов не показало статистически значимого увеличения шансов выздороветь для пациентов сравниваемых групп. Таким образом, вывод о статистически значимой разнице выживаемости в исследуемых группах при использовании статистической модели пропорциональной интенсивности Кокса ничтожен. Почему так произошло? При всей наглядной разнице кривых Каплана–Мейера мы не получили конечной точки исследования из-за отсутствия статистической мощности по количеству умерших больных. Из табл. 3 следует, что относительный риск летального исхода (в данной модели исследования) уровень тромбоцитов не увеличивал, но влиял на конечный результат выживаемости при различной тактике ГКС-терапии (р < 0,05).
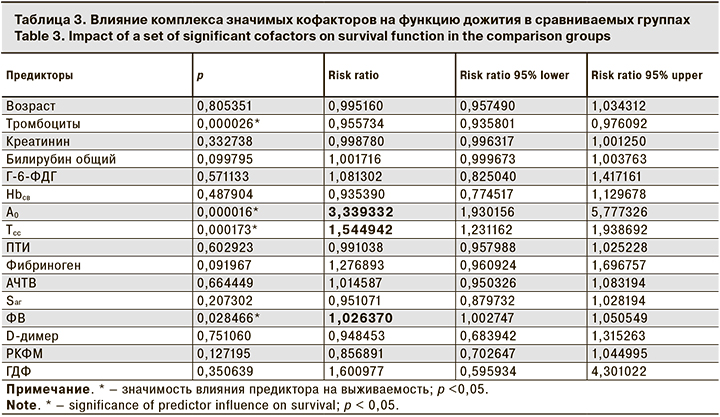
Особого внимания заслуживал показатель плотности сгустка (А0). При ее снижении шанс выжить был в 3 раза меньше вне зависимости от режима ГКС-терапии. На выживаемость также влияли время существования плотного сгустка и активность фактора Виллебранда. А вот проведение ГДФ статистически значимого влияния на выживаемость пациентов в сравниваемых группах не имело (р > 0,05).
ЖКК – самое позднее проявление геморрагического синдрома при лептоспирозе, на возникновение которого гипотетически могут оказать влияние ятрогенные воздействия [11]. При анализе кривых Каплана–Мейера (рис. 2, см. на вклейке) заключили, что ЖКК чаще развивалось при пульс-терапии ГКС. Конечная Ме времени до развития ЖКК не определена, так как число больных с возникшим кровотечением было меньше половины числа наблюдаемых (в 1-й группе – 9 из 45, во 2-й – 18 из 186). Несмотря на очевидную достоверность различий кривых, показывающих долю возникновения события (ЖКК) в определенный момент времени для сравниваемых групп, RR не было больше 1. Мы определили, что на возникновение ЖКК, помимо режима ГКС-терапии, оказывал влияние ряд кофакторов: уровень мочевины (RR = 1,04 [1,01–1,06]), креатинина (RR = 1,00 [1,00–1,01]) и проведение ПЗТ (гемодиафильтрации) (RR = 2,25 [1,01–5,02]). Проведение ГДФ в данном случае – зависимый критерий, так как связан с тяжестью острого повреждения почек. Однако именно пациенты, в лечении которых применяли ПЗТ, имели в 2,3 раза больший шанс наступления ЖКК, чем те, кто ПЗТ не получал. Установленный факт связи ЖКК с выраженностью патологии почек при ГКС-терапии требовал пересмотра тактики назначения ГКС. Интересно, что ни один из показателей гемостаза не являлся фактором риска ЖКК.
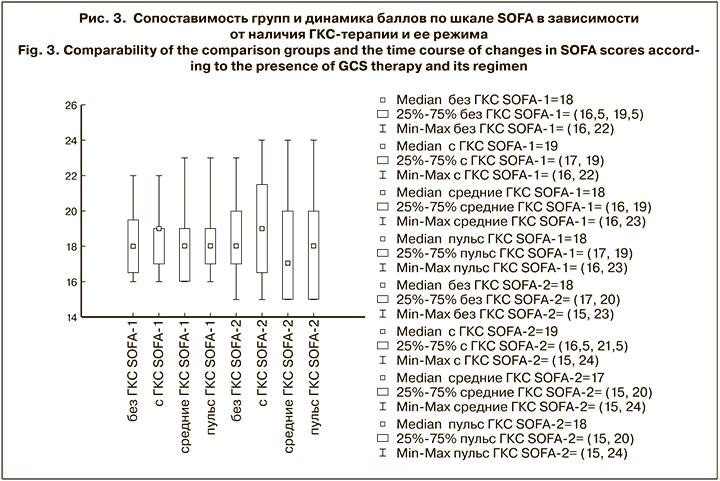
Для оценки целесообразности применения ГКС в комплексной терапии тяжелого лептоспироза определяли объективные критерии тяжести ПОН по шкале SOFA. Баллы SOFA-1 регистрировали при поступлении пациентов в стационар, а баллы SOFA-2 – на 2–3-й день пребывания. На рис. 3 показано, что вне зависимости от наличия ГКС-терапии и ее режима, медианы SOFA-2 с межквартильным интервалом статистически значимо не отличались ни в одной из групп.
Однако при расчете OR [CI] оказалось, что шансы уменьшить тяжесть ПОН (баллы по SOFA) при использовании ГКС-терапии были в 2,65 раза больше (OR = 2,65 [1,20–5,83]). При этом шансы появления тяжелых кровотечений и/или возникновения поздних гнойно-септических осложнений в исследуемых группах от применения ГКС не зависели. OR для развития кровотечений составило 0,448 [0,17–1,78], а гнойно-септические осложнения с летальным исходом развились у 2 пациентов, относящихся к разным группам.
При каком же режиме ГКС-терапии шансы снизить баллы по SOFA больше? При расчете OR = 2,36 мы не получили статистически значимых преимуществ в уменьшении тяжести ПОН в зависимости от тактики ГКС-терапии, так как ДИ [0,77–7,23].
Обсуждение
Так есть ли точка приложения для ГКС в интенсивной терапии тяжелого лептоспироза помимо септического шока с признаками адреналовой недостаточности? Ведь хорошо известно, что ГКС снижают активность прововоспалительных цитокинов, блокируют иммунокомплексный и аутоиммунный процессы. Существующая сорбция цитокинов рутинно пока не проводится, поэтому при отсутствии на сегодняшний день доступных альтернативных средств для супрессии цитокинового «шторма» ГКС могут оказать положительное влияние и на различные энергодефицитные состояния [12]. При прогрессирующем системном воспалении с развитием органных повреждений в результате любой инфекции ГКС способствуют ограничению деструктивного процесса. Известно, что невысокие дозы ГКС вызывают так называемые геномные эффекты, а высокие – внегеномные [13]. Из геномных эффектов важна регуляция транскрипции определенных генов и изменение синтеза различных регуляторных белков и ферментов. Среди них – цитокины, молекулы адгезии и другие. Кроме того, ГКС уменьшают образование и увеличивают распад компонентов комплемента. В последнее десятилетие усилились дискуссии по поводу целесообразности добавления низких доз ГКС в терапию острого повреждения легких у больных без септического шока. В некоторых работах была доказана важная роль в восстановлении поврежденных легких активации ГКС-рецепторов на альвеоцитах, макрофагах и ряде циркулирующих клеток [14, 15]. При лептоспирозе интерес к ГКС вырос в связи с утяжелением клиники за счет острого повреждения легких с тяжелыми легочными кровотечениями, которые стали ведущими причинами смерти больных [11]. Открытым остается вопрос о дозах ГКС. В рандомизированных клинических исследованиях при сепсисе и пневмонии показано, что пролонгированное введение метилпреднизолона в низких дозах (1 мг/кг в сутки) при тяжелом остром повреждении легких с выраженной воспалительной реакцией (уровень СРБ более 150 мг/л) приводило к снижению содержания ряда провоспалительных цитокинов в крови, к более быстрому приросту коэффициента оксигенации, сокращало длительность ИВЛ и в целом улучшало выживаемость. При этом пациенты на фоне введения ГКС имели сравнимую с контрольной группой частоту таких нежелательных реакций, как суперинфекции и кровотечения [16, 17].
Результаты проведенного исследования показали, что при наличии ПОН (более 16 баллов по шкале SOFA) шансы уменьшить ее тяжесть (баллы по SOFA) при использовании ГКС-терапии были в 2,65 раза выше, чем без нее. Таким образом, показанием к ГКС-терапии при лептоспирозе является ПОН. Какие же дозы ГКС применять? Мы доказали отсутствие преимуществ какого-либо режима ГКС-терапии в выживаемости больных тяжелым лептоспирозом, однако режим ГКС-терапии должен быть дифференцирован с учетом полученных результатов.
Заключение
Режим пульс-доз может улучшить выживаемость больных тяжелым лептоспирозом в комплексе с другими независимыми предикторами: формированием плотного сгустка (по результату инструментального функционального метода экспресс-диагностики системы гемостаза), повышением активности ФВ.
Если имеет место развитие коагулопатии потребления (которая характеризуется рыхлым сгустком и выраженным снижением активности ФВ), пульс-терапия ГКС не улучшит выживаемости пациентов. Кроме того, при сочетании коагулопатии потребления с ОПП III стадии по AKIN и проведением ПЗТ использование пульс-терапии ГКС увеличивает риск ЖКК. Тем не менее подчеркнем, что только пульс-терапия ГКС (без кофакторов) статистически значимого влияния на ЖКК не оказывает.
Все эти данные позволили предложить концепцию дифференцированного применения ГКС при тяжелом лептоспирозе:
- При ПОН более 16 баллов по SOFA у больных лептоспирозом ГКС способствуют уменьшению тяжести полиорганной дисфункции и могут применяться в режиме средних доз или в виде пульс-терапии.
- Отсутствуют доказательства преимуществ влияния какого-либо режима ГКС-терапии на выживаемость больных тяжелым лептоспирозом.
- Показанием к ГКС-терапии при тяжелом лептоспирозе является не только септический шок с адреналовой недостаточностью, но и другая органная дисфункция.
- Применение пульс-доз ГКС должно быть строго лимитировано при сочетании коагулопатии потребления, ОПП III стадии по AKIN и проведении ПЗТ.


