Согласно результатам многочисленных исследований, атазанавир (ATV), относящийся к классу ингибиторов протеазы (ИП) ВИЧ, является высокоэффективным препаратом как для пациентов, только начинающих антиретровирусную терапию (АРТ), так и для больных с опытом лечения или предшествующей вирусологической неудачей. Препарат был зарегистрирован в России в 2005 г., а широкое его использование в мире насчитывает уже более 10 лет.
ATV обладает хорошим профилем безопасности и хорошо переносится пациентами. Среди нежелательных явлений наиболее часто встречается повышение уровня непрямого билирубина, которое обратимо, поддается коррекции и не связано с развитием гепатотоксичности. Рандомизированные контролируемые исследования по использованию ИП [1–3] показали, что большинство препаратов этого класса вызывает клинически значимое повышение уровня триглицеридов и холестерина. К безусловным достоинствам ATV нужно отнести отсутствие влияния на липидный, а также углеводный профиль, что позволило использовать этот препарат у пациентов старшего возраста, больных кардиоваскулярными заболеваниями и сахарным диабетом [4, 5].
ATV обладает уникальным преимуществом – возможностью использования как с усилением ритонавиром (RTV), так и в качестве самостоятельного препарата. При этом эффективность его эквивалентна, а параметры безопасности существенно лучше. Это связано с собственными побочными эффектами RTV, а также с усилением токсичности других ИП при сочетанном применении.
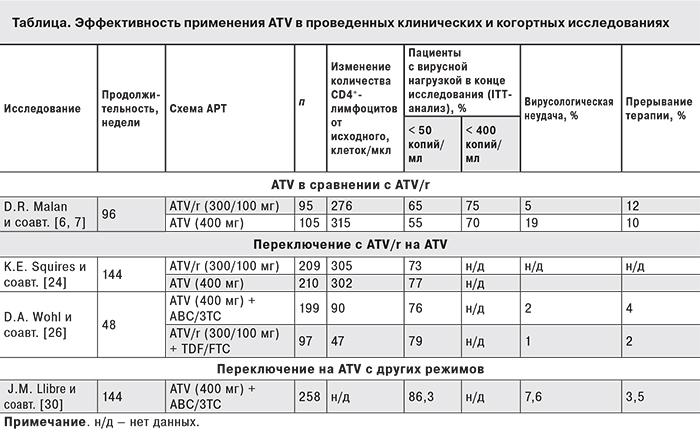
Важным моментом в совершенствовании и расширении подходов к лечению стал сравнительный анализ схем, включающих бустированный (ATV/r) и небустированный ATV у не леченных ранее пациентов. С этой целью было проведено многоцентровое рандомизированное открытое международное клиническое исследование III фазы BMS AI424-089 [6, 7]. Через 48 (первичная цель) и 96 нед. оценивали долю пациентов с концентрацией РНК ВИЧ < 400 и < 50 копий/мл, изменение количества CD4+-лимфоцитов и проводили анализ параметров безопасности. В исследование было включено 200 пациентов, из которых 95 получали ATV 300 мг в сочетании с RTV 100 мг однократно (1-я группа), а 105 – ATV 400 мг однократно (2-я группа). В качестве базовой терапии применяли ламивудин (3ТС) и ставудин (d4T).
Характеристики пациентов до начала лечения были сходными в обеих группах. Исходно медиана количества CD4+-лимфоцитов составила около 200 клеток/мкл, концентрация РНК ВИЧ – 4,95 log копий/мл, а уровня холестерина и триглицеридов – 161 и 145 мг/дл соответственно.
На 48-й неделе пропорция больных с вирусной нагрузкой ВИЧ < 400 копий/мл составила 86 и 85%, а < 50 копий/мл – 70 и 75% в 1-й и 2-й группах соответственно (включая всех пациентов, даже больных с вирусной неудачей – ITT-анализ). При использовании в анализе данных только пациентов, завершивших исследование (ОT-анализ), были получены следующие результаты: вирусной нагрузки < 400 копий/мл достигли по 93% пациентов в каждой группе, < 50 копий/мл – 76 и 87% в 1-й и 2-й группах соответственно. На 96-й неделе исследования пропорция пациентов с уровнем РНК ВИЧ < 400 и < 50 копий/мл составила 75 и 65% в 1-й группе и 70 и 55% во 2-й группе (различия статистически недостоверны). Эти результаты соответствовали предопределенным протоколом критериям равной эффективности (см. таблицу).
Увеличение количества CD4+-лимфоцитов по сравнению с исходным было сопоставимо в двух ветвях исследования: прирост в 1-й группе составил 189 клеток/мкл, во 2-й – 224 клеток/мкл на 48-й неделе, 276 и 315 клеток/мкл на 96-й неделе соответственно (различия статистически недостоверны).
Вирусологическая неудача на 48-й неделе была зарегистрирована в 3 и 10% случаев у пациентов 1-й и 2-й групп соответственно, на 96-й неделе – в 5 и 19% случаев. Пациенты 1-й группы с вирусологической неудачей сохранили фенотипическую чувствительность к ATV, в то время как во 2-й группе из 20 пациентов с неудачей у 4 была зарегистрирована потеря чувствительности ВИЧ к ATV.
Повышение концентрации холестерина наблюдали в 15% случаев в 1-й группе по сравнению с 6% во 2-й (р < 0,01). Повышение уровня триглицеридов чаще имело место при применении ATV/r (26 и 3% в 1-й и 2-й группах соответственно; р < 0,01). На 96-й неделе по сравнению с 48-й неделей изменения были минимальны (различия между группами сохранялись, за исключением концентрации триглицеридов), что указывает на отсутствие повышения риска с продолжением терапии. Прерывание терапии в течение 48 нед. было зафиксировано у 12% пациентов 1-й группы и у 10% пациентов 2-й группы. Анализ причин прерывания АРТ показал, что в связи с развитием нежелательных явлений (главным образом, гипербилирубинемии – ГБР) лечение прервали 8% пациентов в 1-й группе и лишь 1% больных во 2-й группе. Более половины случаев преждевременной отмены терапии произошло по причине предопределенных протоколом требований по отмене терапии ATV/r в случае персистирования ГБР 4-й степени, даже в случае отсутствия клинических симптомов. Случаев прерывания терапии между 48-й и 96-й неделями не зарегистрировано. Было сообщено о желтухе у 3% пациентов в 1-й группе и у менее 1% во 2-й. ГБР 3–4 степени была зафиксирована на 48-й неделе у 59 и 20%, на 96-й неделе – у 66 и 24% пациентов, получавших соответственно ATV/r и ATV.
Таким образом, в данном исследовании был продемонстрирован высокий и сравнимый между группами уровень вирусологического ответа на протяжении 96 нед. Безопасность и переносимость обеих схем была достаточно хорошей. Вместе с тем, использование ATV без RTV не только сокращает суточное количество таблеток, но и реже вызывает повышение уровня билирубина, а также нарушение липидного обмена. В то же время ATV/r характеризуется лучшим профилем резистентности.
В настоящее время среди практических врачей распространено мнение о том, что повышение уровня билирубина в процессе терапии ATV является поводом для отмены этого препарата и перехода на другие схемы АРТ. Действительно, во всех клинических исследованиях с использованием ATV было зафиксировано повышение уровня непрямого билирубина у 30–50% пациентов. Однако изменение этого лабораторного параметра достигает 4-й степени выраженности только у 1–2% больных, не влечет за собой повышения уровня трансаминаз и не нарушает функцию печени. По данным многочисленных исследований (CASTLE, SIMPATAZ и др.), частота желтухи составляла только 4–10%, при этом повышение уровня трансаминаз наблюдали всего в 2% случаев [8, 9]. ATV способствует снижению концентрации уридиндифосфат-глюкуронилтрансферазы (UGT1A1), что по патофизиологическому механизму аналогично синдрому Жильбера или физиологической желтухе новорожденных [10, 11]. Схему лечения обычно не меняют, если уровень билирубина не превышает 60–80 ммоль/л. Однако желтизна кожи может вызывать затруднения в общении с другими людьми и снижать качество жизни. В субанализе исследования CASTLE, выполненного С. McDonald и соавт. [12], оценивали клиническую значимость ГБР у пациентов, получавших ATV/r на протяжении 96 нед. Авторы заключили, что наличие ГБР 3–4-й степени было связано с достижением вирусологического ответа (74% в общей популяции, 84% у пациентов с ГБР и 69% у пациентов без ГБР). Менее 1% пациентов прекратили участие в исследовании по причине развития ГБР. Также показано, что нет отличий в приверженности к лечению (как к режиму в целом, так и к ATV) и качестве жизни пациентов с ГБР и без неё.
Существуют предикторы развития ГБР, связанные как с особенностями пациента, так и с фармакокинетикой препарата.
Так, риск развития ГБР намного выше у больных с физиологическим дефицитом UGT1A1. Кроме того, описано несколько генетических полиморфизмов, ассоциированных с развитием ГБР, один из которых – UGT1A1*28 (rs8175347). Наличие 6 ТА-повторов в промоторной области гена UGT1A1 соответствует нормальной активности работы фермента. Обнаружение 7 ТА-повторов в гетеро- или гомозиготном состоянии [генотипы (ТА)6/(ТА)7 и (ТА)7/(ТА)7 соответственно] ассоциировано со сниженной активностью фермента UGT1А1, что может приводить к развитию синдрома Жильбера и/или изменению индивидуального фармакологического ответа на лекарственные препараты, метаболизируемые этим ферментом [13].
Распространенность аллеля UGT1A1*28 гораздо ниже в Азии, в том числе среди корейцев (13%), китайцев (16%) и японцев (11%), по сравнению с европейцами (36–39%) и афроамериканцами (43%) [14–16]. Гомозиготный вариант аллеля выявлен у 0,8% больных в Корее, тогда как в европейской популяции его частота составляет около 10% [17]. В России аллель UGT1A1*28 обнаруживали у 57,4% больных, а гомозиготный аллель – у 14,9% [18].
Некоторые другие полиморфизмы могут также влиять на развитие связанной с ATV ГБР, например, ген множественной лекарственной устойчивости 1 (MDR1), кодирующий Р-гликопротеин, который отвечает за адсорбцию и распределение ИП ВИЧ [19], а также аллель UGT1A1*6 [20].
Исследование, проведенное Федеральным научно-методическим центром по профилактике и борьбе со СПИДом (Москва), показало, что общая частота повышения концентрации общего билирубина 3–4-й степени при использовании ATV в схеме АРТ составила 29,8%, непрямого билирубина – 36,2%, выраженной желтухи –10,6% [18]. Дополнительные факторы риска (заболевания гепатобилиарного тракта, исходно повышенная концентрация билирубина) могут увеличить частоту и выраженность ГБР. Минимальный риск развития выраженной ГБР при назначении ATV имеют пациенты без UGT1A1*28 не более чем с одним дополнительным фактором риска и с гетерозиготным UGT1A1*28 без дополнительных факторов риска. Наибольшему риску подвержены пациенты с гомозиготным генотипом UGT1A1*28. Среди российских пациентов минимальный риск развития выраженной ГБР имеют 61,7%, умеренный – 23,4% и лишь 14,9% больных подвержены высокому риску этой патологии.
На основе данных швейцарского генетического когортного исследования, включавшего 96 больных, была составлена математическая модель, согласно которой можно добиться уменьшения частоты желтухи при приеме ATV с 21,6 до 5,8% при условии назначения препарата в соответствии с генотипом больного (p < 0,001) [13].
Использование фармакогенетического тестирования помогает оптимизировать схему АРТ и избежать возможных нежелательных явлений, но на практике можно ориентироваться на уровень билирубина перед назначением ATV. Однако как было показано в исследовании B. Schackman и соавт. [21], рутинное выполнение теста на генетический полиморфизм для определение варианта аллеля UGT1A1 не оправдано с фармакоэкономической точки зрения. В исследовании моделировалась ситуация, когда всем пациентам, которым при рутинном скрининге при наличии UGT1A1*28 назначается усиленный дарунавир (DRV/r) вместо ATV/r, а пациенты без указанного аллеля могут получать ATV/r. Базовый сценарий предусматривал, что ATV и DRV равны по цене, и стоимость теста составляет 107 долларов США. Выполнение такого теста было оправдано с фармакоэкономической точки зрения только при снижении стоимости теста до 10 долларов США. При условии, если DRV дороже ATV (в РФ стоимость DRV практически в 2 раза выше стоимости ATV), выполнение рутинного теста невыгодно при любом сценарии.
В отличие от генетических факторов пациента, на которые повлиять нельзя, фармакокинетику ATV возможно изменить при назначении его без RTV. Так, в исследовании NCT00440947 с участием 419 пациентов было зарегистрировано снижение частоты ГБР 2–4-й степени с 10 до 4% при использовании небустированного ATV [22].
В ряде исследований было показано, что замена бустированного ATV на небустированный сокращает вероятность развития ГБР более чем в 2 раза [23]. Так, в рандомизированном открытом исследовании равной эффективности III фазы ARIES [24] изучалась возможность подобного переключения у 515 пациентов, не получавших ранее АРТ. Открытая фаза, длившаяся 36 нед, предполагала, что все больные принимают ATV в дозе 300 мг в сочетании с RTV в дозе 100 мг и АВС/3ТС. Затем больные были рандомизированы на 2 группы: пациенты 1-й группы (п = 209) продолжили принимать исходную схему, а пациенты 2-й группы (п = 210) были переведены на ATV в дозе 400 мг. Анализ, проведенный на 144-й неделе исследования, показал равную эффективность ATV в сочетании с RTV и без него (см. таблицу). Снижение концентрации РНК ВИЧ < 50 копий/мл было достигнуто у 73 и 77% больных соответственно (ITT-анализ). Среднее изменение количества CD4+-лимфоцитов от исходного также не отличалось в группах и составило 305 и 302 клетки/мкл соответственно. Однако оценка параметров безопасности выявила существенные различия. Пациенты 2-й группы имели меньше нежелательных явлений 2–4-й степени, чем пациенты 1-й группы – 12 и 23% соответственно. Еще более выраженные различия между группами были в частоте ГБР – 6 и 14% (p = 0,00232). Кроме того, во 2-й группе частота липидных отклонений была минимальной.
Сочетание использования генетических тестов и знаний фармакокинетики ATV может дать еще больший эффект при определении оптимальной схемы АРТ для конкретного больного. По данным L. Ferraris и соавт. [25], переключение с ATV/r на ATV в случае обнаружения UGT1A1*28 (как гомозиготного, так и гетерозиготного) способствовало снижению уровня общего билирубина с 69,9 до 31,1 мкмоль/л, практически исключая возможность развития ГБР 3–4-й степени.
Недавно было опубликовано исследование по переключению с ATV/r на ATV [26]. Оно было интересно тем, что кроме отмены RTV была произведена и смена нуклеозидной основы. В это открытое проспективное рандомизированное мультицентровое исследование IV фазы были включены взрослые пациенты, получавшие ATV/r (300/100 мг) в комбинации с тенофовиром/эмтрицитабином (TDF/FTC – 300/200 мг) не менее 6 мес. до скрининга в качестве первого или второго режима, достигшие вирусологической супрессии (РНК ВИЧ < 75 копий/мл) и не имевшие документированной вирусологической неудачи. Больные были рандомизированны в соотношении 2:1 на упрощение режима путем приема АВС/3ТС (600/300 мг) 1 раз в день и 400 мг ATV или продолжение приема ATV/r + TDF/FTC. В течение 48 нед. оценивали уровень РНК ВИЧ, иммунологические, рутинные биохимические и гематологические показатели, а также специфические биомаркеры, направленные на оценку обмена фосфатов, кальция и функции почек. Первичной конечной точкой исследования являлась пропорция пациентов с уровнем РНК ВИЧ < 50 копий/мл на 24-й неделе после переключения (алгоритм TLOVR), оценка пропорции пациентов с неопределяемой вирусной нагрузкой на 48-й неделе была вторичной конечной точкой. Кроме того, вторичными целями исследования были: доля пациентов с РНК ВИЧ < 400 копий/мл, изменение уровня CD4+-лимфоцитов от исходных показателей, изменение показателей липидного обмена и других параметров безопасности проводимой терапии, определение фенотипической и генотипической резистентности в случае развития неудачи терапии. Также оценивали нейрокогнитивную функцию и изменение показателей биомаркеров сердечно-сосудистых заболеваний, воспаления, костной системы и почек.
Всего в исследование было включено 297 пациентов: 199 пациентов перевели на ATV + АВС/3ТС, 97 пациентов продолжили прием ATV/r + TDF/FTC. Один пациент из этой группы не получил лечения в исследовании и не включен в анализ. В целом группы были хорошо сбалансированы между собой, преобладали мужчины (79%), белой расы (60%), медиана CD4+-лимфоцитов – 492 клетки/мкл. На 24-й неделе исследования (первичная конечная точка) 86,9% пациентов, принимавших ATV и АВС/3ТС, и 86,6% принимавших ATV/r сохранили уровень РНК ВИЧ < 50 копий/мл (р = 0,33; 95%ДИ 7,97–8,64), на 48-й неделе таких пациентов было 76 и 79% соответственно (p = 0,564). Не было выявлено различий между группами среди всех закончивших исследование пациентов (ОТ-анализ), а также в зависимости от расы, пола и возраста. Несмотря на то, что группы демонстрировали равные медианные уровни CD4+-лимфоцитов на 48-й неделе (603 и 590/мкл для принимавших ATV + ABC/3TC и ATV/r + TDF/FTC соответственно), медиана прироста была значимо выше (p = 0,026) в группе принимавших ATV + АВС/3ТС: 90 клеток/мкл против 47 клеток/мкл. 4 (2%) человека из числа принимавших ATV + АВС/3ТС и 1(1%) из группы принимавших ATV/r + TDF/FTC имели подтвержденную вирусологическую неудачу, у 3 из них вирус на момент неудачи оставался чувствительным ко всем исследуемым препаратам, а также имелись сообщения из клинических центров о неприверженности данных пациентов и прерывании ими лечения. У 2 оставшихся пациентов, имевших длительную историю применения ННИОТ + TDF/FTC до переключения на прием ATV/r (у 1 из них – более 7 лет), было сообщено об обнаружении множественных мутаций резистентности к НИОТ [в том числе к зидовудину (ZDV) и d4T, которые никогда не применялись у этих пациентов] и ИП.
Побочные эффекты встречались с одинаковой частотой в обеих группах и привели к прекращению приема лекарственных препаратов только в 4% случаев при приеме ATV + ABC/3TC и в 2% случаев при приеме ATV/r + TDF/FTC (тошнота, рвота и сыпь были причинами прерывания лечения, зарегистрированными более чем у 1 пациента). Нарушения лабораторных показателей 3–4-й степени встречались значимо чаще (p = 0,0014) у пациентов, продолживших прием ATV/r + TDF/FTC. В основном эти различия были обусловлены изменениями уровня общего билирубина. Так, у пациентов, перешедших на прием ATV, повышение уровня общего билирубина 3–4-й степени было зарегистрировано в 6% случаев по сравнению с 29% в группе принимавших ATV/r + TDF/FTC. Изменения уровня липидов в целом были сопоставимы между группами и с исходными значения, за исключением небольшого, но статистически значимо бóльшего прироста липопротеидов высокой плотности в группе принимавших ATV + ABC/3TC (3 г/л; p = 0,013). Скорость клубочковой фильтрации (СКФ) в начале исследования была одинаковой в обеих группах и составила 93 мл/мин/1,73м2 (формула MDRD). На 48-й неделе исследования были зарегистрированы статически незначимые разнонаправленные изменения СКФ: прирост на 0,8 мл/мин/1,73м2 в группе пациентов, переключившихся на прием ATV, и снижение на 1,3 мл/мин/1,73м2 в группе принимавших ATV/r . Биомаркеры функции костной ткани [костный изофермент щелочной фосфатазы (КЩФ), паратиреодидный гормон (ПТГ), С-терминальный телопептид (С-ТТп), остеокальцин] значимо улучшились в группе принимавших ATV и остались на прежнем уровне у пациентов, продолживших прием ATV/r + TDF/FTC. При этом уровень витамина D, который был на низком, но нормальном уровне в начале исследования, на протяжении 48 нед. немного снизился у пациентов, получавших ATV + ABC/3TC, и немного вырос у пациентов, получавших ATV/r + TDF/FTC, что в целом не было связано с улучшением других описанных выше показателей. Биомаркер почечной функции (соотношение β2-микроглобулина к креатинину, комбинированный показатель гломерулярной и тубулярной функции) снизился на 56% в группе пациентов, принимавших ATV (p < 0,001), и вырос в группе пациентов, принимавших ATV/r + TDF/FTC. В то же время не было зарегистрировано различий между группами в показателях воспаления или развития сердечно-сосудистых заболеваний.
Таким образом, переключение пациентов, получавших стабильный режим ATV/r + TDF/FTC, на ATV + ABC/3TC не только не приводит к компромиссу в вирусологической эффективности (79 и 76% соответственно), но и улучшает иммунологическую эффективность, показатели биомаркеров функции костной ткани и почек, а также снижает частоту развития ГБР 3–4-й степени.
В последние годы пристальное внимание специалистов в области ВИЧ-инфекции направлено на повышение приверженности к терапии, что позволяет резко снизить частоту возникновения лекарственной устойчивости к препаратам принимаемой терапевтической схемы. Одним из путей повышения приверженности является уменьшение суточного количества таблеток и капсул [27, 28]. Однократный прием ATV является несомненным преимуществом этого препарата по сравнению с другими ИП ВИЧ и делает его еще более привлекательным для применения у больных ВИЧ-инфекцией. Кроме того, небустированный ATV возможно использовать для упрощения существующего режима АРТ.
В 2014 г. были опубликованы результаты мета-анализа 5 рандомизированных клинических исследований, оценивавших стратегию переключения с бустированных ИП на неусиленный ATV [29]. В этих исследованиях приняли участие 1249 пациентов, которые были рандомизированы на 2 группы: упрощения режима с использованием неусиленного ATV и продолжения приема бустированного ИП. Мета-анализ показал отсутствие различий в эффективности между режимами (ОР = 1,04; 95% ДИ 0,99–1,10), при значимом улучшение показателей уровня общего холестерина (p = 0,0002), липопротеидов низкой плотности (р = 0,009) и ГБР при переключении на небустированный ATV.
Исследования в реальной клинической практике
Несмотря на то, что, в отличие от США и России, использование неусиленного ATV не лицензировано в ЕС, в реальной клинической практике было выполнено достаточно много исследований по применению ATV без RTV в стратегиях упрощения. В одном из таких когортных исследований оценивали переключение на прием неусиленного ATV и ABC/3TC пациентов, включенных в европейскую когорту EuroSIDA [30]. Учитывали исходы лечения пациентов, переведенных на прием ATV + ABC/3TC c ATV/r (27,1%), других ИП//r (9,7%) или других режимов (63,2%). Около трети пациентов имели вирусологическую неудачу предшествующей схемы, основанной на ИП (в соответствии с локальной инструкцией по медицинскому применению, у пациентов с предшествующей неудачей АРТ должен применяться только ATV/r). При анализе всех включенных в исследование пациентов (TLOVR; прекращение терапии по любой причине = неудача лечения) вирусологический ответ (РНК ВИЧ < 50 копий/мл) составил 89,5, 88 и 86,3% соответственно на 48-й, 96-й и 144-й неделе после переключения (см. таблицу). Факторами, связанными с вероятностью вирусологической неудачи, оказались минимальный уровень CD4+-лимфоцитов в анамнезе (ОР = 0,6 на каждые 100 клеток повышения), время с РНК ВИЧ < 50 копий/мл (ОР = 0,89 на каждые последующие 6 мес.) и предшествующая неудача режима, включающего ИП (ОР = 3,04). Таким образом, наименьший относительный риск неудачи был у пациентов, не имевших вирусологической неудачи режимов, включающих ИП, с более высоким уровнем CD4+-лимфоцитов на момент начала лечения и более долгим периодом поддержания неопределяемой вирусной нагрузки. Другие факторы (пол, возраст, коинфекция вирусными гепатитами, уровень CD4+-лимфоцитов на момент переключения, предшествующий третий агент) никак не влияли на поддержание вирусологического ответа. Авторы заключили, что упрощение режима при переключении на ATV + ABC/3TC ассоциируется с относительно низким риском неудачи и прекращением терапии по причине нежелательных явлений. Использование такой стратегии может быть рассмотрено у пациентов с длительной супрессией и без предшествующей неудачи терапии, включающей ИП.
При ретроспективном анализе 2 больших итальянских когорт S. Bonora и соавт. [31] отметили, что переключение на неусиленный ATV в комбинации с 2 НИОТ пациентов, получавших другие режимы (у 58,6% больных на момент переключения РНК ВИЧ < 50 копий/мл) было эффективным и хорошо переносилось пациентами. Показатели липидного обмена (уровень общего холестерина и триглицеридов) значимо улучшились при оценке на 48-й и 96-й неделе. Через 157 нед. наблюдения (по медиане) 77,5% пациентов продолжали получать ATV, прекратили прием по причине вирусологической неудачи и побочных эффектов только 4 и 0,8% пациентов соответственно.
Клинический пример.
Больной В., 35 лет, находился на амбулаторном учете в Федеральном научно-методическом центре по профилактике и борьбе со СПИДом с 2007 г. с диагнозом «ВИЧ-инфекция, стадия 3, бессимптомная». Антитела к ВИЧ впервые обнаружены 15.04.2005. При постановке на учет проводилось стандартное обследование. Показаний к АВТ не было.
В 2010 г. при плановом обследовании состояние удовлетворительное. Жалоб не предъявляет. Кожа и видимые слизистые оболочки обычной окраски, чистые. Лимфоузлы не увеличены. В легких выслушивается везикулярное дыхание над всей поверхностью, хрипов нет. Тоны сердца ясные, ритм правильный, шумов нет, ЧСС=PS – 76 уд. в минуту. АД – 110/70 мм рт. ст. Температура тела 36,5 °С. Живот мягкий, при пальпации безболезненный во всех отделах, печень у края реберной дуги. Селезенка не пальпируется. Симптом поколачивания отрицательный с обеих сторон. Физиологические отправления в норме. Очаговой и менингеальной симптоматики нет. Масса тела 75 кг.
Общий анализ крови: гемоглобин – 140 г/л, эритроциты – 4,35 × 1012/л, тромбоциты – 235 × 109/л, лейкоциты – 6,7 × 109/л, нейтрофилы – 4,23 × 109/л. Биохимическом анализ крови: общий билирубин – 7,7 мкмоль/л, прямой билирубин –2,1 мкмоль/л, АЛТ – 29 ЕД/л, АСТ – 23 ЕД/л, ГГТ – 32 ЕД/л. Показатели иммунитета: CD4+-лимфоциты – 345 клеток/мкл (17%). РНК ВИЧ – 168 200 копий/мл. HBsAg – отр., a-HCV – отр., RW – отр., тест на HLA B*5701 – отр. Рентгенография легких, УЗИ брюшной полости – без особенностей. Была назначена АРТ: EFV, d4T, 3TC.
Через 3 мес. АРТ: больного беспокоят головные боли, головокружения, слабость. Общий анализ крови: гемоглобин – 94 г/л, эритроциты – 3,35 × 1012/л, тромбоциты – 254 × 109/л, лейкоциты – 7,1 × 109/л, нейтрофилы – 4,91 × 109/л. CD4+-лимфоциты – 377 клеток/мкл, РНК ВИЧ – 5300 копий/мл. Принято решение заменить схему АРТ и назначить ATV/r, ABC, 3TC.
Через 3 мес. применения новой схемы: пациент жалуется на пожелтение склер. Объективно отмечается иктеричность склер, кожные покровы физиологической окраски. Общий анализ крови: гемоглобин – 132 г/л, эритроциты – 4,5 × 1012/л, тромбоциты – 215 × 109/л, лейкоциты – 6,3 × 109/л, нейтрофилы – 3,84 × 109/л. Биохимический анализ крови: общий билирубин – 55,4 мкмоль/л, прямой билирубин – 31,3 мкмоль/л, АЛТ – 26 ЕД/л, АСТ – 17 ЕД/л. CD4+-лимфоциты – 459 клеток/мкл (23%), РНК ВИЧ – неопределяемая.
Через 6 мес. применения новой схемы: жалобы на пожелтение кожи и склер. Объективно отмечается умеренная иктеричность кожи и склер. Общий билирубин –75,4 мкмоль/л, прямой билирубин – 51,3 мкмоль/л, АЛТ – 24 ЕД/л, АСТ – 18 ЕД/л. CD4+-лимфоциты – 496 клеток/мкл (26%), РНК ВИЧ – неопределяемая. Учитывая стабильную иммунологическую и вирусологическую эффективность схемы, а также нарастающую ГБР, больного перевели на прием АTV. Рекомендовано также пить больше жидкости.
Через 3 мес. приема АTV: жалоб не предъявляет. Больной отмечает большую удовлетворенность новой схемой в связи с меньшим количеством таблеток. Объективно отмечается легкая иктеричность склер. Общий билирубин – 52,6 мкмоль/л, прямой билирубин – 25,4 мкмоль/л, АЛТ – 25 ЕД/л, АСТ – 19 ЕД/л. CD4+-лимфоциты – 510 клеток/мкл (27%), РНК ВИЧ – неопределяемая.
В настоящее время пациент продолжает принимать схему АРТ, включающую АTV, ABC и 3TC в течение 4 лет.
Таким образом, у пациентов со стабильной вирусологической супрессией переключение с ATV/r на ATV позволяет добиться уменьшения или полной редукции ГБР и желтухи, сокращения суточного количества принимаемых таблеток без кардинального изменения схемы АРТ.


