Развитие в начале 2020 г. пандемии коронавирусной инфекции, вызванной вирусом SARS-CoV-2 (COVID- 19), затронуло все социальные группы, в том числе и больных ВИЧ-инфекцией. Перед специалистами были поставлены вопросы о наличии или отсутствии особенностей течения COVID-19 у этой категории пациентов. Оценивая вероятность развития тяжелого течения COVID-19, госпитализации и летального исхода, J.M. Tesoriero и соавт. [1] провели исследование с участием 2988 больных ВИЧ-инфекцией, проживающих в штате Нью-Йорк. К 15 июля 2020 г. 869 пациентов были госпитализированы, 207 из них умерли. После стандартизации пациентов по возрасту вероятность госпитализации больных ВИЧ-инфекцией по сравнению с ВИЧ-негативными лицами была выше в 2,61 раза, а вероятность летального исхода – в 2,55 раза. Среди больных ВИЧ-инфекцией афроамериканцев и выходцев из Латинской Америки заболеваемость COVID-19 была существенно выше. Наличие более «поздней» стадии ВИЧ-инфекции (стадия 3 по классификации CDC) повышало риск госпитализации на 69% (по сравнению со стадией 1). Однако в данном исследовании авторы не учитывали наличия сопутствующих заболеваний (сердечно-сосудистые заболевания, хроническое заболевание почек, диабет, онкозаболевания) и приема пациентами антиретровирусной терапии (АРТ), что могло повлиять на частоту госпитализации и тяжесть течения COVID-19.
Из 17 282 905 обследованных жителей Великобритании у 27 480 (0,16%) был установлен диагноз «ВИЧ-инфекция» [2]. После корректировки по возрасту и полу было обнаружено, что риск смерти от COVID-19 у лиц с ВИЧ-инфекцией выше – ОШ = 2,90 (95% ДИ 1,96–4,30; p < 0.0001). После выравнивания групп по социальному статусу, этической принадлежности, наличию ожирения, курению сигарет у ВИЧ-инфицированных сохранялся более высокий риск смерти от COVID-19 – ОШ = 2,59 (95% ДИ 1,74–3,84; p < 0.0001), а у представителей черной расы по сравнению с лицами, не относящимися к черной расе, риск летального исхода был выше – ОШ = 4,31 (95% ДИ 2,42–7,65) и 1,84 (95% ДИ 1,03–3,26; p = 0.044) соответственно. Исследователи предположили, что чернокожие граждане Великобритании могут иметь более высокий риск заражения коронавирусом, поскольку их профессиональная деятельность предусматривает бóльшее число контактов.
Специалисты трех Европейских стран (Германии, Испании и Италии) оценили факторы риска заболеваемости и смертности от COVID-19 на основании данных, полученных от 175 больных сочетанной инфекцией ВИЧ/COVID-19 за период до 12.06.2020. У 49 (28%) пациентов было отмечено тяжелое течение COVID-19, 7 (4%) умерли. Почти все пациенты получали АРТ, у 94% РНК ВИЧ была < 50 копий/мл. При однофакторном анализе было установлено, что возраст 50 лет и старше, минимальное количество CD4+-лимфоцитов (< 200 клеток/мкл), < 350 клеток/мкл на момент заболевания и наличие, по крайней мере, одного сопутствующего заболевания ассоциировались с тяжестью течения COVID-19. Не было выявлено взаимосвязи между тяжестью течения заболевания и полом, этнической принадлежностью, наличием ожирения, определяемом уровнем РНК ВИЧ, наличием предшествующего СПИД-индикаторного заболевания и использованием в схемах АРТ тенофовира (в большинстве случаев – тенофовира алафеномида) и ИП ВИЧ. При многовариантном анализе было обнаружено, что количество CD4+-лимфоцитов < 350 клеток/мкл перед заболеванием COVID-19 является единственным фактором, определяющим тяжесть течения коронавирусной инфекции – ОШ = 2,85 (95% ДИ: 1,26–6,44; p = 0.01). Кроме того, установлено, что количество CD4+-лимфоцитов < 200 клеток/мкл было единственным фактором, связанным с вероятностью летального исхода – ОШ = 10,11[(95% ДИ 1,19–86,10); p = 0,03) [3].
В качестве этиотропной терапии COVID-19, в соответствии с рекомендациями Минздрава России, следует использовать препараты фавипиравир, ремдесивир, умифеновир и ИФН-α (беременным рекомендован только рекомбинантный ИФН-α-2b). Специального раздела, посвященного особенностям лечения коронавирусной инфекции у больных ВИЧ-инфекцией, не представлено [4].
Во временных рекомендациях американских специалистов (26.02.2021) указано, что в настоящее время ремдесивир является единственным противовирусным средством от COVID-19, одобренным FDA. Дексаметазон обычно назначают пациентам с COVID-19, которым требуется кислородная поддержка. Показания к назначению этих препаратов для лечения больных ВИЧ-инфекцией, госпитализированных с COVID-19, те же, что и для пациентов без ВИЧ-инфекции [5].
В отечественной практике была показана эфффективность фавипиравира у больных с легким и среднетяжелым течением COVID-19. У получающих его пациентов клиническое улучшение наступало на 4 дня быстрее, чем у больных, получавших стандартную терапию (умифеновир + интраназальный ИФН-α-2b или гидроксихлорохин). Также на 5-й день лечения отмечали бóльшую частоту элиминации вируса у пациентов, принимавших фавипиравир: у 81,2% по сравнению с 67,9% в группе контроля (ОШ = 1,22; 95% ДИ 1,00–1,48; р = 0,022) [6].
Нет достоверных данных об эффективности антиретровирусных препаратов для профилактики и лечения COVID-19. Частота регистрации коронавирусной инфекции у лиц, получающих доконтактную профилактику ВИЧ (тенофовир/эмтрицитабин), не ниже, чем в основной популяции. Отсутствуют доказательства необходимости смены схемы АРТ у больных ВИЧ-инфекцией с целью профилактики или лечения COVID-19 [7].
При назначении терапии COVID-19 ВИЧ- инфицированным пациентам, получающим АРТ, необходимо оценить возможные лекарственные взаимодействия препаратов [5, 7]. С полным перечнем лекарственных взаимодействий можно ознакомиться на сайте https://www.covid19-druginteractions.org.
На фоне применения генноинженерных биологических препаратов (тоцилозумаба, олокизумаба, канакинумаба, барицитиниба и др.) в условиях острой вирусной инфекции повышается риск развития вторичных (бактериальных, грибковых) инфекций. Перед применением генноинженерных биологических препаратов и глюкокортикоидов необходимо исключить наличие у пациентов туберкулезной инфекции путем иммунологического тестирования методом ELISPOT, поскольку туберкулез является наиболее частым вторичным заболеванием у больных ВИЧ-инфекцией в России [5, 7, 8].
Генноинженерные биологические препараты в комбинации с кортикостероидами при наличии выраженного иммунодефицита (количество CD4+-лимфоцитов < 200 клеток/мкл) у больных ВИЧ-инфекцией следует применять с осторожностью, только по жизненным показаниям [7].
Таким образом, до настоящего времени не вполне ясно, существуют ли особенности течения и терапии COVID-19 у больных инфекцией ВИЧ.
Целью настоящего исследования было изучение характера течения и подходов к терапии COVID-19 у ВИЧ-инфицированных пациентов.
Материалы и методы
Исследование было ретроспективным, на 01.03.2021 под наблюдением находились 85 больных ВИЧ- инфекцией (68 мужчин и 17 женщин), перенесших коронавирусную инфекцию. Медиана возраста составила 39 (23–70) лет, старше 60 лет было 4 (4,7%) пациента. У всех РНК ВИЧ была < 50 копий/мл. Медиана количества CD4+-лимфоцитов – 602,5 (144–1140) клетки/ мкл, у 7 (9,5%) пациентов число CD4+-лимфоцитов было < 350 клеток/мкл. 76 пациентов получали АРТ: 30 – на основе ННИОТ, 10 – ИП и 36 – ИИ. 9 пациентов, обратившихся за консультативной помощью, АРТ не получали. Медиана количества CD4+-лимфоцитов среди этих пациентов – 342 (14–1142) клетки/мкл. У 5 (55,6%) пациентов количество CD4+-лимфоцитов составляло < 350 клеток/мкл. Медиана РНК ВИЧ – 69 915,5 копий/ мл (у 3 пациентов > 100 000 копий/ мл). 19 (22,4%) пациентов имели сопутствующие заболевания: гипертоническую болезнь, ИБС, постинфарктный кардиосклероз, сахарный диабет 2-го типа, ХГВ, ХГС, неспецифический язвенный или антибиотикоассоциированый колит, хронический гастрит, холецистит, панкреатит, мочекаменную болезнь и др. У 1 больного без АРТ (количество CD4+лимфоцитов – 14 клеток/ мкл) в анамнезе имела место двухсторонняя пневмония (бактериальная + пневмоцистная) и у 1 больного, получавшего АРТ, – лимфопролиферативное заболевание (количество CD4+-лимфоцитов – 340 клеток/ мкл).
У 45 пациентов COVID-19 был подтвержден обнаружением РНК SARS-CoV-2 из носоглотки методом ПЦР, у 45 – наличием в крови анти-SARS-CoV-2 IgG. У 3 пациентов с отрицательным результатом тестирования на РНК SARS-CoV-2 (апрель–май 2020 г.) и отсутствием данных о тестировании на анти-SARS-CoV-2 основанием для постановки диагноза была типичная картина изменений, полученная при компьютерной томографии (КТ) легких: у 2 – объем поражения легких 1-й степени (КТ1), у 1 – 3-й степени (КТ3). Всего КТ легких была выполнена 38 пациентам.
Использованы показатели описательной статистики: среднее значение со стандартным отклонением, медиана, минимальные и максимальные значения. Номинальные/дискретные данные представлены абсолютными и относительными (в %) частотами.
Результаты
У 22 (25,9%) пациентов заболевание имело среднетяжелое течение (7 получали лечение в стационаре, 15 – амбулаторно); у 63 (74,1%) – легкое (60 лечились амбулаторно, 3 – в стационаре). 2 пациента заболели COVID-19 повторно (оба получали АРТ; количество CD4+-лимфоцитов – 450 и 545 клеток/мкл; РНК ВИЧ < 50 копий/мл). У одного 1-й эпизод протекал легко, 2-й имел среднетяжелое течение. Исследование мазка на РНК коронавируса из носоглотки методом ПЦР дало положительный результат, На КТ легких были выявлены изменения 2-й степени. У второго пациента 1-й эпизод имел среднетяжелое течение: была диагностирована пневмония, в сыворотке крови обнаружены анти-SARSCov-19 IgG в диагностических титрах; 2-й эпизод протекал легко, в мазке из носоглотки обнаружена РНК SARS-CoV-19, на КТ легких изменений не выявлено.
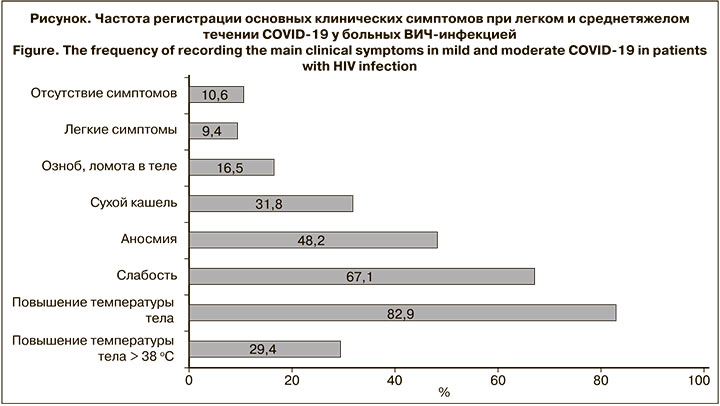
Тяжелого течения заболевания не отмечено. Отсутствие клинических симптомов или симптоматика легкой степени выраженности (заложенность носа, отсутствие обоняния, боли в горле) имели место у 17 (20%) пациентов (см. рисунок). Повышение температуры тела регистрировали у 63 (82,9%) чел., в том числе выше 38 оС – у 25 (29,4%). Среди других симптомов преобладали слабость (67,1%), потеря обоняния (53,9%), сухой кашель (35,5%), одышка (5,3%), а также симптомы интоксикации (головная боль, озноб, ломота в мышцах, боль в горле). 1 пациент предъявлял жалобы на диарею. Изменения на КТ легких регистрировали у 28 (73,7%) из 38 пациентов: объем поражения легких 1-й степени (КТ1) – у 19, КТ2 – у 8, КТ3 – у 1.
21 (24,7%) из 85 больных терапии коронавирусной инфекции не получал. АРТ препаратами фавипиравир или рамдесивир получали 4 (6,25%) пациента, лопинавир/ритонавир – 1, гидроксихлорохин в сочетании с антибактериальной терапией (АБТ) – 10 (15,6%), АБТ – 48 (75%), антикоагулянты – 14 (21,9%), кортикостероиды – 3(4,9%); ИФН-α-2b – 1 пациент.
В качестве иллюстрации приводим краткую выписку из амбулаторной карты больного ВИЧ-инфекцией, перенесшего COVID-19 в легкой форме.
Пациент Д., 1973 г. р. Диагноз ВИЧ-инфекции установлен в 2000 г. Более 10 лет получает АРТ. Последняя схема с августа 2020 г. – фосфазид/ламивудин + элсульфавирин. Каждые 3 мес. регулярно проходит диспансерное обследование. 26.08.2020 количество CD4+-лимфоцитов – 690 клеток/мкл (34%); РНК ВИЧ < 50 копий/мл. 10.09.2020 у жены пациента диагностирован COVID-19: в мазке из носоглотки методом ПЦР обнаружена РНК SARS-Cov2, при КТ легких объем поражения составил 15%. Женщина получала лечение амбулаторно. У пациента Д. мазок из носоглотки показал отрицательный результат, повышения температуры тела отмечено не было. В течение 2–3 дней беспокоило чувство заложенности носа, аносмии не было. Лечения COVID-19 не получал. 10.10.2020 пациент самостоятельно сдал кровь на анти-SARS-CoV-2. Методом ИФА выявлены анти-SARS-CoV-2 IgM – 5,66 ед (положительный результат > 2 ед), IgG – 89,59 ед (положительный результат > 10 ед). Каких-либо жалоб пациент не предъявлял, дополнительной терапии не получал. При очередном обращении в СНИО ЭП СПИД 17.11.2020 количество CD4+-лимфоцитов – 491 клетка/мкл (29%); РНК ВИЧ < 50 копий/мл. Не обнаружено изменений в показателях периферической крови и биохимического анализа крови. При следующем визите 16.02.2021 количество CD4+-лимфоцитов – 582 клетки/ мкл (32%); РНК ВИЧ < 50 копий/мл. Существенных изменений в показателях периферической крови и биохимического анализа крови выявлено не было.
Таким образом, у больного ВИЧ-инфекцией, регулярно получавшего эффективную схему АРТ, течение COVID-19 было легким, практически бессимптомным и не требовало дополнительной терапии. Вместе с тем, отмечено некоторое снижение абсолютного и относительного количества CD4+-лимфоцитов (при неопределяемом уровне РНК ВИЧ в плазме крови), что, возможно, связано с COVID-19.
Заключение
Риск развития тяжелого течения COVID-19 у больных ВИЧ-инфекцией, возможно, выше, чем у ВИЧ-отрицательных лиц, что в значительной степени обусловлено отсутствием эффективной АРТ и низким количеством CD4+-лимфоцитов (< 350 клеток/мкл), особенно их минимальным содержанием. Согласно результатам многочисленных исследований, у пациентов как с ВИЧ-инфекцией, так и без нее, повышен риск более тяжелого течения COVID-19 у лиц старшего возраста, а также страдающих сердечно-сосудистыми заболеваниями, хроническими заболеваниями легких, диабетом. Риск смерти от коронавирусной инфекции у больных ВИЧ-инфекцией, вероятно, сопоставим с риском для лиц, не инфицированных ВИЧ [1–3, 5].
Среди наших пациентов у 3/4 больных ВИЧ-инфекцией коронавирусная инфекция протекала легко, у 20% – бессимптомно либо со стертой симптоматикой, что, вероятно, связано с регулярным диспансерным наблюдением за этой категорией пациентов, наличием эффективной АРТ у 89,4%, молодым возрастом больных и отсутствием у большинства пациентов сопутствующих заболеваний.
Как и в общей популяции пациентов с COVID-19, больным ВИЧ-инфекцией избыточно назначали АБТ (в 76,6% случаев). Согласно 10-й версии рекомендаций Минздрава России, подавляющее большинство пациентов с COVID-19, особенно при легком и среднетяжелом течении, не нуждаются в назначении АБТ. Ее назначают только при наличии убедительных признаков присоединения бактериальной инфекции [4].
У всех пациентов, находившихся под нашим наблюдением, заболевание COVID-19 закончилась выздоровлением. Не отмечено зависимости тяжести течения COVID-19 от получаемой пациентами схемы АРТ. В настоящее время отсутствуют достоверные данные об эффективности антиретровирусных препаратов для профилактики и лечения коронавирусной инфекции. При заболевании COVID-19 ВИЧ-инфицированных пациентов, получающих АРТ, следует продолжить АРТ по прежней схеме, а лечение COVID-19 проводить с учетом лекарственных взаимодействий.


