Вирусные гепатиты продолжают оставаться серьезной проблемой для мировой системы здравоохранения. По данным ВОЗ, в настоящее время из 2 млрд людей, инфицированных вирусом гепатита В (HBV), 240 млн человек страдают хроническим гепатитом В (ХГВ) [1].
Пациенты с ХГВ обладают повышенным риском прогрессирования заболевания до цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) с высокой вероятностью летального исхода [2–4]. ХГВ входит в список 10 наиболее распространенных причин смертности в мире. От 310 до 340 тыс. больных ХГВ ежегодно умирают от декомпенсированного ЦП или ГЦК [5], а доля поражения печени, обусловленного HBV, в структуре показаний к трансплантации печени составляет 5–10%. Скорректированная по возрасту смертность у носителей HBsAg в 3–3,6 раз выше, чем у людей без HBV-инфекции [6].
ХГВ может протекать в различных клинико-серологических вариантах: от бессимптомного носительства до прогрессирующего ХГВ [7, 8].
Выделяют 2 варианта ХГВ в зависимости от статуса е-антигена: HВeAg-позитивный и HBeAg-негативный. В последнее десятилетие в мировой структуре заболевания происходит увеличение доли HBeAg-негативного ХГВ на фоне снижения HBeAg-позитивного [9]. Это приводит к превалированию данной формы заболевания во многих регионах мира, включая Европу [8, 10, 11]. В России, по разным данным, удельный вес HBeAg-негативного ХГВ может составлять от 70 до 90% [9, 12].
В настоящее время идентифицировано 10 генотипов HBV. Самыми распространенными являются генотипы А, В, С и D [13, 14]. На территории РФ преобладает генотип D [15, 16]
Основная цель лечения ХГВ – повышение качества и продолжительности жизни путем предотвращения прогрессирования болезни в ЦП, декомпенсации цирроза, развития терминального поражения печени, ГЦК и смерти. Достичь этой цели можно путем стойкого подавления репликации вируса и поддержания виремии на минимальном уровне в течение длительного времени. Поэтому главной задачей лечения считается уменьшение уровня ДНК HBV в крови, нормализация активности АлАТ и АсАТ, уменьшение некрозо-воспалительной активности гепатита и уменьшение степени выраженности фиброза печени [17].
Международный опыт противовирусного лечения ХГВ к настоящему времени суммирован в международных рекомендациях трех крупнейших медицинских сообществ, занимающихся проблемами изучения болезней печени: Европейской (EASL), Американской (AASLD) и Азиатско-Тихоокеанской (APASL) ассоциаций. В 2015 г. впервые выпустила рекомендации по лечению гепатита Всемирная организация здравоохранения (ВОЗ). В России клинические рекомендации по гепатиту В представлены Российской гастроэнтерологической ассоциацией совместно с Российским обществом по изучению печени – РОПИП (обновлены в 2014 г.). Рекомендации служат руководством для практических врачей, осуществляющих ведение и лечение пациентов с ХГВ на разных стадиях заболевания, и подлежат регулярному пересмотру в соответствии с новыми данными научных исследований в области гепатита В.
В своей статье мы бы хотели провести сравнительную характеристику основных международных и российских рекомендаций по отбору пациентов с ХГВ для противовирусной терпапии (ПВТ) и сравнить тактику лечения этой категории больных.
Критерии отбора пациентов с ХГВ для назначения ПВТ
В своем выступлении на 13-м Международном симпозиуме по вирусным гепатитам и заболеваниям печени международный эксперт Анна Лок (США) отметила, что потенциально все инфицированные HBV являются кандидатами для проведения ПВТ, вопрос состоит в том, когда должно быть начато противовирусное лечение, чтобы оно было эффективным и рентабельным [18].
Для принятия решения о начале терапии используют главным образом 3 критерия: уровень ДНК HBV в сыворотке крови, активность АлАТ и тяжесть поражения печени.
В европейских рекомендациях (2012), принятых на согласительной конференции Европейского общества по изучению заболеваний печени (European Association for the Study of the Liver – EASL), и российских рекомендациях (2014) показания к противовирусному лечению одинаковы как для HBeAg-позитивных, так и для HBeAg-негативных больных ХГВ. Согласно этим рекомендациям, ПВТ назначается при уровне ДНК HBV > 2000 МЕ/мл и/или активности АлАТ, превышающей верхнюю границу нормы (30 МЕ/мл – для мужчин и 19 МЕ/мл – для женщин), если наблюдается умеренный либо сильно выраженный воспалительно-некротический процесс и/или, по крайней мере, умеренный фиброз (более 1 балла по шкале METAVIR) [17, 19].
По последним практическим рекомендациям Американской ассоциации по изучению болезней печени (AASLD), показания к назначению противовирусных препаратов для HBeAg-позитивных и HBeAg-негативных пациентов различаются. В соответствии с рекомендациями AASLD, противовирусные препараты следует назначать пациентам с HBeAg-позитивным ХГВ при уровне вирусной нагрузки > 20 000 МЕ/мл и уровне активности АлАТ ≥ 2 норм. Пациентам с HBeAg-негативным ХГВ ПВТ показана при уровне вирусной нагрузки > 2000 МЕ/мл и уровне активности АлАТ ≥ 2 норм. Если пациент с HBeAg-позитивным ХГВ имеет ориентируемый на лечение уровень вирусной нагрузки, а уровень АлАТ не превышает 2 норм, то для решения вопроса о назначении ПВТ рекомендуется выполнение пункционной биопсии печени. Пациентам с HBeAg-негативным гепатитом В для принятия данного решения рекомендуется та же манипуляция при уровне вирусной нагрузки > 2000 МЕ/мл и уровне активности АлАТ ≤ 2 норм [20].
Таким образом, европейские и российские эксперты более склонны определять показания к ПВТ по индексу гистологической активности или фиброзу печени, а американские эксперты в большей степени ориентируются на уровень вирусной нагрузки, активность АлАТ и затем уже на гистологическую активность. Но при этом эксперты объединились во мнении, что однозначным показанием к ПВТ как для HBeAg-позитивных, так и для HBeAg-негативных пациентов является повышение уровня АлАТ выше нормы в 2 раза и уровень вирусной нагрузки > 20 000 МЕ/мл. В таком случае ПВТ рекомендуется начинать даже без проведения биопсии печени. Биопсия или исследование печеночной ткани неинвазивными методами у этой категории лиц могут быть полезны для диагностики, но, как правило, полученный результат не влияет на решение о проведении терапии. Также, согласно общему мнению экспертов, назначение противовирусного лечения целесообразно HBeAg-позитивным пациентам с высоким уровнем репликации вируса, нормальной активностью аминотрансфераз и отсутствием гистологической активности гепатита, то есть пациентам в фазе иммунной толерантности, в возрасте старше 30 лет (по мнению американских ученых – старше 40 лет) с семейным анамнезом ГЦК или ЦП [17, 19, 20].
Согласно рекомендациям ВОЗ, показания к ПВТ ХГВ главным образом зависят от возраста пациента, активности АлАТ и уровня ДНК HBV. Так, лечение рекомендуется пациентам в возрасте старше 30 лет, с повышенным уровнем АлАТ и ДНК HBV > 20 000 МЕ, независимо от статуса HBeAg. Причем здесь эксперты ВОЗ делают пометку, что при недоступности теста на уровень вирусной нагрузки решение о лечении базируется на повышении уровня АлАТ [1].
В приоритетном порядке, согласно всем международным и национальным рекомендациям, ПВТ назначается пациентам с ЦП при любом определяемом уровне виремии, независимо от активности АлАТ [1, 17, 19, 20].

ПВТ ХГВ
В настоящее время в лечении ХГВ существует 2 стратегических терапевтических направления. Первое из них основано на применении препаратов интерферона (ИФН) с множественными механизмами воздействия: противовирусным, иммуномодулирующим, антипролиферативным и антифибротическим [21–23]. Для лечения ХГВ зарегистрированы 2 типа препаратов ИФН-α – стандартный и пегилированный. Предпочтение отдается пегилированной форме (ПегИФН-α). Лечение ПегИФН-α в течение 48 нед. показало снижение вирусной нагрузки ДНК до неопределяемого уровня (< 400 копий/мл) у 25% пациентов, нормализацию АлАТ – у 38%, уменьшение некрозо-воспалительной активности в ткани печени – у 52%. Сероконверсия HBeAg произошла в 27% случаев [24, 25]. У 86% больных, ответивших на первичный курс лечения, сероконверсия HBeAg сохранялась через 1 год после его окончания [26].
Исчезновение HBsAg при лечении HBeAg-позитивного гепатита в течение 48 нед. произошла в 7% случаев [27]. Проведенные в США и Европе исследования по лечению больных ХГВ пегасисом показали, что в HBeAg-положительной когорте больных, у которых при лечении ПегИФН произошел сероклиренс HBeAg, через 3 года после завершения терапии в 45% случаев виремия не превышала 400 копий/мл, в 30% случаев наблюдался сероклиренс HBsAg [28].
У HBeAg-негативных пациентов через 48 нед. лечения неопределяемый уровень вирусной нагрузки ДНК был достигнут в 63% случаев, нормализация уровня АлАТ – в 39%, улучшение гистологии печени – в 48% [22].
В HBeAg-отрицательной группе больных на протяжении трех лет наблюдения после завершения терапии пегасисом целевой уровень виремии (< 20 000 МЕ/мл) сохранялся у 30% больных. Частота клиренса HBsAg увеличивалась с течением времени после окончания курса лечения: с 5% через год до 11% после четырех лет наблюдения [29]. Потеря HBsAg больными ХГВ при применении ПегИФН через 5 лет после годового курса терапии составила 12%.
Препарат значительно лучше проявил себя в популяции с HBV генотипа А, так как HBeAg-сероконверсия, улучшение гистологических показателей печеночного воспаления и фиброза достоверно чаще наблюдалось при инфицировании возбудителем генотипа А по сравнению с генотипами В, С и D (52, 30, 31 и 22% соответственно) [30, 31]. К недостаткам ПегИФН следует также отнести высокую стоимость лечения, меньшую эффективность у больных с HBeAg-негативным ХГВ. Значимым негативным моментом интерферонотерапии является исключение ее применения у больных субкомпенсированным и особенно декомпенсированным ЦП и после трансплантации печени [32]. ПегИФН вводится парентерально, требует хранения в холодильнике, что создает неудобства для пациента. Также ИФН обладают значительным числом побочных эффектов.
Второе направление использует химиотерапевтические препараты – синтетические аналоги нуклеоз(т)идов, обладающие исключительно противовирусным действием.
К 2015 г. для лечения ХГВ могут быть использованы 6 аналогов нуклеоз(т)идов. Применяются нуклеозидные (ламивудин, телбивудин, эмтрицитабин, энтекавир) и нуклеотидные (адефовир и тенофовир) аналоги. Эти препараты блокируют репликацию HBV в клетках печени и других органах инфицированного, что приводит к быстрому снижению числа вирусных частиц в цитоплазме гепатоцитов и, соответственно, в крови больного.
В отличие от ИФН эти препараты удобны в применении, характеризуются отсутствием влияния генотипа HBV на исходы лечения и серьезных нежелательных побочных явлений [33, 34]. Но наряду с преимуществами у этого класса препаратов имеется ряд недостатков. Прежде всего, это отсутствие в большинстве случаев стойкого вирусологического ответа и связанная с этим неопределенная к настоящему времени длительность лечения HBeAg-негативного ХГВ. Другой серьезной проблемой при долгосрочном применении аналогов нуклеоз(т)идов является развитие резистентности к ним. Энтекавир и тенофовир обладают мощным противовирусным свойством и характеризуются высоким генетическим барьером к развитию резистентности [35, 36]. Ламивудин относится к недорогим препаратам, но длительная монотерапия очень часто сопровождается развитием резистентности [21, 37]. Адефовир менее эффективен и дороже тенофовира. Телбивудин – мощный ингибитор репликации HBV, но к нему быстро развивается резистентность у пациентов с высоким исходным уровнем ДНК HBV или с определяемым уровнем ДНК HBV через 6 мес. лечения [38]. Некоторые аналоги неклеоз(т)идов обладают активностью как против HBV, так и против ВИЧ. К таким препаратам относятся ламивудин, эмтрицитабин, тенофовир и, в меньшей степени, энтекавир [39].
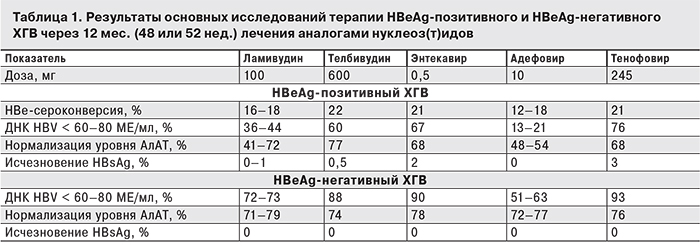
Результаты основных исследований терапии HBeAg-позитивного и HBeAg-негативного ХГВ через 12 мес. (48 или 52 нед.) лечения аналогами нуклеоз(т)идов приведены в табл. 1 [17].
Согласно рекомендациям AASLD, EASL и российским рекомендациям, в настоящее время существуют 2 разные стратегии лечения HBeAg-позитивного и HBeAg-негативного ХГВ: курсовое применение ПегИФН или аналогов нуклеоз(т)идов и длительная терапия аналогами нуклеоз(т)идов [17, 19, 20].
Стратегия курсовой терапии применяется у HBеAg-позитивных пациентов с высокой вероятностью анти-HBe-сероконверсии. Рекомендуется 48-недельный курс ПВТ ПегИФН, обеспечивающий наибольшую вероятность сероконверсии с появлением анти-HBe. Эта стратегия может применяться и у HBеAg-негативных пациентов, поскольку это практически единственный вариант возможного получения стойкого вирусологического ответа после завершения терапии. Курсовая терапия может проводиться и аналогами нуклеоз(т)идов, но для курсового лечения можно применять только наиболее активные из них с высоким барьером резистентности. Если при лечении аналогами нуклеоз(т)идов HBеAg-позитивных больных наступает сероконверсия в анти-HBe, то терапию нужно продолжать не менее 12 мес. [40]. Продолжительный эффект после окончания лечения (стойкая HBe-сероконверсия) можно ожидать у 40–80 % таких пациентов [41–43].
Длительное лечение аналогами нуклеоз(т)идов необходимо, если у пациента не наблюдается стойкого вирусологического ответа после прекращения лечения, и требуется продление терапии, то есть у HBeAg-позитивных пациентов без HBe-сероконверсии и у HBeAg-негативных пациентов. В качестве монотерапии первой линии должны использоваться наиболее мощные препараты с оптимальным профилем резистентности – тенофовир и энтекавир. Эффективность, безопасность и переносимость энтекавира и тенофовира при длительном приеме не изучены. При монотерапии тенофовиром и энтекавиром в течение 3 лет и более удается поддерживать вирусологическую ремиссию у большинства больных [44–46].

Таким образом, согласно AASLD, EASL и российским рекомендациям, препаратами первой линии для лечения ХГВ в настоящее время являются ПегИФН, энтекавир и тенофовир. Остальные аналоги нуклеоз(т)идов применяются, когда энтекавир или тенофовир недоступны или в особых группах пациентов [17, 19, 20].
При выявлении резистентности должна быть начата соответствующая терапия наиболее эффективным противовирусным препаратом, который не обладает перекрестной резистентностью с предыдущим, чтобы избежать развития множественной лекарственной резистентности (табл. 2) [17, 19].
В свою очередь ВОЗ в качестве препаратов первой линии рекомендует использовать только тенофовир или энтекавир, преимущественно в качестве длительной (пожизненной) терапии. Эксперты ВОЗ утверждают, что необходимо избегать монотерапии ламивудином, эмтрицитабином и телбивудином (если возможно) из-зи риска развития лекарственной устойчивости и трудностей ее мониторирования. Они не исключают также и курсового приема аналогов нуклеоз(т)идов у HBeAg-позитивных пациентов при наличии признаков сероконверсии HBe-антигена в ассоциации с сохраняющимся нормальным уровнем АлАТ и неопределяемым уровнем ДНК ВГВ с последующим мониторированием.
Что касается применения ИФН, то ВОЗ не рекомендует их в качестве препаратов первой линии ПВТ, так как они малоприменимы в условиях ограниченных ресурсов: требуют назначения инъекций, затратны, плохо переносятся, требуют постоянного мониторинга и имеют ряд противопоказаний [1].
По мнению экспертов всех сообществ по изучению болезней печени, у больных с ЦП терапия аналогами нуклеоз(т)идов – энтекавиром либо тенофовиром – должна проводиться пожизненно [1, 17, 19, 20].
Аналоги нуклеоз(т)идов выводятся почками, соответственно во всех случаях перед началом лечения необходимо исследовать уровень и клиренс креатинина. К факторам риска повреждения относят один или несколько из следующих: декомпенсированный ЦП, клиренс креатинина < 60 мл/мин, плохо контролируемая артериальная гипертензия, протеинурия, декомпенсированный диабет, активный гломерулонефрит, прием нефротоксичных препаратов, трансплантация солидных органов. Мониторирование почечной функции на фоне лечения аналогами нуклеотидов (адефовир, тенофовир) должно включать определение уровня сывороточного креатинина (клиренс креатинина) и фосфатов сыворотки крови у всех пациентов с ХГВ. Рекомендуется следующий режим мониторирования почечной функции на фоне лечения: у пациентов без факторов риска повреждения почек в течение первого года – каждые 3 мес., далее – 1 раз в 6 мес. при стойко хороших показателях; у пациентов с факторами риска повреждения почек – ежемесячно в течение первых 3 мес., затем, при стабильных показателях – каждые 3 мес. до окончания первого года терапии и далее – каждые 6 мес. в случае отсутствия ухудшения почечной функции. Если на фоне лечения клиренс креатинина снижается до уровня < 60 мл/мин или уровень фосфатов составляет < 2 мл/дл, то мониторирование почечной функции должно быть очень тщательным [1, 17]. В процессе лечения препаратами из группы аналогов нуклеозидов (ламивудин, телбивудин, энтекавир) рекомендуется исследование уровня сывороточного креатинина лишь у больных ХГВ, имеющих высокий риск почечных осложнений, и у данной группы пациентов режим мониторирования почечной функции должен быть таким же, как приведено выше для пациентов, получающих тенофовир и адефовир [1, 17]. У ВИЧ-инфицированных пациентов описано снижение минеральной плотности костной ткани на фоне терапии тенофовиром. В настоящее время проводятся исследования денситометрии костей у больных ХГВ, получающих тенофовир. Продолжается изучение канцерогенности энтекавира при длительном применении у больных ХГВ. При лечении телбивудином у больных ХГВ описаны редкие случаи миопатии. Безопасность длительного применения комбинации нескольких аналогов нуклеоз(т)идов, включающих тенофовир и энтекавир, пока не изучена [17].
Лечение пациентов с коинфекцией ВИЧ/HBV
Лечение пациентов с коинфекцией ВИЧ и HBV имеет свои особенности. Согласно российским рекомендациям и рекомендациям ВОЗ, у всех пациентов с коинфекцией ВИЧ/HBV и признаками активного поражения печени рекомендуется начинать антиретровирусную терапию (АРТ), независимо от стадии заболевания, количества CD4+-лимфоцитов и уровня РНК ВИЧ [1, 47, 48].
Препараты против ВГВ включаются в схему АРТ. Она должна включать 2 препарата, активных против и ВИЧ, и HBV. Желательно, чтобы это были тенофовир и эмтрицитабин или ламивудин [1, 47, 48].
У пациентов с коинфекцией ВИЧ/HBV быстро появляются штаммы HBV, устойчивые к ламивудину. Даже при применении высоких доз ламивудина (300 мг в сутки) через 2 года лечения устойчивые штаммы появляются почти у 50% пациентов с коинфекцией, а через 4 года – у 90% [49].
При развитии резистентности HBV к ламивудину у пациента, ранее получавшего схему АРТ, не включавшую тенофовир, его необходимо назначить вместо другого НИОТ. В качестве альтернативы при невозможности назначения тенофовира дополнительно к АРТ рекомендуется назначение энтекавира в дозе 1 мг в сутки как четвертого препарата [47].
Необходимо помнить, что после отмены препаратов, обладающих активностью против ВИЧ/HBV, может развиваться клинически активный гепатит. Описаны даже редкие случаи фульминантной печеночной недостаточности. Поэтому к любому прерыванию лечения у пациентов с сочетанной инфекцией ВИЧ/HBV следует подходить очень осмотрительно, в особенности у пациентов с ЦП, поскольку прекращение приема препаратов, активных против HBV, может привести к декомпенсации печеночной недостаточности [1, 47, 48].
Как известно, рекомендации по диагностике и лечению различных заболеваний основываются на распространенности этих заболеваний в той или иной стране, особенностях клинического течения, диагностики и возможностях национальной системы здравоохранения. Проанализировав основные международные и национальные рекомендации по диагностике и лечению ХГВ (табл. 3), можно выделить несколько основных позиций, в которых мнения экспертов объединились:
- В настоящее время для лечения ХГВ используют ПегИФН и аналоги нуклеоз(т)идов.
- Нуклеоз(т)идными аналогами первого ряда в лечении ХГВ являются энтекавир и тенофовир, остальные препараты из этой группы применяются, когда энтекавир или тенофовир недоступны или не могут быть использованы.
- У HBеAg-позитивных пациентов с высокой вероятностью анти-HBe-сероконверсии может применяться курсовая терапия ПегИФН или аналогами нуклеозидов.
- Долгосрочная терапия аналогами нуклеозидов рекомендована HBeAg-негативным пациентам, HBeAg-позитивным пациентам без сероконверсии и больным с ЦП, независимо от их HВe-статуса и достижения сероконверсии на фоне лечения.
- У больных с коинфекцией ВИЧ/HBV наличие ХГВ является самостоятельным показанием для назначения АРТ, схема которой должна включать тенофовир и эмтрицитабин (или ламивудин). При развитии резистентности ВИЧ к этим препаратам их отмена не рекомендуется во избежание обострения течения ХГВ.
Таким образом, адекватное применение противовирусных препаратов позволит улучшить выживаемость пациентов, уменьшить летальность, риск развития ЦП и ГКЦ и оптимизировать затраты на лечение.


