По данным ВОЗ, вирусом гепатита В (HBV) в мире инфицировано около 2 млрд человек, около 350 млн человек имеют хроническую инфекцию, около 600 000 человек ежегодно умирают от острой или хронической формы гепатита В [1].
В России отмечаются стабильно высокие уровни заболеваемости впервые выявленными хроническими формами гепатитов, из которых хронический гепатит В (ХГВ) составляет 24,1% [2]. Несмотря на проведение вакцинации против гепатита В и снижение заболеваемости острым гепатитом В во всех возрастных группах, в 2010 г. среди заболевших довольно значительным был удельный вес детей 1-го года жизни – 27,4%, показатель «носительства» HBV у них превышал показатель «носительства» среди детей до 17 лет в 4,4 раза [3]. Исходом инфицирования HBV на 1-ом году жизни в 90% случаев является ХГВ [1].
Основной путь инфицирования HBV детей 1-го года жизни – вертикальная передача от матери [4, 5]. Частота выявления HBsAg у беременных в Российской Федерации на протяжении последних лет составляет около 1,0–1,3 %, а частота выделения HBsAg у новорожденных детей от матерей-носителей HBV – 2,6% [3]. ХГВ у беременных характеризуется маловыраженной симптоматикой [6] и у 80% женщин во время беременности выявляется впервые [7].
Инфицирование HBV ребенка от матери происходит, главным образом, во время родов, но может происходить трансплацентарно, редко – постнатально [5]. Ведущим фактором риска вертикальной передачи HBV считают высокий уровень вирусной нагрузки у матери во время беременности и в момент родов [5, 6].
Известно, что элиминация вируса и патогенез заболевания в значительной степени опосредованы адаптивным иммунным ответом на HBV-инфекцию [8]. Дефицит клеточного иммунного ответа сопровождается высоким уровнем репликации HBV в печени пациентов даже при отсутствии цитологических нарушений или воспаления [8].
Цель исследования – изучение вирусной нагрузки и показателей иммунного статуса у женщин с хронической HBV-инфекцией в III триместре беременности.
Материалы и методы
Исследование у беременных с хронической HBV-инфекцией проводили согласно правилам национального стандарта Российской Федерации (ГОСТ Р 52379–2005) «Надлежащая клиническая практика» на основании заключения ЛЭК Сибирского государственного медицинского университета (регистрационный № 1371 от 19.04.2010). В исследование были включены 50 беременных с подтвержденным диагнозом ХГВ в фазе репликации, без дельта-инфекции, подписавших информированное согласие. Контрольную группу составили 34 практически здоровые беременные.
Исследование маркерного спектра проводили методом иммуноферментного анализа (ИФА) с использованием наборов реагентов для диагностики гепатита В ЗАО «Вектор-Бест» (Новосибирск). Выявление ДНК HBV в сыворотке крови осуществляли методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией с использованием набора реагентов «АмплиСенсR HBV-FL» (Москва). Количественное содержание ДНК HBV (вирусная нагрузка) определяли методом ПЦР в режиме реального времени с использованием тестовых систем компании «ДНК-Технология» (Москва).
Иммунофенотипирование лимфоцитов периферической крови проводили методом лазерной проточной цитофлуориметрии с использованием моноклональных антител к дифференцировочным антигенам лимфоцитов периферической крови на проточном цитофлуориметре COULTERR EPICSR XL («Beckman Coulter», США). В периферической крови у беременных на сроке 28–36 нед были определены относительное и абсолютное количество показателей иммунного статуса: CD3+, CD3+CD4+, CD3+CD8+, CD3+CD4+/CD3+CD8+, CD3-CD16+56+, CD19+, CD3+HLA-DR+, NKT-клетки.
Определение сывороточных иммуноглобулинов классов M, A, G проводили методом ИФА с использованием тестовых систем «Иммуноскрин-G, M, A – ИФА – БЕСТ» (ЗАО «Вектор-Бест», Новосибирск). Определение циркулирующих иммунных комплексов (ЦИК) в сыворотке крови выполняли с помощью 4% раствора полиэтиленгликоля методом преципитации.
Статистическую обработку полученных данных проводили с помощью программы PASW Statistics for Windows® Release 18.0. Проверку выборок на соответствие нормальному закону распределения выполняли на основании критерия Шапиро–Уилка. Оценку показателей клеточного и гуморального иммунного статуса проводили с использованием параметрического критерия Стьюдента для независимых выборок (t). Уровень вирусной нагрузки рассчитывали на основании медианы (Ме) и интерквартильной широты [Q1; Q3]. Оценку динамики вирусной нагрузки определяли с помощью непараметрического критерия Уилкоксона (в парных выборках). Проверку статистической значимости различий между относительными частотами событий проводили с помощью критерия χ². Анализ взаимосвязей между количественными данными, подчиняющихся нормальному закону распределения, выполняли на основании параметрического коэффициента Пирсона, для остальных данных определяли непараметрический коэффициент ранговой корреляции Спирмана. Различие сравниваемых величин считали статистически значимыми при уровне p < 0,05.
Результаты и обсуждение
Средний возраст беременных с ХГВ составил 28,5 ± 0,8 года, в контрольной группе – 28,9 ± 0,6 года. Распределение пациенток с ХГВ по классификации ВОЗ было следующим: в возрасте 18–23 лет (ранний репродуктивный период) – 7 (14,0%) женщин, 24–35 лет (репродуктивный период) – 39 (78,0%), 36–45 лет (поздний репродуктивный период) – 4 (8,0%). В группе контроля в возрасте 18–23 лет было 5 (14,7%) женщин, 24–35 лет – 26 (76,5%), 36–45 лет – 3 (8,8%).
Предположительный срок заболевания ХГВ у беременных был от 0 до 12 лет (в среднем 5,7 ± 1,1 года).
Состояние всех беременных с ХГВ было удовлетворительным. Проявлений интоксикационного и желтушного синдромов не отмечалось. Биохимические показатели у большинства беременных с ХГВ не имели отклонений от нормы. Повышение уровня общего билирубина выше нормы (до 30,4 мкмоль/л) было зарегистрировано лишь у 1 (2,0%) из 50 беременных с ХГВ, синдром цитолиза в виде повышения АЛТ (максимально до 167 МЕ) – у 3 (6,0%), повышение АСТ (максимально до 133 МЕ) – у 2 (4,0%). Ультразвуковое исследование показало отсутствие признаков цирроза печени у беременных с ХГВ.
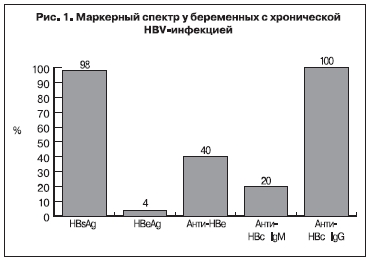
Исследование маркерного спектра у беременных с хронической HBV-инфекцией показало наличие HBsAg, основного маркера HBV-инфекции, у 49 (98,0%) женщин (рис. 1), у 1 (2,0%) женщины он был отрицательным, несмотря на положительные результаты ПЦР на ДНК HBV. HBeAg, который считается маркером высокой инфекциозности крови и указывает на высокий риск вертикальной передачи HBV [5], был выявлен лишь у 2 (4,0%) женщин. Антитела к HBeAg определялись у 20 (40,0%) беременных, анти-HBc IgM были выявлены только у 10 (20%), все беременные с ХГВ имели анти-HBc IgG.
Определение вирусной нагрузки ДНК HBV рекомендуется проводить у инфицированных беременных в конце II триместра (в 26–28 нед) с целью выявления показаний к противовирусной терапии [9]. Известно, что вирусная нагрузка более 105–106 копий/мл у матери может привести к вертикальной передаче [6, 9, 10].
Нами была проведена оценка вирусной нагрузки у женщин с ХГВ в 28 и 36 нед беременности (табл. 1). Исходный уровень вирусной нагрузки в 28 нед беременности у женщин варьировал в пределах от менее 50 до 107 копий/мл. Уровень вирусной нагрузки в 36 нед беременности составлял от 103 до 2,4 х 107 копий/мл и был выше, чем в 28 нед (p = 0,026).
Высокую (105 и более копий/мл) вирусную нагрузку имели 15 (30,0%) женщин с ХГВ в 28 нед беременности и 26 (52,0%) беременных к моменту родов (χ2 = 19,780; p < 0,001).
При проведении корреляционного анализа не выявлено взаимосвязи между наличием анти-HBc-IgM и уровнем вирусной нагрузки в 28 и 36 нед беременности у пациенток с ХГВ (p > 0,05). Однако определялась статистически значимая умеренная положительная корреляция между уровнем вирусной нагрузки в 28 и 36 нед беременности (r = 0,619; p = 0,012).
Для изучения клеточного звена иммунитета у беременных с ХГВ в III триместре определяли субпопуляции Т-лимфоцитов: CD3+-лимфоциты, отражающие общий уровень Т-лимфоцитов периферической крови; Т-хелперы (CD3+CD4+); цитотоксические Т-лимфоциты (CD3+CD8+); соотношение CD3+CD4+/CD3+CD8+ (иммунорегуляторный индекс); активированные Т-лимфоциты, экспрессирующие HLA-DR-антиген (CD3+HLA-DR+), а также естественные киллеры (CD3–CD16+56+); NKT-клетки, являющиеся Т-клетками с функциями естественных киллеров; В-лимфоциты (CD19+) (табл. 2).
При анализе показателей клеточного звена иммунитета не было выявлено статистически достоверных различий по процентному и абсолютному содержанию популяций CD3+-лимфоцитов, CD3+CD8+-лимфоцитов (Т-супрессоров), В-лимфоцитов (CD19+), NKT-клеток у беременных с ХГВ по сравнению с группой контроля (p > 0,05).
Статистически значимые различия определяли по процентному содержанию CD4+-лимфоцитов (Т-хелперов), их средний уровень был ниже у женщин с ХГВ по сравнению с контрольной группой (р = 0,046). Содержание средних показателей относительного количества популяции CD3+CD8+, оказывающих цитотоксическое и супрессорное действие, имело тенденцию к повышению (р = 0,130) по сравнению с контрольной группой. Статистически значимых различий в абсолютных значениях Т-хелперов и Т-супрессоров в сравниваемых группах зарегистрировано не было. Тем не менее показатель иммунорегуляторного индекса CD3+CD4+/CD3+CD8+ у беременных с ХГВ был достоверно ниже (р = 0,015). При этом определялась умеренная прямая корреляционная связь иммунорегуляторного индекса с относительным содержанием CD3+CD4+-лимфоцитов (r = 0,665; p < 0,001). В то же время были зарегистрированы статистически значимые сильные отрицательные корреляционные связи иммунорегуляторного индекса с относительным (r = -0,874; p < 0,001) и абсолютным содержанием CD3+CD8+-клеток (r = -0,712; p < 0,001). Это свидетельствует о значительном влиянии количества CD3+CD8+-клеток на уровень иммунорегуляторного индекса у пациенток с ХГВ в III триместре беременности.
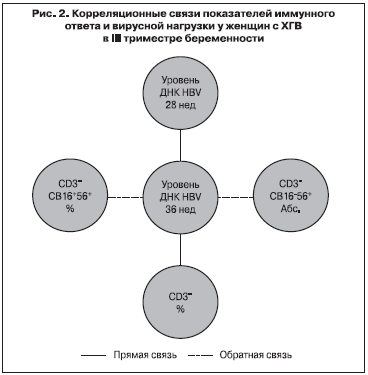
В нашем исследовании были выявлены устойчивые статистически значимые умеренные положительные связи между вирусной нагрузкой и относительным содержанием CD3+-лимфоцитов в 28 (r = 0,645; p = 0,007) и в 36 нед беременности (r = 0,534; p = 0,027) (рис. 2). Физиологические изменения во время беременности обычно приводят к сдвигу Th1–Th2 баланса в сторону Th2–ответа, увеличению количества регуляторных Т-клеток, которые способствуют депрессии иммунного ответа против HBV [9].
Кроме того, нами отмечена статистически значимая умеренная положительная корреляция между вирусной нагрузкой в 28 нед беременности и абсолютным содержанием CD3+CD4+-лимфоцитов (r = 0,610; p = 0,009), в 36 нед эта связь отсутствовала. Предполагается, что элиминация HBV является Т-клеточно-зависимым процессом. При остром течении HBV-инфекции, сопровождающейся элиминацией вируса, Т-клеточный ответ является энергичным, поликлональным и мультиспецифическим, в то время как хроническая HBV-инфекция характеризуется слабым адаптивным иммунным ответом, предположительно первоначально связанным с неэффективной мобилизацией CD4+-клеток в начале заболевания и последующим развитием количественно и качественно неэффективного CD8+ Т-клеточного ответа [8].
У беременных с ХГВ выявлены статистически значимые различия, связанные с более высокими средними показателями относительного количества CD3+HLA-DR+, по сравнению с группой контроля (p = 0,007). Зарегистрирована статистически значимая сильная отрицательная корреляционная взаимосвязь между относительным содержанием CD3+HLA-DR+- и CD3+CD4+-лимфоцитов (r = -0,731; p = 0,005). Молекулы HLA-DR являются маркером активации лимфоцитов. Повышение экспрессии HLA-DR на Т-лимфоцитах происходит при воспалительных процессах под воздействием цитокинов. Повышение экспрессии этих молекул на Т-лимфоцитах возможно при любых заболеваниях, связанных с воспалением [11]. В недавнем исследовании G. Tan и соавт. иммунофенотипического профиля лимфоцитов у больных ХГВ была выявлена отрицательная корреляция между CD4+HLA-DR+ и сывороточной ДНК HBV [12]. В нашем исследовании связь между CD3+HLA-DR+-лимфоцитами и уровнем вирусной нагрузки не была статистически значимой (r = -0,171; p = 0,590).
Статистически значимые различия были выявлены при определении содержания CD3-CD16+56+ (NK-клетки): у женщин с ХГВ их процентное содержание было выше, чем в группе контроля (р = 0,042). Природные киллеры (NK-клетки) – эффекторные лимфоциты иммунной системы – представляют собой особую популяцию больших гранулярных лимфоцитов, способных лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными агентами, и опухолевые клетки, таким образом ограничивая их распространение и последующее повреждение тканей.
Литическая активность NK-клеток, в отличие от Т-клеток, проявляется при первичном контакте без предварительной сенсибилизации [11]. Недавние исследования свидетельствуют о том, что NK-клетки являются также регуляторными клетками, функция которых – взаимодействие с дендритными клетками, макрофагами, Т-клетками и эндотелиальными клетками. NK-клетки могут таким образом ограничить или усилить иммунный ответ [13].
При проведении корреляционного анализа нами выявлена у беременных с ХГВ статистически значимая умеренная отрицательная связь между относительным содержанием CD3-CD16+56+-клеток и общим уровнем Т-лимфоцитов периферической крови (CD3+) (r = -0,584; p = 0,003). Абсолютное содержание CD3-CD16+56+-лимфоцитов имело статистически значимые умеренные положительные корреляционные связи с абсолютным содержанием CD3+- (r = 0,444; p = 0,030), CD3+CD8+- (r = 0,407; p = 0,049) и CD19+-лимфоцитов (r = 0,470; p = 0,020). Кроме того, были выявлены статистически значимые умеренные отрицательные корреляционные взаимосвязи между процентным содержанием CD3-CD16+56+-клеток и уровнем ДНК HBV в 28 (r = - 0,518; p = 0,040) и 36 (r = - 0,534; p = 0,027) нед беременности (см. рис. 2). Необходимо отметить, что подобная взаимосвязь между циркулирующими CD3-CD16+56+-лимфоцитами и уровнем ДНК HBV в сыворотке крови отмечена и у пациентов с ХГВ в исследовании G. Tan и соавт. [12]. Считается, что в основном адаптивный иммунный ответ является ответственным за элиминацию вируса и патогенез заболевания при HBV-инфекции [8]. Тем не менее установлена способность врожденного иммунного ответа распознавать HBV на ранних стадиях инфицирования, при этом в ответ на HBV-инфекцию происходит быстрая кинетика NK- и NKT-клеток, которые препятствуют распространению HBV и обеспечивают своевременную индукцию адаптивного иммунного ответа [14].
В настоящее время известно, что если клеточный иммунный ответ устраняет инфицированные клетки при HBV-инфекции, то гуморальный иммунный ответ участвует в элиминации циркулирующих частиц HBV и таким образом предотвращает распространение вируса в организме хозяина [8]. Исследование показателей гуморального иммунитета в сыворотке крови у беременных с ХГВ по сравнению с группой контроля показало тенденцию к повышению концентраций IgM и IgA (p > 0,05) и статистически значимое повышение уровня IgG (p = 0,004) (табл. 3 на стр. 26). Несмотря на отсутствие статистически значимых различий в концентрации IgA и IgM у беременных с ХГВ по сравнению с группой контроля, корреляционный анализ показал наличие у беременных с ХГВ статистически значимых умеренных прямых корреляционных связей уровня IgG с концентрацией IgM (r = 0,568; p < 0,001) и IgA (r = 0,476; p = 0,003). Эти данные указывают на активацию гуморального иммунитета у беременных с ХГВ.
Исследование содержания ЦИК в сыворотке крови показало статистически значимую разницу с повышением их концентрации у беременных с ХГВ по сравнению с группой контроля (p = 0,001). При этом у беременных с ХГВ были выявлены статистически значимые положительные корреляции уровня ЦИК с концентрацией IgA (r = 0,336; p = 0,045), наличием специфических анти-HBc IgM (r = 0,369; p = 0,041), активностью АЛТ (r = 0,432; p = 0,034) и АСТ (r = 0,557; p =0 ,025). По всей видимости, эти данные являются отражением развития воспалительных процессов у беременных при хронической HBV-инфекции.
Выводы
1. Хроническая HBV-инфекция у беременных, представленная преимущественно HBeAg-негативным гепатитом с редкими цитолитическими обострениями, сопровождается повышением вирусной нагрузки к моменту родов.
2. Клеточный иммунный ответ у женщин с ХГВ в III триместре беременности характеризуется снижением иммунорегуляторного индекса за счет снижения количества Т-хелперов и тенденции к повышению цитотоксических Т-лимфоцитов, повышением количества активированных Т-лимфоцитов и естественных киллеров.
3. Активность вирусной репликации у женщин с ХГВ в III триместре беременности связана с состоянием клеточного иммунитета, что подтверждается статистически значимыми стойкими положительными связями уровня вирусной нагрузки с относительным уровнем Т-лимфоцитов и отрицательными связями с относительным и абсолютным содержанием естественных киллеров.
4. Гуморальный иммунный ответ у беременных с ХГВ сопровождается редким обнаружением специфических анти-HBc IgM, активацией неспецифического гуморального иммунного ответа за счет повышения уровня IgG, их положительной корреляционной связью с уровнем IgМ и IgА.
5. Повышение уровня ЦИК у женщин с ХГВ в III триместре беременности, по всей видимости, является отражением воспалительного процесса в организме и имеет положительную корреляционную связь с синдромом цитолиза, концентрацией IgA и выявлением специфических анти-HBc IgM.


