Геморрагическая лихорадка с почечным синдромом (ГЛПС) является ведущей природно-очаговой инфекцией в Российской Федерации и занимает первое место в краевой патологии в Республике Башкортостан. Широкое распространение, высокие показатели заболеваемости, сопровождающейся длительным периодом временной нетрудоспособности, отсутствие эффективных и доступных специфических средств лечения и профилактики обусловливают высокую социальную и медицинскую значимость ГЛПС для Республики Башкортостан. Среди нарушений метаболизма, возникающих при ГЛПС, значительное место занимают нарушения баланса витаминов, макро- и микроэлементов [1–3]. По данным литературы, при ГЛПС значительно нарушается уровень кальция в крови. Однако объяснить гипокальциемию в олигурический период ГЛПС повышенным выделением кальция с мочой невозможно, так как в этот период отмечается также и гипокальциурия [4]. Исследований уровня витамина D как одного из регуляторов фосфорно-кальциевого обмена при ГЛПС ранее не проводилось. В то же время именно в почках образуется активный метаболит витамина D – кальцитриол (КТ), который не только регулирует уровень кальция в крови, но и обладает иммунотропным действием, а при ГЛПС одним из основных звеньев патогенеза является нарушение иммунологического статуса.
Целью настоящей работы явилось изучение уровней 25(ОН) витамина D (кальцидиола – КД) и 1,25(ОН)2 витамина D (КТ) в зависимости от формы и периода заболевания и выяснение роли нарушений витаминного статуса КД и КТ в патогенезе ГЛПС.
Материалы и методы
Исследование проводили на базе МУ «Городская клиническая больница № 13» и МУ «Инфекционная клиническая больница № 4» г. Уфы. Под наблюдением находились 114 больных с серологически подтвержденным диагнозом ГЛПС. Среди них было 94 (82,4%) мужчины и 20 (17,5%) женщин. При определении степени тяжести заболевания использовали классификацию Б.З. Сиротина [5]. Среднетяжелая форма заболевания была у 53 больных, тяжёлая – у 61. В контрольную группу были включены 44 практически здоровых лица соответствующего возраста (в основном врачи, преподаватели школ и вузов). Возраст обследованных составил 18–55 лет (средний возраст 37,4 ± 2,6 года). Из исследования были исключены лица, которые до заболевания ГЛПС имели болезни почек, печени, сердечно-сосудистой и нервной систем, а также эндокринологические заболевания.
Кровь для исследования в объеме 9 мл брали из локтевой вены, утром натощак. Определение уровней КД и КТ в сыворотке крови проводили методом высокоэффективной жидкостной хроматографии в лаборатории «Гемотест» (Уфа) и в испытательной лаборатории АНО «Центр биотической медицины» (Москва).
Определение уровня цитокинов [фактора некроза опухоли альфа (TNF-α), интерферона-γ (INF-γ), интерлейкинов-2, -4, -10 (IL-2, IL-4, IL-10)] проводили в Центральной научно-исследовательской лаборатории ГБОУ ВПО «Башкирский государственный медицинский университет» Минздрава России. Для определения концентрации цитокинов использовали наборы реагентов ЗАО «Вектор-Бест» (Новосибирск). Уровни цитокинов определяли иммуноферментным методом, в соответствии с инструкцией производителя. Метод определения основан на «сэндвич»-варианте твердофазного иммуноферментного анализа с применением моно- и поликлональных антител.
Математическую обработку результатов исследования проводили с использованием стандартного статистического пакета программ Statistica 7.0 for Windows. Среднее значение (М) и ошибку среднего значения (m) вычисляли в Microsoft Excel.
Результаты и обсуждение
Исследование уровней витаминов в сыворотке крови проводили в зависимости от степени тяжести болезни, периода заболевания и выраженности основных клинических синдромов. Полученные результаты представлены в табл. 1.
Hаши исследования показали, что в олигурический период концентрация КТ в сыворотке крови значительно снижается, а у больных с тяжелой формы ГЛПС отмечается выраженный дефицит КТ. Кроме того, в данный период уровень КТ у них достоверно ниже, чем при заболевании средней тяжести. Содержание КД в сыворотке крови больных ГЛПС ниже нормальных показателей выявлено только в олигурический период при тяжелой форме заболевания, соответственно оно достоверно ниже, чем при среднетяжелом течении. В период ранней реконвалесценции уровень КД находится в пределах нормы, а уровень КТ только имеет тенденцию к нормализации.

Витамин D пищи всасывается в составе мицелл, в крови он транспортируется в связи со специфическим транспортным глобулином, в гепатоцитах гидроксилируется в 25-гидроксихолекальциферол (КД). Это главная резервная в печени и транспортная в крови форма витамина D. Часть КД участвует в энтеро-печеночной циркуляции (как желчные кислоты). При ее нарушении может возникать дефицит витамина D. В почках, плаценте и костях КД гидроксилируется в положении 1 с образованием 1,25-дигидроксихолекальциферола (КТ). Его продукция регулируется собственной концентрацией, паратгормоном и сывороточными фосфатами.
КТ – единственный регулятор перемещения кальция через мембрану энтероцитов против градиента концентрации. Он стимулирует биосинтез в энтероцитах кальций-связывающего белка, что обеспечивает всасывание кальция и фосфатов в тонком кишечнике. КТ усиливает реабсорбцию кальция и фосфатов в почечных канальцах, что способствует поддержанию нормального их соотношения в плазме и внеклеточных жидкостях. Таким образом, выявленное нами снижение уровня КТ соответственно тяжести ГЛПС является одним из патогенетических механизмов развития гипокальциемии в олигурическом периоде ГЛПС.
В последние годы выявлено активное участие витамина D в регуляции иммуногенеза и клеточной пролиферации. Моноциты и лимфоциты экспрессируют рецепторный белок к КТ с такой же аминокислотной последовательностью, как и у кишечного рецепторного белка к КТ. КТ напрямую влияет на СD4+-лимфоциты, усиливая пролиферацию Тh2-клеток [6].
Исследование уровней цитокинов в сыворотке крови проводили в зависимости от степени тяжести, периода заболевания и выраженности основных клинических синдромов. Полученные результаты представлены в табл. 2.
Анализ уровня TNF-α в лихорадочный период ГЛПС выявил его повышение при среднетяжелой форме в 13,1 раза, при тяжелой – в 18,6 раз по сравнению с показателями контрольной группы. В олигурическом периоде отмечено нарастание уровня TNF-α как при среднетяжёлой, так и при тяжелой форме заболевания. В периоде полиурии содержание TNF-α уменьшалось, оставаясь значительно выше, чем в контрольной группе, как при среднетяжелой, так и при тяжелой форме.
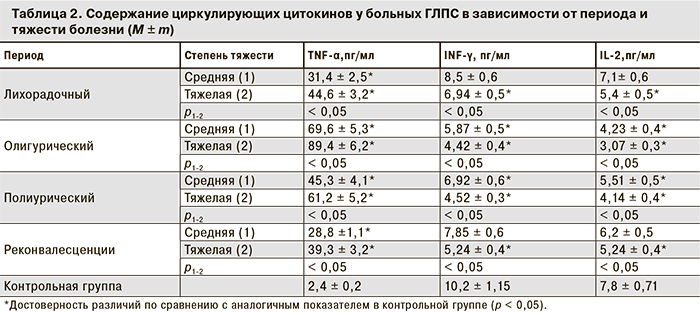
Анализ содержания INF-γ выявил совершенно другую динамику. В лихорадочном периоде при тяжелой форме ГЛПС уровень IFN-γ составил 6,94 ± 0,5 пг/мл, что ниже показателей контрольной группы (р < 0,01). В олигурическом периоде происходило его дальнейшее снижение как при среднетяжёлой, так и при тяжелой форме ГЛПС. В периоде полиурии продукция IFN-γ несколько повышалась при среднетяжёлой форме и практически не изменялась при тяжёлой форме заболевания. У реконвалесцентов с тяжёлой формой ГЛПС через месяц после выписки из стационара уровень IFN-γ был ниже, чем в контрольной группе (р < 0,05). Это указывает на сниженную активность Т-хелперов и NK-клеток, продуцирующих данный цитокин. В то же время низкие концентрации IFN-γ могут объясняться как его преимущественным содержанием в тканях, так и быстрым разрушением. Наиболее низкие уровни IFN-γ были выявлены при острой почечной недостаточности.
Уровень IL-2, важного медиатора иммунитета, особенно клеточного, в лихорадочном периоде при среднетяжёлой форме ГЛПС практически не отличался от показателя контрольной группы, а при тяжёлой форме снижался (р < 0,05). В олигурическом периоде выявлено снижение уровня IL-2 (р < 0,05). В полиурическом периоде концентрация IL-2 у больных ГЛПС оставалась ниже, чем в контрольной группе, несмотря на повышение его уровня как при среднетяжелой (5,51 ± 0,5 пг/ мл; р < 0,05), так и при тяжелой форме (4,14 ± 0,4 пг/мл; р < 0,05). К периоду реконвалесценции уровень IL-2 незначительно отличался от показателей контрольной группы при среднетяжелой форме ГЛПС, но у больных с тяжелой формой был снижен (р < 0,05). Основным биологическим эффектом IL-2 является стимуляция пролиферации Т- и NK-клеток. Следовательно, низкий уровень IL-2 является одним из факторов снижения количества СD3+- и СD16+-лимфоцитов в период разгара ГЛПС, что было выявлено ранее.
Наши исследования показали наличие достоверной прямой корреляционной связи между КТ и IL-2 (r = +0,61; p < 0,05), а также между КТ и INF-γ (r = +0,51; p < 0,05). Кроме того, выявлена достоверная обратная корреляционная связь между концентрацией КТ и уровнем TNF-α (r = -0,53; p < 0,05).
На активированных Т- и В-лимфоцитах, макрофагах и моноцитах экспрессируются специальные рецепторы к КТ, обеспечивающие дифференцировку моноцитов и прелимфоцитов до зрелых форм, способных продуцировать достаточное количество интерлейкинов, факторов роста и других Са-зависимых медиаторов иммуногенеза. Возможно, этим можно объяснить выявленную нами прямую достоверную прямую корреляционную связь между КТ и INF-γ, а также между КТ и IL-2.
Таким образом, при среднетяжелой и тяжелой формах ГЛПС в олигурическом периоде отмечается наименьшая концентрация КТ и КД в сыворотке крови, причем чем тяжелее заболевание, тем выраженнее дефицит активных метаболитов витамина D. Возможно, это является одним из механизмов, способствующих появлению гипокальциемии на фоне гипокальциурии в разгар ГЛПС.
Наличие корреляционных связей КТ с TNF-α, INF-γ и IL-2, указывает на возможную роль дефицита активного метаболита витамина D в развитии иммунологических нарушений при ГЛПС.


