Течение хронического гепатита С (ХГС) существенно различается в зависимости от генотипа вируса, возраста, пола, веса тела, ко-инфекции и других факторов. Важное значение имеют генетические особенности организма человека, о чем свидетельствуют межпопуляционные (межрасовые) различия в частоте хронизации и формирования цирроза печени и гепатоцеллюлярной карциномы, а также в ответе на противовирусную терапию (ПВТ) [1–4]. В настоящее время доказанным фактом является относительно низкая частота вирусологического ответа у лиц, принадлежащих к афроамериканской этнической группе [5–8]. О важной роли генетических факторов хозяина могут свидетельствовать данные о более тяжелом течении ХГС и высокой частоте развития гепатоцеллюлярной карциномы в некоторых регионах и этнических группах в Японии, Италии, Испании [9]. Исследования, до сих пор проводимые на территории Казахстана, были направлены в первую очередь на изучение эпидемиологических и диагностических аспектов ХГС в республике [10–15]. Этнические особенности течения заболевания у пациентов казахской национальности остаются не изученными.
Целью настоящего исследования явилось выявление особенностей генотипического профиля и вирусологического ответа на стандартную ПВТ у больных ХГС, принадлежащих к коренному и некоренному населению Республики Казахстан.
Материалы и методы
Работа основана на результатах клинического и лабораторно-инструментального обследования 221 больного ХГС из разных регионов Казахстана, находившегося на лечении в РГП «Национальный научный медицинский центр» Министерства здравоохранения Республики Казахстан в период с 2005 по 2012 г.
В соответствии с целью и задачами исследования, больные были разделены на 2 группы: 1-ю группу составили лица казахской национальности (n = 143; 64,7%), из них 85 мужчин и 58 женщин; 2-ю группу сформировали пациенты некоренной (славянской) национальности (n = 78; 35,3%), из них 41 мужчина и 37 женщин. Возраст больных варьировал от 18 до 60 лет.
В основу формирования групп по национальности были положены рекомендации А.В. Шабалдина и соавт [16]. В 1-ю группу вошли этнически чистые, не связанные родством казахи, в родословных которых на протяжении трех поколений не было смешанных браков. В состав 2-й группы вошли пациенты-славяне, у которых также в родословных на протяжении трех поколений не было смешанных браков. Формирование групп происходило по мере обращения пациентов в гепатологический центр, функционирующий на базе РГП «Национальный научный медицинский центр» Республики Казахстан.
Для подтверждения диагноза использовали общепринятые методы клинико-лабораторного обследования, включающие биохимическое исследование сыворотки крови, серологические маркеры вируса гепатита С (HCV), а также метод полимеразной цепной реакции с качественным и количественным определением РНК HCV.
Для лечения ХГС использовались официально зарегистрированные стандартные схемы ПВТ: пегилированный интерферон-α-2а (пегасис – 180 мкг/нед) или пегилированный интерферон-α-2b (пегинтрон – 1,5 мкг/кг/нед); рибавирин при генотипе 1b назначали в дозе 1000 мг/день при весе больного до 75 кг и 1200 мг/день при весе более 75 кг; при генотипах 2 и 3 доза рибавирина у всех пациентов была 800 мг/день. Длительность терапии при генотипе 1b составила 48 нед, при генотипах 2 и 3 – 24 нед.
Статистическую обработку полученных данных проводили на персональном компьютере с использованием программы Exel операционной системы Windows XP версии 2007 фирмы Microsoft®. Результаты исследования обработаны методом вариационной статистики.
Исследование выполнено при финансовой поддержке Министерства образования и науки Российской Федерации (Государственный контракт № 11.519.11.2034 от 01 ноября 2011 г.)
Результаты и обсуждение
Распределение больных ХГС по генотипу вируса оказалось следующим: в 1-й группе было 75 человек (52,5%; m = 4,2%) с генотипом 1b, генотипы 2 и 3 были выявлены у 68 пациентов (47,5%; m = 4,2%); во 2-й группе генотип 1b выявлен у 43 (55,1%; m = 5,6%) пациентов, генотипы 2 и 3 – у 35 (44,9%; m = 5,6%) (рис. 1). Таким образом, отмечалось незначительное преобладание генотипа 1b HCV в обеих группах пациентов, хотя отличия не были статистически достоверными (р > 0,05).
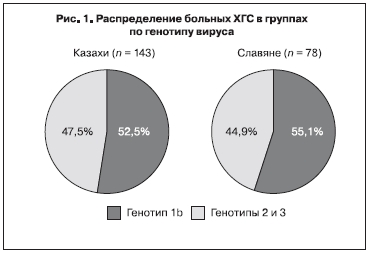
Как известно, частота обнаружения различных генотипов HCV зависит от географического региона и пути передачи вируса. В США доля генотипа 1 составляет примерно 70%, в то время как генотипы 2 и 3 обнаруживаются соответственно у 5 и 20% больных. Генотипы вируса 1a и 1b также являются наиболее распространенными в Европе. Генотип 4 часто выявляется в Египте, Саудовской Аравии и других странах Северной Африки и Ближнего Востока, генотип 5 имеет распространение в Южной Африке, генотип 6 относительно часто встречается в Азии. В России доминирует генотип 1b, составляя в регионах Северной Евразии 64,7%, на Дальнем Востоке – 80–83%. Генотип 1a чаще (11,2–21,9%) обнаруживается в Центральном, Северо-Западном, Волго-Вятском регионах; генотипы 2а, 2b и За выявляются реже – от 1 до 19% случаев в зависимости от региона [17, 18]. В настоящем исследовании у больных ХГС генотип 2 или 3 HCV выявляли у представителей как 1-й, так и 2-й группы почти в половине случаев. Данное обстоятельство демонстрирует существенное отличие генотипического распространения HCV на территории Республики Казахстан по сравнению с РФ, что связано, по-видимому, с эпидемиологическими особенностями распространения HCV на территории Казахстана. В обеих группах отличия в частоте обнаружения генотипов вируса не были статистически достоверными, что еще раз свидетельствует в пользу эпидемиологических, а не генетических факторов, влияющих на распространенность генотипов HCV на территории Казахстана.
Вирусную нагрузку исследовали у всех пациентов. При этом ПВТ в 1-й группе получали 36 больных, а во 2-й – 27 больных. Распределение их по полу и генотипу вируса представлено на рис. 2.

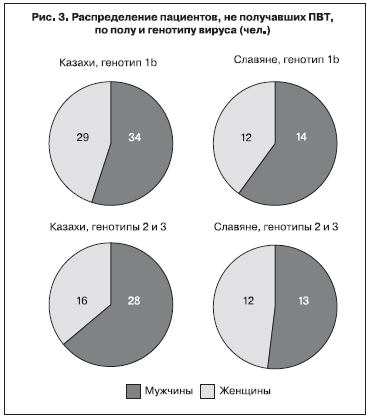
Не получали ПВТ в 1-й группе 107 больных, во 2-й – 51 больной (рис. 3).
Кинетика вирусной нагрузки при ХГС генотипа 1b изучена у 39 больных 1-й группы и у 31 больного 2-й группы, при этом ПВТ проводилась 20 больным 1-й группы и 14 больным 2-й группы. Для сравнения оценивали показатели 19 пациентов 1-й группы и 17 пациентов 2-й группы, которым не проводилась ПВТ (табл. 1).
* Достоверность различий в сравнении с исходными данными (р < 0,001);
** Достоверность различий между группами (р < 0,001).
В группах с ПВТ при ХГС генотипа 1b уже к 4-й неделе наблюдения вирусная нагрузка достоверно снижалась. К 12-й и 24-й неделе ПВТ уровень вирусной нагрузки продолжал уменьшаться, а на 36-й и 48-й неделях у пациентов 1-й группы РНК HCV в сыворотке крови не обнаруживалась. Во 2-й группе к 36-й неделе ПВТ вирусная нагрузка снизилась до 1000 ± 500 копий/мл (р < 0,001) и к 48-й неделе так же не определялась. Таким образом, у всех больных на фоне ПВТ получен вирусологический ответ к окончанию лечения. При этом вирусная нагрузка на 4-й, 12-й, 24-й и 36-й неделе лечения в 1-й группе была достоверно ниже, чем во 2-й группе.
При анализе динамики вирусной нагрузки при ХГС генотипа 1b без ПВТ установлено, что в обеих группах ее снижение не фиксировалось. Более того, наблюдалось ее нарастание в процессе наблюдения.
Из 20 больных 1-й группы с ХГС генотипа 1b, получавших стандартную ПВТ с использованием пегилированных интерферонов и рибавирина, стойкий вирусологический ответ (СВО) получен у 17 пациентов, что составило 85,0% (m = 8,7%). Во 2-й группе СВО наблюдался у 10 из 14 больных, что составило 71,6% (m = 12,1%). Небольшое число наблюдении не позволило получить статистически достоверное отличие данных показателей (р > 0,05). У 7 пациентов наблюдался рецидив репликации HCV в разные сроки после отмены противовирусных препаратов.
Кинетика вирусной нагрузки при ХГС генотипов 2 и 3 изучена у 32 больных 1-й группы и у 28 больных 2-й группы. ПВТ проводили 16 больным 1-й группы и 13 больным 2-й группы. Для сопоставления использовали результаты исследования вирусной нагрузки у 16 пациентов 1-й группы и у 15 пациентов 2-й группы без ПВТ (табл. 2).
* Достоверность различий в сравнении с исходными данными (р < 0,001);
** Достоверность различий между группами (р < 0,001).
В обеих группах на фоне проведения ПВТ уже к 4-й неделе наблюдения вирусная нагрузка снизилась. При этом показатели в 1-й группе на 4-й и 12-й неделях были достоверно ниже, чем во 2-й группе. К моменту окончания лечения (24-я неделя) в обеих группах наблюдалось достоверное снижение вирусной нагрузки до неопределяемого уровня.
Из 16 пациентов 1-й группы с генотипами 2 и 3, получивших терапию с использованием пегилированных интерферонов и рибавирина, СВО получен у 14 больных, что составило 87,5% (m = 10,1%). Во 2-й группе СВО наблюдался у 10 из 13 больных (76,9%, m = 11,7%). Как и в случае ХГС генотипа 1b, недостаточное число наблюдений не позволило нам говорить о статистически достоверном отличии данных показателей (р > 0,05). Рецидив репликации после окончания ПВТ был зафиксирован у 5 пациентов.
Среди пациентов без ПВТ в обеих группах в процессе исследования наблюдалось достоверное повышение вирусной нагрузки.
Таким образом, существенная разница в динамике вирусной нагрузки в группах на фоне ПВТ, по нашему мнению, определенно связана с этнической принадлежностью пациентов. Анализ кинетики вирусной нагрузки продемонстрировал, что при ХГС на фоне проведения ПВТ наблюдалось более быстрое (к 4-й неделе) ее снижение в 1-й группе (казахи) при генотипе 1b, тогда как во 2-й группе (славяне) достоверное снижение достигалось лишь к 12-й неделе ПВТ. Более значительным снижение в 1-й группе было и в последующие недели наблюдения. При генотипах 2 и 3 в обеих группах вирусная нагрузка достоверно снижалась на 4-й неделе ПВТ, но в 1-й группе на 4-й и 12-й неделях лечения снижение было более существенным. Данные факты позволяют нам утверждать, что принадлежность к казахской национальности может рассматриваться как положительный прогностический фактор эффективности ПВТ при ХГС генотипов 1b и не 1 (2 и 3 генотипы). Отмечалась бoльшая частота развития СВО при HCV с генотипами 1b и не 1 в 1-й группе по сравнению со 2-й, но отличия не оказались статически достоверными.
Полученные нами результаты еще раз подтверждают влияние генетических факторов на эффективность ПВТ при ХГС. В свое время по результатам целого ряда исследований было доказано влияние на течение ХГС локусов HLA, определяющих иммунный ответ хозяина [19, 20]. В настоящее время является доказанным наличие генетически детерминированного прогностического фактора эффективности ПВТ в виде однонуклеотидного полиморфизма гена человека, кодирующего интерферон лямбда [21–23]. Полиморфизм rs12979860 и rs8099917 гена ИЛ-28В оказывает существенное влияние на частоту достижения СВО. Так, у пациентов белой расы – носителей генотипа С (гомозиготы по аллели С) регистрируется 2-кратная разница в частоте достижения СВО по сравнению с носителями генотипов СТ и ТТ полиморфизма rs12979860 гена ИЛ-28В [22]. Минорная аллель g полиморфизма rs8099917 гена ИЛ-28В ассоциируется с переходом острого гепатита С в ХГС и неэффективностью ПВТ у пациентов с генотипами 1 и 4 HCV [21, 23]. Принадлежность к той или иной этнической группе населения может определять и набор генетически детерминированных факторов, подобных гену ИЛ-28В, поиск которых активно происходит во всем мире. Основной целью таких исследований является разработка оптимальных схем терапии хронических вирусных гепатитов в зависимости от генетического статуса пациента.
Выводы
1. У больных ХГС на территории Республики Казахстан практически с одинаковой частотой обнаруживаются генотипы 1b и не 1 (2 и 3) HCV как среди лиц казахской национальности, так и среди некоренной популяции.
2. Выявлено более быстрое снижение вирусной нагрузки на фоне проведения стандартной ПВТ у больных ХГС с генотипами 1b и не 1 (2 и 3) HCV у лиц коренной популяции, что позволяет рассматривать принадлежность к казахской национальности в качестве положительного прогностического фактора эффективности ПВТ при ХГС.


