Стафилококковая инфекция объединяет большую группу заболеваний, вызываемых стафилококком, и занимает ведущее место в инфекционной патологии у детей грудного возраста [1, 2]. Род Staphylococcus включает более 35 видов, 16 из которых могут вызывать заболевание у человека. Чаще всего инфекция у детей бывает обусловлена тремя видами стафилококка: золотистым (S. аureus), эпидермальным (S. еpidermidis), сапрофитическим (S. saprophyticus). Вид золотистого стафилококка включает 6 биоваров (А, В, С и др.). Патогенным для человека и основным возбудителем заболевания является биовар А, остальные биовары патогенны для животных и птиц [3, 4]. Стафилококковые энтериты и энтероколиты патогенетически подразделяются на 2 вида: первичный, возникающий при попадании возбудителя через рот, с развитием воспалительного процесса в тонком и толстом кишечнике; вторичный – при гематогенном попадании возбудителя в кишечник, в результате генерализации стафилококковой инфекции, с развитием в толстой кишке язвенно-некротического или катарально-десквамативного процесса и вторичный – как следствие дисбактериоза кишечника и активации размножения стафилококка, находящегося в кишечнике в норме и приобретающего новые свойства: большую токсигенность и патогенность, резистентность к антибиотикам [5]. Первичный СЭ у детей грудного возраста может протекать с наличием в стуле слизи, крови, что определяет его схожесть с дизентерией, а при наличии энтерита и длительного субфебрилитета – с сальмонеллезом. Выделение патогенного стафилококка при острых кишечных инфекциях (ОКИ) требует тщательного анализа эпидемиологических и анамнестических данных в сопоставлении с клинической симптоматикой для принятия окончательного решения о его этиологической роли в развитии заболевания. С практической точки зрения диагностика СЭ должна быть ранней, так как от этого зависят эффективность проводимого лечения и развитие возможных последствий болезни (генерализация процесса, вторичная лактазная недостаточность, дисбактериоз кишечника и др.) [6].
Цель исследования – выявление клинико-эпидемиологических особенностей СЭ у детей грудного возраста.
Материалы и методы
Источниками информации являлись данные 198 историй болезни детей в возрасте от 1 до 12 мес. с подтвержденным диагнозом СЭ, проходивших лечение в ГБУЗ АО «Областная инфекционная клиническая больница имени А.М. Ничоги» (Астрахань) с января 2017 по декабрь 2021 г. Этиология заболевания была подтверждена обнаружением S. aureus в концентрации 106 и более в 1 г кала при отрицательных результатах бактериологического и серологического обследования на патогенную группу возбудителей ОКИ, результатах стандартного ПЦР-скрининга фекалий на дизентерию, сальмонеллез, вирусные ОКИ.
Анализировали эпидемиологические данные, продолжительность основных симптомов СЭ (лихорадки, диареи, токсикоза с эксикозом), частоту дисбактериоза кишечника, вторичной лактазной недостаточности. Наличие дисбактериоза кишечника определяли по имевшимся в медицинской документации результатам исследования кала на микробный пейзаж (снижение количества бифидо- и/или лактобактерий < 106 КОЕ/г фекалий, повышение количества условно-патогенных бактерий до 105 КОЕ/г), лактазной недостаточности — по содержанию углеводов в кале (по данным пробы Бенедикта) при уровне углеводов > 0,5 мг% и/или pH кала 5,5 и выше. Наличие углеводов в кале до 0,25 мг% у детей первого года жизни считается нормальным. При лактазной недостаточности рН кала снижается, а содержание углеводов увеличивается.
Степень дегидратации оценивали с использованием клинической шкалы дегидратации CDS (Clinical Dehydration Scale): 0 баллов – дегидратация отсутствует, от 1 до 4 баллов – легкая дегидратация, 5–8 баллов – дегидратация средней и тяжелой степени.
У всех пациентов в медицинской документации имелось подписанное родителями или законным представителем ребенка информированное согласие на обработку данных и их использование в научных целях.
Анализ данных проводили с использованием пакета статистических программ STATISTICA v. 6.0 (Stat.SoftInc., США). Количественные показатели указывали как среднее арифметическое значения ± стандартное отклонение (М ± m). Сравнение количественных показателей в 3 группах (легкая, среднетяжелая и тяжелая форма CЭ) выполнено с применением дисперсионного анализа ANOVA, качественных показателей – с помощью критерия χ2. Различия считали статистически значимыми при p < 0,05.
Заключения Этического комитета на проведение исследования не запрашивали.
Результаты
Среди больных СЭ детей первых 6 мес. жизни было 134 (68%), в возрасте от 7 до 12 мес. – 64 (32%) (табл. 1).
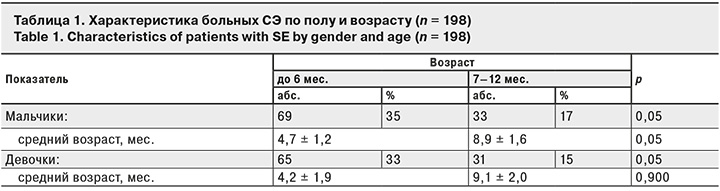
114 (57%) детей имели отягощенный преморбидный фон (недоношенность, омфалит, последствия поражения центральной нервной системы гипоксического или органического характера и др.). На грудном вскармливании находились 28 (14%) детей, на смешанном – 86 (43%), на искусственном – 84 (43%). В 1-е сутки заболевания госпитализированы 115 (58%) пациентов, во 2-е – 62 (31%), в 3-и– 21 (11%). Стафилококковые поражения ЖКТ у 155 (78%) детей были связаны с пищевым путем инфицирования (мастит у матери, употребление инфицированных молочных продуктов и др.). У 22% больных путь инфицирования не установлен. Преобладали среднетяжелые формы болезни – 123 (62%) случая, в тяжелой форме СЭ протекал у 33 (17%) пациентов, в легкой – у 42 (21%). Клиническая картина отличалась большим полиморфизмом: энтерит – у 14 (7%) пациентов, энтероколит – у 99 (50%), гастроэнтероколит – у 57 (29%), колит – у 10 (5%), гемоколит – у 18 (9%) (табл. 2).
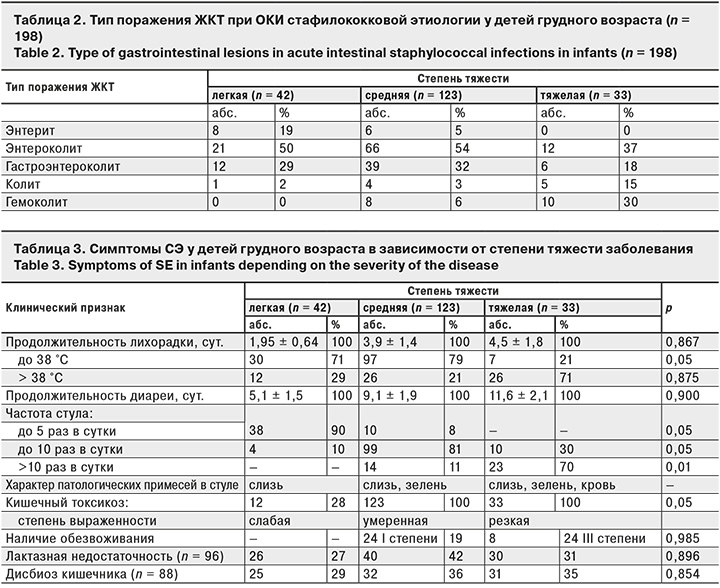
У 139 (70%) детей острое начало заболевания характеризовалось наличием лихорадки, учащением стула с наличием в нем патологических примесей (слизь и/или прожилки крови), развитием обезвоживания. Обезвоживание, имевшее место у 32 (16%) больных, лабораторно соответствовало изотоническому типу с компенсированным метаболическим ацидозом. Количество эритроцитов увеличивалось до 5,8 ± 0,2 х 1012/л (норма 3,8–5,5 х 1012/л), гематокрита – до 44 ± 1,2% (норма 29–41%), общего белка крови – до 78 ± 2,3 г/л (норма 47–72 г/л). Концентрация натрия в плазме крови составляла 129,9 ± 7,9 ммоль/л (норма 130–150 ммоль/л), осмолярность плазмы крови – 280,3 ± 9,9 мосм/л (норма 275–295 мосм/л), рН – 7,39 ± 0,03 (норма 7,35–7,45), дефицит оснований отсутствовал, парциальное давление СО2 33,9 ± 1,95 мм рт. ст. (норма 35–45 мм рт. ст.). Установлена прямая корреляционная связь поздней госпитализации больных с обезвоживанием (r = 0,72, p < 0,001). Состав микрофлоры кишечника был изменен у 88 (44%) больных и соответствовал критериям дисбактериоза I степени. Снижение количества бифидобактерий и лактобацилл до 105–108 отмечали у 48% детей, кишечной палочки – до 106 – у 23%, рост условно-патогенных бактерий (не более 2 видов) в разведениях 102–103 – у 29%. Наличие углеводов в кале в количестве 0,8 ± 0,15 мг установлено у 69 (72%), снижение рН кала до 3,4 ± 0,7 – у 85 (88%), что свидетельствовало о наличии вторичной лактазной недостаточности. Средняя продолжительность стационарного лечения составляла 9,8 ± 3,5 дня. Частота и выраженность перечисленных симптомов зависели от степени тяжести заболевания (табл. 3).
У 59 (30%) детей в возрасте до 3 мес. развитию полной картины кишечной инфекции предшествовал диспепсический синдром (жидкий стул) разной продолжительности. Установлено наличие во время беременности инфекционно-воспалительных заболеваний у 5 (8%) матерей этих пациентов, тяжелый токсикоз первой половины беременности – у 15 (25%), явления угрожающего выкидыша – у 3(5%), безводный период в родах в течение 24 ч – у 6 (10%), слабость родовой деятельности – у 12 (20%), инфицирование околоплодных вод – у 5 (8%), нормальное течение беременности и родов – у 13 (22%). Родоразрешение через естественные родовые пути проводилось у 48 (81%) рожениц, методом кесарева сечения (плановым) – у 11 (19%). В первые 3–4 дня после родов у 7 (12%) новорожденных развился гнойный конъюнктивит, а у 9 (15%) – катаральный омфалит. Нарушения стула у 15 (25%) новорожденных появились в возрасте 7–9 дней, у 23 (39%) – 12–16 дней, у 21 (36%) – 19–27 дней. Основными симптомами диарейного синдрома являлись жидкий стул от 1 до 3 раз в сутки, без видимых патологических примесей, при удовлетворительном самочувствии и прибавке массы тела. Состояние детей ухудшалось постепенно, в течение 12,5 ± 3,9 дня. Частота стула увеличивалась до 10 раз и более у 47 (80%). Энтероколитный характер стула отмечали у 52 (88%) детей, колитный – у 4 (7%), гемоколит – у 3 (5%). Температура тела повышалась до 37,5 ± 0,2 °С у 30 (51%) пациентов, до 38,9 ± 0,5 °С – у 29 (49%). Синдром дегидратации I степени диагностировали у 9 (15%) детей, I–II степени – у 3 (5%). Средняя продолжительность заболевания у 41% пациентов этой группы составляла 15,9 ± 4,3 дня, лихорадки – 5,3 ± 1,4 дня, диарейного синдрома – 12,8 ± 3,4 дня. У 49% температура тела на 3–4-й день от начала заболевания снижалась до 37,2 ± 0,1 °С с непостоянным субфебрилитетом в последующие дни и сохранением диарейного синдрома до 15,3 ± 4,8 дня, с повторным выделением S. aureus 106 КОЕ/г, устойчивого к антибиотикам.
В качестве иллюстрации приводим собственное наблюдение.
Пациент С. Возраст 30 дней. Ребенок от первой беременности, протекавшей с токсикозом первой половины и безводным периодом в течение 18 ч во время родов. Родоразрешение путем кесарева сечения. Масса плода при рождении 3450,0 г, рост 54 см. Оценка по шкале Апгар 7 баллов. Гнойный конъюнктивит левого глаза в возрасте 4 дней. Проводилось местное лечение (20% раствор сульфацила натрия, эритромициновая мазь). Выписан из роддома на 6-е сутки в удовлетворительном состоянии. Вскармливание грудное. В возрасте 14 дней появился жидкий стул желтого цвета, до 2–3 в раз в сутки, без видимых патологических примесей. Самочувствие ребенка оставалось удовлетворительным, снижение аппетита, повышение температуры тела отсутствовали; прибавлял в массе тела. Ухудшение состояния наступило в возрасте 30 дней. Ребенок стал вялым, увеличилась частота стула, что послужило основанием для госпитализации в инфекционный стационар.
Результаты осмотра при поступлении 26.09: состояние средней тяжести. Масса тела 4100,0 г. Температура тела 37,5 °С. Кожные покровы и видимые слизистые обычной окраски. Тургор тканей сохранен. Большой родничок 1,5 × 1,5 см на уровне костей черепа. Число дыханий 44 в 1 мин. Дыхание пуэрильное, проводится по всем полям, хрипов нет. ЧСС 142 в 1 мин. Тоны сердца умеренно приглушены, шумов нет. Сосет активно, но часто срыгивает. Живот умеренно вздут из-за газов, доступен глубокой пальпации. Симптомов раздражения брюшины нет. Перистальтика кишечника живая. Печень на 2 см ниже края реберной дуги. Селезенка не пальпируется. Стул жидкий, до 8 раз в сутки, с примесью зелени и слизи.
Общий анализ крови от 26.09: эритроциты 4,5 × 1012/л, Hb 150 г/л, тромбоциты 298 клеток/л, лейкоциты 7,5 × 109/л, палочкоядерные 3%, сегментоядерные 43%, лимфоциты 44%, моноциты 6%, эозинофилы 4%; СОЭ 10 мм/ч.
Биохимический анализ крови от 26.09: общий белок 70 г/л, глюкоза крови 4,2 ммоль/л, общий билирубин 20 мкмоль/л, креатинин 105 ммоль/л, АЛТ 22 Ед/л (норма до 27 Ед/л), АСТ 33 Ед/л (норма до 58 Ед/л), СРБ 4 мг/л (норма 0–1 мг/л).
Общий анализ мочи от 26.09: удельный вес – 1025 г/л, белок – абс., лейкоциты 2–3 в поле зрения. Копрограмма: слизь в умеренном количестве, лейкоциты 20–30, эритроциты 3–5 в поле зрения, нейтральный жир в большом количестве. Бактериологический посев кала от 26.09: рост S. aureus 106 КОЕ/г, устойчивого к антибиотикам. Посев молока матери на флору отрицательный.
Диагноз: «Стафилококковая инфекция, энтероколит средней тяжести».
Анамнестические данные матери ребенка по течению беременности и родов, наличие гнойного конъюнктивита у ребенка, продолжительность диареи при отсутствии лихорадки, патологических примесей в стуле, отрицательный результат посева молока матери на бактериальную флору, рост S. aureus 106 КОЕ/г в кале ребенка свидетельствуют о вторичном поражении кишечника (вторичный СЭ как результат дисбактериоза).
Обсуждение
Стафилококковая инфекция у детей грудного возраста до настоящего времени остается часто встречающейся инфекционной патологией, тесно связанной с инфицированностью матери и лиц, ухаживающих за ребенком. Предрасполагающими факторами для ее возникновения являются раннее искусственное или смешанное вскармливание, наличие сопутствующих заболеваний и др. [7–9], морфофизиологические особенности строения ЖКТ у детей грудного возраста (повышенная проницаемость, недостаточность секреторного аппарата, незавершенность функционального развития нервных путей [10, 11], нарушения синтеза гуморальных антител, цитокинсинтезирующих лимфоцитов [12].
По результатам исследований Г.А. Тимофеевой и соавт. [5], Р.Н. Манкевич и соавт. [6], И.В. Николаевой и соавт. [7], первичный энтерит и энтероколит стафилококковой этиологии могут начинаться остро или постепенно в зависимости от патогенности и инфицирующей дозы стафилококка с более частым развитием патологического процесса одновременно в тонком и толстом кишечнике. Без адекватной терапии болезнь прогрессирует, нарастает токсикоз, развивается обезвоживание. Заболевание принимает затяжное, рецидивирующее течение с длительным выделением стафилококка и возможным развития генерализованной стафилококковой инфекции. Первичный СЭ установлен в нашем исследовании у 139 (70%) пациентов. Заболевание характеризовалось острым началом, одновременным развитием воспалительного процесса в тонком и толстом кишечнике у 79% пациентов. Поражение толстого кишечника по типу колита и гемоколита установлено у 14% больных, энтерит – только у 7%. Заболевание у 62% протекало в среднетяжелой форме. Дегидратация I–II степени установлена у 14% детей.
Стафилококк в небольшом количестве постоянно присутствует в составе флоры кишечного тракта. Перевод ребенка на смешанное или искусственное вскармливание сопровождается качественными изменениями характера питания, приводящими к количественным изменениям в соотношении состава нормальной микрофлоры кишечника. Размножение стафилококка в нормальных условиях сдерживается антагонистическими свойствами кишечной палочки. При подавлении нормальной флоры он начинает интенсивно размножаться, что в конечном итоге может приводить к развитию вторичного стафилококкового энтерита и/или СЭ [13–15].
В нашем исследовании у 59 (30%) детей в возрасте до 3 мес. установлено наличие жидкого стула, появившегося в разные сроки периода новорожденности, причину которого более правильно расценивать как проявление дисбактериоза. Нарастание клинической симптоматики происходило постепенно, в течение 12,5 ± 3,9 дня, что отличалось от начала заболевания при первичном СЭ. Продолжительность заболевания у этих детей превышала аналогичный показатель при первичном энтероколите в 1,6 раза. По степени тяжести, топическому поражению кишечника, частоте развития дегидратации достоверных различий не выявлено. Учитывая анамнестические данные матери и ребенка, наличие продолжительного диарейного синдрома, предшествовавшего появлению патологических примесей в стуле (слизь, кровь), заболевание у этих детей относится ко второму виду – вторичному СЭ как следствию дисбактериоза кишечника, протекавшему у 66% детей в среднетяжелой форме. В исследованиях других авторов [5, 16, 17] вторичный энтерит и энтероколит представлены тяжелыми формами заболевания, которые сопровождались многократной рвотой, токсикозом с обезвоживанием, обильной водянистой диареей, судорогами и возможностью летального исхода.
Выводы:
1. Среди больных стафилококковым энтероколитом, участвовавших в исследовании, преобладали дети в возрасте до 6 мес. (68%) с неблагоприятным преморбидным фоном (57%), находившиеся на искусственном и смешанном вскармливании (86%).
2. Пищевой путь заражения установлен у 78% больных.
3. Первичный стафилококковый энтероколит установлен у 139 (70%) детей, вторичный, как следствие дисбактериоза, – у 59 (30%).
4. Преобладала среднетяжелая форма заболевания (62%). Стафилококковое поражение ЖКТ протекало по типу энтерита у 14 (7%) пациентов, энтероколита – у 99 (50%), гастроэнтероколита – у 57 (29%), колита – у 10 (5%), гемоколита – у 18 (9%).
5. Дисбактериоз кишечника установлен у 44% больных стафилококковым энтероколитом, вторичная лактазная недостаточность – у 48% .


