Первый случай заражения ВИЧ в СССР был обнаружен в 1985 г. у гражданина Африки [1]. До середины 90-х гг. XX в. в СССР, а затем в Российской Федерации регистрировали небольшое число случаев инфицирования, к 1995 г. лиц, живущих с ВИЧ (ЛЖВ), в стране насчитывалось менее 1000 чел. Однако начиная с 1996 г., вследствие попадания вируса в уязвимую группу лиц, употребляющих инъекционные наркотики, скорость его распространения значительно увеличилась. До 2016 г. ежегодно более 50% новых случаев инфекции были вызваны парентеральным путем передачи. Быстрое развитие эпидемии ВИЧ-инфекции в России стало одной из причин высокой пораженности населения в настоящее время. Согласно опубликованным данным [2], к 2021 г. число ЛЖВ в стране достигло 1 137 596 чел., что составляет 0,8% общей численности населения страны и 1,5% населения в возрасте от 15 до 49 лет.
Развитие эпидемии ВИЧ-инфекции в Республике Армения (РА) происходило несколько иначе. С конца 1990-х гг. эпидемия начала распространяться в основном в группе потребляющих инъекционные наркотики. С 2004 г. в РА благодаря осуществлению национальной программы по профилактике ВИЧ/СПИДа возрос доступ к тестированию, был внедрен систематический эпидемиологический надзор за ВИЧ, дан старт профилактическим программам. В следующее десятилетие развитие эпидемии под влиянием внутренних и внешних факторов изменилось, и сейчас она характеризуется тем, что основным путем передачи являлся гетеросексуальный (в 2009–2018 гг. – 76,5%). В этот период 56% зараженных ВИЧ были инфицированы за рубежом, среди зарегистрированных случаев значительное влияние имел фактор миграции (66%) [3]. В последнее время, кроме этих особенностей, наблюдается также распространение ВИЧ-инфекции среди мужчин, практикующих секс с мужчинами, составив 11% всех случаев годовой регистрации. С 1988 г. по 31 декабря 2022 г. в стране было зарегистрировано 5114 случаев заражения среди граждан РА. Основными путями передачи ВИЧ-инфекции являются гетеросексуальные контакты (75,0%), потребление инъекционных наркотиков (15,9%) и гомосексуальный путь передачи (6,4%) (https://ncid.am/statistics/).
Российская Федерация и РА связаны между собой чрезвычайно сильно. По данным Федеральной миграционной службы России, в РФ ежегодно регистрируются до 500 000 граждан Армении, являющихся трудовыми мигрантами. Согласно проведенным опросам, одновременно в РА находятся примерно 80 000–100 000 возвращающихся трудовых мигрантов [4]. Почти все они мужчины. В 2017 г. из 358 новых случаев ВИЧ-инфекции, выявленных в РА, 56% приходилось на долю вернувшихся трудовых мигрантов, 9% – на долю их партнеров. В исследовании, проведенном в 2016 г. с использованием методов многоэтапной кластерной выборки в 6 регионах Армении, было установлено, что распространенность ВИЧ среди возвращающихся сельских трудовых мигрантов составила 0,6% в возрастной группе 18–49 лет [5].
Хроническое течение болезни, неспецифические клинические признаки, поздняя диагностика осложняют определение региона инфицирования. В то же время в решении этой задачи могут быть с успехом применены молекулярные и биоинформатические методы [6, 7]. В случае секвенирования достаточного количества ВИЧ-инфицированных лиц на изучаемых территориях можно не только определить географическое направление распространения вируса, но и оценить степень связанности эпидемий [8].
До настоящего времени секвенирование ВИЧ граждан РА осуществлялось в крайне ограниченном количестве, что делало невозможным проведение анализа связанности эпидемий с помощью биоинформатических методов. В связи с этим целью нашей работы были анализ генетического разнообразия вариантов ВИЧ, циркулирующих на территории РА; поиск стран, в которых проживают ВИЧ-инфицированные, эпидемиологически связанные с армянскими гражданами, и оценка степени связанности эпидемий ВИЧ-инфекции между РА и Российской Федерацией.
Материалы и методы
В работе были использованы нуклеотидные последовательности региона pol, кодирующие гены протеазы и обратной транскриптазы (позиции 2253–3369 согласно референсному геному HXB-2, K03455) и сопутствующие данные о 1009 пациентах (пол, возраст, год постановки диагноза, предполагаемый путь инфицирования, опыт терапии, регион проживания, дата забора крови на исследование), являющихся гражданами РА, и 3579 пациентах – гражданах РФ. Данные о ВИЧ-инфицированных РА были получены в ходе ранее проведенных исследований, о ВИЧ-инфицированных РФ – из коллекции ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора (далее – ЦНИИЭ). Дополнительно из базы данных Лос-Аламос (https://www.hiv.lanl.gov/content/index) с помощью инструмента HIV BLAST были выгружены наиболее генетические близкие сиквенсам ВИЧ граждан РА нуклеотидные последовательности вместе с сопутствующей информацией (страна инфицирования, год забора крови). Всего с помощью этого инструмента была получена 871 последовательность.
Редактирование и обрезку нуклеотидных последовательностей выполняли в программе BioEdit 7.0.5.3. Выравнивание последовательностей проводили с использованием инструментов базы данных Лос-Аламос (https://www.hiv.lanl.gov/content/sequence/VIRALIGN/viralign.html) HMM-align методом. Субтипирование осуществляли с помощью инструментов базы данных университета Стэнфорда (https://hivdb.stanford.edu/), а также путем филогенетического анализа с использованием референсных последовательностей различных субтипов. Филогенетический анализ был выполнен в программе MEGA 6.0 (Maximum likelihood метод, bootstrap 100, модель GTR + G + I). Для выявления кластеров использовали программу Cluster Picker 1.2.3 с bootstrap 0.9 и порогом генетической дистанции в 4,5%. Визуализация и аннотация деревьев были выполнены в iTOL (https://itol.embl.de/).
Сравнения между группами проводили с применением точного критерия Фишера, значимость разницы между средними значениями двух неродственных групп определяли с использованием независимых t-критериев. Различия считали статистически значимыми при p < 0,05.
Результаты
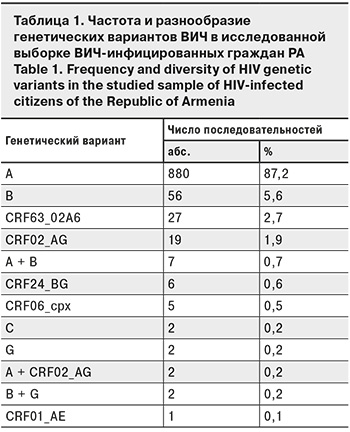
Разнообразие генетических вариантов ВИЧ в Республике Армения
В рамках исследования был произведен анализ 1009 клинических образцов плазмы крови, собранных и отсеквенированных от ВИЧ-инфицированных граждан РА ранее [9, 10]. В результате субтипирования было обнаружено, что 880 (87,2%) нуклеотидных последовательностей относятся к субтипу А. Проведенный далее филогенетический анализ показал, что 854 (97,05%) последовательности принадлежат к субсубтипу А6. Следующими по частоте встречаемости являлись субтип В (56 образцов, 5,6%), а также циркулирующие рекомбинантные формы CRF63_02А6 (27 образцов, 2,7%) и CRF02_AG (19 образцов, 1,9%). Доля остальных субтипов и рекомбинантных форм не превышала 1% для каждого варианта. В то же время разнообразие генетических вариантов, которые суммарно составили 2,7% (27 образцов), было значительно (табл. 1).
Генетическое сходство ВИЧ, циркулирующих в РА и других странах мира
Для анализа связанности генетических вариантов ВИЧ, проанализированных в ходе данного исследования, с вирусами ВИЧ-инфицированных из других стран был проведен поиск наиболее родственных нуклеотидных последовательностей ВИЧ, доступных в открытой базе данных Лос-Аламоса. Для каждой из 1009 последовательностей было подобрано по 10 наиболее родственных сиквенсов с последующим удалением дублирующихся последовательностей. Всего было получено 828 последовательностей, включая 44 из РА, депонированные ранее. В табл. 2 представлено распределение 784 нуклеотидных последовательностей (родственные последовательности из РА были удалены) по странам и генетическим вариантам.
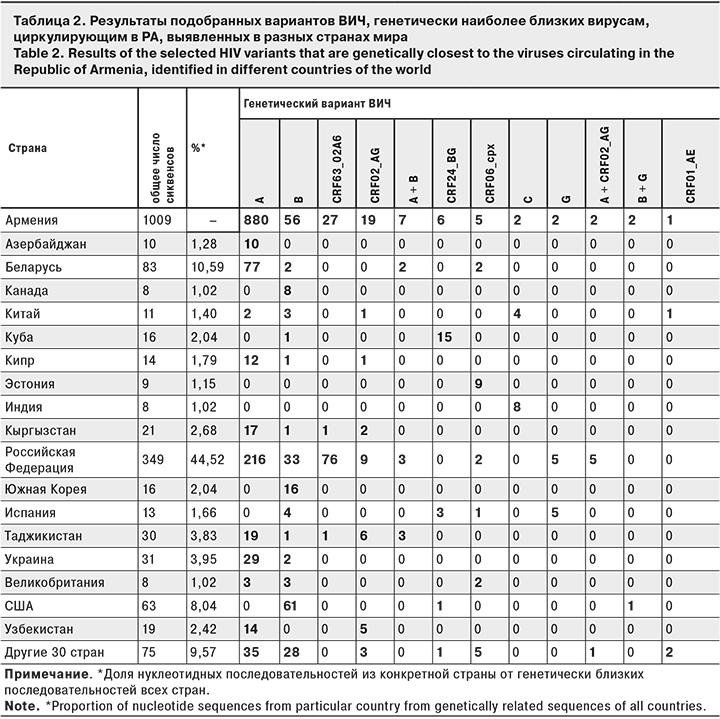
Более 90% генетически близких последовательностей происходили из 17 стран, в том числе 44,52% имели российское происхождение, 10,59% сиквенсов были из Республики Беларусь и 8,04% – США. Интересно отметить, что из некоторых стран все сиквенсы, родственные последовательностям из РА, принадлежали к единственному генетическому варианту. В частности, последовательности из Азербайджана относились к субтипу А, из Канады – субтипу В, из Эстонии – CRF06_cpx, из Индии – субтипу С.
Филогенетический анализ вариантов ВИЧ субтипа В
Тремя наиболее распространенными генетическими вариантами в РА ия являются субтип А (субсубтип А6), субтип В и CRF63_02A6. Согласно результатам анализа BLAST, представленным в табл. 2, доля последовательностей субтипа А и CRF63_02А6 из России составляет соответственно 49,8 и 97,4% всех подобранных наиболее генетически близких. В отношении субтипа В ситуация не столь однозначна; наибольшее количество подобранных инструментом BLAST родственных сиквенсов (61 образец, 37,2%) происходили из США и только 33 (20,1%) – из России. Для уточнения взаимосвязи генетических вариантов из разных стран был проведен филогенетический анализ сиквенсов, относящихся к субтипу В. Филогенетическое дерево представлено на рисунке (см. на вклейке).
Результаты филогенетического анализа показывают, что большая часть последовательностей из РА более родственны российским, нежели зарубежным, в том числе из США. Основная часть последовательностей из других стран образовали отдельный кластер, лишь небольшое их количество находятся среди российско-армянских сиквенсов. Также на дереве видно, что сиквенсы РА образовали 2 крупных кластера, которые не содержат последовательностей из других стран, в том числе из России.
Выявление и анализ молекулярных кластеров
Анализ молекулярных кластеров был проведен для определения эпидемиологических тенденций передачи вируса между странами. Однако в связи с недостаточным объемом эпидемиологической информации, присутствующей для сиквенсов из базы данных Лос-Аламоса, при выявлении молекулярных кластеров исследовали выборку, содержащую нуклеотидные последовательности ВИЧ-инфицированных из РА и России. При использовании порога генетической дистанции в 4,5% из 1009 сиквенсов РА 676 (67,0%) оказались внутри кластеров (67,0%). Кластеры состояли либо только из последовательностей ВИЧ-инфицированных граждан РА (АМ-кластеры), либо содержали также сиквенсы ВИЧ из России (смешанные AM-RU-кластеры). Мы сравнили эти группы с разбивкой по основным характеристикам пациентов и вируса (табл. 3).
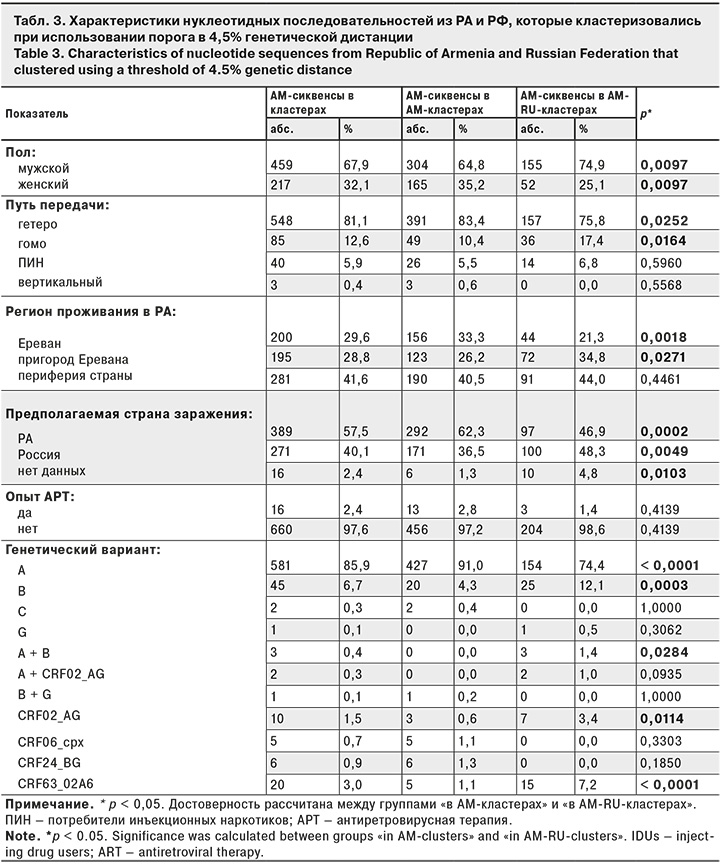
Было обнаружено, что достоверно чаще смешанные AM-RU-кластеры состояли из мужчин с гомосексуальным путем передачи, проживающих в пригороде Еревана, инфицированных предположительно в России, чем кластеры, содержащие только граждан из РА. В смешанных кластерах чаще регистрировали вирусы субтипа В либо рекомбинантные формы CRF63_02A6, CRF02_AG и рекомбинанты A + B.
В то же время кластеры, содержащие нуклеотидные последовательности ВИЧ только от граждан РА, имели следующие характеристики: женский пол, гетеросексуальный путь передачи, Ереван как регион проживания; РА как предполагаемая страна инфицирования и субтип А (субсубтип А6) как наиболее распространенный генетический вариант.
Обсуждение
Для РА характерна относительно невысокая пораженность населения ВИЧ-инфекцией. В то же время в ней, как и во многих других странах региона ВЕЦА [11], растет число новых случаев заражения. Согласно результатам эпидемиологического надзора, более 50% новых случаев заражения происходит вне страны, являясь, таким образом, значимой причиной развития эпидемии. При этом, согласно исследованиям [12, 13], в 90% случаев РФ является страной миграции граждан РА.
До недавнего времени молекулярно-генетические исследования ВИЧ в РА практически не проводились. в связи с этим оценить связанность эпидемий ВИЧ-инфекции в РА и других странах было невозможно. Однако в результате исследований, выполненных в 2016–2018 и в 2019–2021 гг. в рамках Распоряжений Правительства РФ № 2314-р и №2656-р, было получено более 1009 нуклеотидных последовательностей ВИЧ от граждан РА, что составляет более 25% ЛЖВ. Генетические данные о вирусе и сопутствующая информация о пациентах позволили оценить связанность эпидемии ВИЧ-инфекции в РА и других странах, в первую очередь в Российской Федерации.
Наиболее распространенным генетическим вариантом в РА является субсубтип А6 (более 87%). Чаще, чем в 1% случаев, регистрируют субтип В и рекомбинантные формы CRF63_02A6 и CRF02_AG. Эти результаты согласуются с данными предыдущих исследований, включавших меньшую по объемам выборку [14], а также схожи с профилем генетических вариантов, циркулирующих в Российской Федерации [15].
Благодаря широкомасштабному секвенированию ВИЧ по всему миру появилась возможность сравнить нуклеотидные последовательности вируса из РА с последовательностями, полученными в других странах. Общедоступная база данных Лос-Аламоса в настоящее время содержит более 1 млн сиквенсов вируса, в том числе 548.515 сиквенсов субтипа В и 18.624 сиквенса суб-субтипа А6 (данные на 23.03.2023). Для анализа была отобрана 871 последовательность, наиболее генетически близкая последовательностям ВИЧ-инфицированных пациентов из РА. Несмотря на то что отобранные последовательности относились к 47 различным странам, 44,52% в полученной выборке составляли сиквенсы из Российской Федерации, на втором месте по числу генетически близких сиквенсов находилась Республика Беларусь (10,59%), на третьем – США (8,04%). Нужно отметить, что ранее была описана связанность эпидемий в Республике Беларусь и Российской Федерации, а также высокая генетическая схожесть циркулирующих вариантов ВИЧ в этих странах [16]. Для 2 из 3 наиболее распространенных генетических вариантов вируса суб-субтипа А6 и CRF63_02A6 родственными являлись сиквенсы российского происхождением. Для субтипа В, было больше генетически близких нуклеотидных последовательностей из США, однако филогенетический анализ показал, что эти сиквенсы группируются в основном отдельно. Подавляющее большинство последовательностей субтипа В выделенных в РА, группировались с российскими сиквенсами, что указывает на их более короткую эпидемиологическую связь.
Для более глубокого изучения связи эпидемий, развивающихся в двух странах, была использована выборка, содержащая 3579 сиквенсов ВИЧ и эпидемиологическую информацию о ВИЧ-инфицированных гражданах РФ из базы данных ЦНИИЭ. Анализ показал, что значительную долю составляют смешанные кластеры, то есть группы, содержащие последовательности ВИЧ из обеих стран. Среди 676 кластеризовавшихся последовательностей ВИЧ от граждан РА 207 (30,6%) находились внутри смешанных кластеров. Их характеристика позволила определить, что более высокая частота интернациональной передачи вируса происходит среди граждан РА мужского пола, проживающих в пригороде Еревана, посредством гомосексуального пути передачи ВИЧ субтипа В либо рекомбинантных форм CRF63_02A6, CRF02_AG и A + B.
Заключение
Высокая частота инфицирования ВИЧ граждан РА на территории Российской Федерации логична и может объясняться более высокой пораженностью населения России, значительной трудовой миграцией, культурной и этнической близостью народов. Однако до настоящего времени это подтверждали только результаты эпидемиологических исследований. В данной работе с помощью молекулярных и биоинформатических методов мы показали высокое генетическое сходство вариантов ВИЧ, циркулирующих на территории двух стран, а также проанализировали эпидемиологические характеристики ВИЧ-инфицированных граждан РА, которые определяют более высокую частоту интернациональной передачи вируса. Полученные результаты могут быть использованы организациями общественного здравоохранения обеих стран при планировании профилактических программ, осуществляемых в отношении трудовых мигрантов.


