Рак головы и шеи (РГШ) – одна из самых распространенных локализаций рака, на который приходится 5–10% всех онкологических заболеваний в мире. В последнее время отмечается рост заболеваемости всеми злокачественными новообразованиями (ЗНО) головы и шеи [1]. К факторам риска развития РГШ относят курение табака и употребление алкоголя, воздействие ультрафиолетового излучения, различные инфекции, в частности, вирус папилломы человека (ВПЧ), а также воздействие окружающей среды [2].
ВПЧ – это повсеместно встречающиеся эпителиотропные ДНК-содержащие вирусы, способные инфицировать кожные покровы и слизистые оболочки животных и человека [3]. Исторически ВПЧ инфицирует людей на протяжении длительного времени. Так, с помощью ПЦР удалось выделить ДНК ВПЧ-18 у мумии Марии Арагонской (1503–1568) [4].
По оценкам специалистов, в мире ежегодно около 52 000 новых случаев РГШ вызваны ВПЧ, в том числе 30% рака ротоглотки, 2,1% рака полости рта и 2,3% рака гортани [5].
Этиологическая доля ВПЧ в развитии рака ротоглотки колеблется от 10% в некоторых регионах мира до более 80% в США. Это может объясняться различиями во временных, географических, социально-демографических сдвигах, в подверженности населения к курению табака и особенностями сексуального поведения [6].
Показатели заболеваемости ВПЧ-ассоциированным РГШ среди населения России за период с 2007 по 2018 г. имели тенденцию к росту при отсутствии динамики к снижению смертности от этой патологии. Среднегодовой показатель заболеваемости ВПЧ-ассоциированным раком губы, полости рта и глотки за рассматриваемый период составил 1,2 на 100 тыс. населения, а для рака гортани – 0,1 на 100 тыс. Обобщенный среднегодовой показатель заболеваемости ВПЧ-ассоциированным РГШ среди населения составил 1,4 на 100 тыс. населения [7].
ВПЧ-ассоциированный РГШ в разных половозрастных группах [8]. Так, в США ВПЧ-ассоциированным раком ротоглотки болеют в основном мужчины. Чаще всего он встречается в более молодом возрасте. Однако недавние исследования, проведенные в США, показывают, что эта патология не ассоциируется с более молодым возрастом [9].
Во многих странах мира зафиксирован рост случаев заболевания раком ротоглотки, связанного с ВПЧ, а также рост распространенности ВПЧ-инфекции [10]. В США тенденция к росту ВПЧ-ассоциированного рака ротоглотки была отмечена около 2 десятилетий назад, и в настоящее время большинство случаев связано с ВПЧ. В других странах, ранее классифицируемых как регионы с низким уровнем заболеваемости ВПЧ-ассоциированным раком ротоглотки, таких как Испания, Италия или Великобритания, в последние годы также наблюдается рост заболеваемости. Этот двадцатилетний разрыв можно связать с прекращением курения, а также различиями в сексуальном поведении между разными группами населения. Примечательно, что тенденции к увеличению неорофарингеального ВПЧ-зависимого РГШ не наблюдается [6].
Большинство случаев РГШ вызваны ВПЧ-16, включенного во все 3 доступные в мире вакцины против ВПЧ. Чаще всего ВПЧ-16 обнаруживают при раке ротоглотки [10].
Для оценки роли ВПЧ в развитии РГШ необходимы дополнительные популяционные и выборочные исследования, которые помогут в разработке стратегий клинического ведения и профилактики заболевания.
Наиболее эффективный метод профилактики – вакцинация против ВПЧ. По данным ВОЗ (WHO/IVB Database), на июнь 2020 г. вакцинация против ВПЧ включена в национальные программы иммунизации 107 стран мира, из них 42 страны внедрили в программы гендерно-нейтральный подход, в 4 странах она включена частично (например, в России ВПЧ-вакцинация входит в ряд региональных календарей профилактических прививок субъектов Федерации) [11]. Вакцинация против ВПЧ является единственным эффективным способом предотвращения развития ВПЧ-ассоциированных злокачественных новообразований головы и шеи. Следует подчеркнуть важность вакцинации против ВПЧ не только женщин, но и мужчин для профилактики распространения ВПЧ.
Цель исследования – клинико-эпидемиологическая характеристика пациентов с потенциально ВПЧ-ассоциированным РГШ по результатам выборочного исследования.
Материалы и методы
Проведен ретроспективный эпидемиологический анализ данных медицинских карт стационарного больного (форма 003/у) Университетской клинической больницы № 1 Первого МГМУ им. И.М. Сеченова Минздрава России и результатов типирования вирусов у больных с проявлениями ВПЧ-инфекции. В рамках исследования были проанализированы 295 карт пациентов (форма 003/у) с установленным диагнозом ЗНО головы и шеи с разной стадией патологического процесса; коды по МКБ-10: губа (C00), полость рта (С01–06, 07, 09, 14), глотка (С10–13), гортань (С32). Сводные данные о включенных в исследование пациентах представлены в табл 1.
Было проведено качественное определение ДНК ВПЧ высокого онкогенного риска (16 и 18 типов) в соскобе эпителиальных клеток методом ПЦР.
Данные о социально-экономическом положении и выживаемости обследованных были собраны методом телефонного опроса.
Для определения границ доходов в рамках абсолютного подхода (долларов США на человека в день с использованием паритета покупательской способности) использовали данные A. Grant и соавт. [12]. Расчет 95% ДИ, объема выборки, а также анализ и обработку данных проводили с помощью программ Epi Tools, Epi Info, Microsoft Office Excel 2010 и RStudio Desktop 1.2.5033.
Результаты
 На наличие ВПЧ были обследованы 58 пациентов с раком полости рта, 34 пациента с раком глотки и 8 пациентов с раком гортани Отрицательный результат был получен у 21 больного раком полости рта (36,2%; [22,3–52,2], у 11 больных раком глотки (32,4%; [16,1–52,8]) и у 6 больных раком гортани (75%; [36,8–95,3]).
На наличие ВПЧ были обследованы 58 пациентов с раком полости рта, 34 пациента с раком глотки и 8 пациентов с раком гортани Отрицательный результат был получен у 21 больного раком полости рта (36,2%; [22,3–52,2], у 11 больных раком глотки (32,4%; [16,1–52,8]) и у 6 больных раком гортани (75%; [36,8–95,3]).
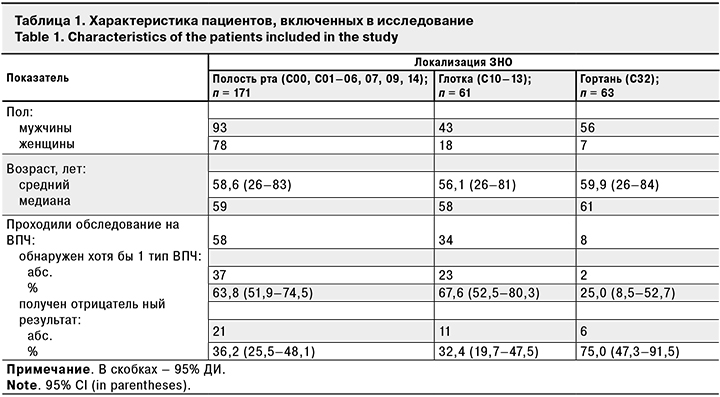
Наиболее часто у пациентов с раком полости рта и раком глотки обнаруживали ВПЧ-16 – в 75,7% ( 56,7–89,1%) и 69,6% (45,2–87,5%) случаев соответственно, а ВПЧ-18 в этих группах – в 21,6% (9,1–40,2%) и в 21,7% (7,3%–45,3%) случаев. Среди пациентов с раком гортани был выявлен только ВПЧ-16 типа (25%; [4,7–63,2%]) (рис. 1).
В 3,3% (0,6–11,6%) случаев выявляли одновременно оба типа – ВПЧ-16 и ВПЧ-18: у пациентов с ЗНО передней части дна полости рта (С07 по МКБ-10) в 2,7% (0,3–13,3%) случаев и с ЗНО ротоглотки (С10 по МКБ-10) – в 4,3%.
Среди 295 пациентов с РГШ было 192 мужчин и 103 женщин. Средний возраст составил 57,8 лет (26 –84 года, медиана – 59 лет) у мужчин и 59,5 лет (26–83 года, медиана – 61 год) у женщин. Патологические изменения имели следующую локализацию: полость рта, в том числе губа (С00); язык (С01,02); другие и неуточненные части полости рта (С03–06,09,14); большие слюнные железы (С07, 08); глотка, в том числе ротоглотка (С10); носоглотка (С11); гортаноглотка (С12, 13) и гортань (С32).
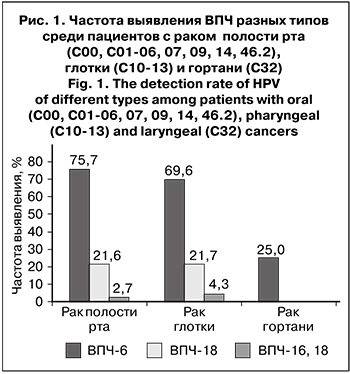
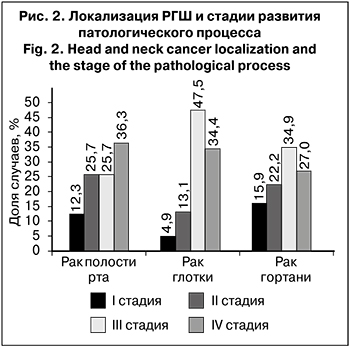 Значительно преобладали больные с III и IV стадией РГШ (32,2 и 33,9% соответственно), II стадия заболевания была выявлена у 22,4% пациентов, I стадия – только у 11,5%. Распределение РГШ в зависимости от локализации по стадиям онкологического процесса представлено на рис. 2.
Значительно преобладали больные с III и IV стадией РГШ (32,2 и 33,9% соответственно), II стадия заболевания была выявлена у 22,4% пациентов, I стадия – только у 11,5%. Распределение РГШ в зависимости от локализации по стадиям онкологического процесса представлено на рис. 2.
При раке глотки и гортани преобладали больные с III стадией патологического процесса (47,5 и 34,9% соответственно), а при раке полости рта – с IV стадией (36,3%).
При раке полости рта и раке гортани было выявлено больше больных с I и II стадией (38,0 и 38,1% соответственно) по сравнению с раком глотки (18,0%), при котором значительно преобладают запущенные стадии (III–IV) – 81,9%.
В 277 (93,9%; [89,8–96,7%]) случаях опухоль гистологически была определена как плоскоклеточный рак различной степени дифференцировки. Доля плоскоклеточного рака низкой степени дифференцировки составила 26,4% (20,1–33,3%) всех исследуемых плоскоклеточных опухолей, умеренной степени дифференцировки – 32,5% (25,8–39,8%), высокой степени дифференцировки – 41,2% (33,9–48,7%).
Неплоскоклеточный рак был выявлен у 4 пациентов (1,4%; [0,4– 3,7%]). В остальных случаях выявлены аденокистозный рак (3,7%; [1,7– 7,1%]), низкодифференцированная карцинома (0,3%; [0,0–1,8%]) и лимфоэпителиальный рак (0,7%; [0,1–2,5%]).
Анализ летальных исходов показал, что через 3 года после госпитализации скончались 13,6% (9,2–19,1%) пациентов. Среди умерших пациенты с ВПЧ-положительным РГШ составили 10,0% (2,8–24,8%), с ВПЧ-отрицательным – 17,5% (9,1–29,8%).
Была дана росто-весовая характеристика пациентов в зависимости от показателя индекса массы тела (ИМТ). Нормальную масса тела имели 47,1% больных (39,9–54,4%), дефицит массы тела отмечали у 5,4% (2,8– 9,3%) , избыточную массу тела – у 33,6% (26,9–40,7%), ожирением 1 и 2 степени страдали 12,9% (8,6–18,3%) и 1,0% (0,2–3,1%) пациентов соответственно.
Анализ социально-экономического положения показал, что средний уровень дохода (от 10 до 50 долл. США на человека в день) имели 39,0% (32,1–46,3%) обследованных, доход выше среднего (более 50 долл. США на человека в день) – 31,2% (24,7–38,2%), пациенты с низким доходом (менее 10 долл. США на человека в день) составили 29,8% (23,5–36,8%). Среди пациентов пенсионеров было 43,4% (36,3–50,7%), работающих – 32,5% (26,0–39,6%), неработающих – 23,7% (18,0–30,3%), учащихся –0,3% (0,0–1,8%). Доля женатых/замужних или живущих в гражданском браке составила 72,5% (65,7–78,7%), разведенных или живущих отдельно –18,3% (13,2– 24,4%); на долю вдовцов приходится 5,8% (3,1–9,8%). Никогда не были женаты/замужем 3,4% (1,5–6,7%).
Среди пациентов с потенциально ВПЧ-ассоциированным РГШ 68,5% (63,2–73,4%) имели высшее образование, 28,5% (23,7–33,6%) – среднее профессиональное и 3,1% (1,6–5,3%) – общее среднее.
Обсуждение
Согласно литературным данным, ВПЧ является причиной от 0 до 44% случаев рака полости рта, от 0 до 86% – ротоглотки, от 0 до 36% – гортани. Столь большой разброс можно объяснить демографическими особенностями популяции и разными методами как обнаружения, так и экстраполяции [13]. При ВПЧ-ассоциированном плоскоклеточном РГШ более 90% случаев связаны с ВПЧ-16 [14]. В одном из недавних исследований было показано, что ВПЧ-16 является наиболее часто выявляемым генотипом среди ВПЧ-положительных случаев (75,2%) в зависимости от локализации рака. Так, 83,0% ВПЧ-16 обнаруживали в ротоглотке, 68,8% – в полости рта и 50,8% – в гортани [8].
Основным фактором риска инфицирования опасными типами ВПЧ является количество сексуальных партнеров на протяжении жизни, практикующих оральный секс. Причем в мужской популяции количество половых партнеров в течение жизни в 3 раза больше, чем в женской. Примечательно, что мужчины от женщин инфицируются намного чаще, чем наоборот [15]. Половое различие в частоте инфицирования ВПЧ можно объяснить слабо выраженным и непродолжительным иммунным ответом после развития первичной генитальной инфекции у мужчин, и, как следствие – снижением защиты при повторном инфицировании во время орального контакта. В противоположность этому высокий уровень иммунного ответа у женщин в обычных условиях снижает риск повторного инфицирования опасным ВПЧ-16 на 50% [16].
Значительное преобладание доли больных с III и IV стадией РГШ демонстрирует высокий показатель запущенности данной патологии в России. В литературе не так много исследований, посвященных изучению зависимости наличия ВПЧ от стадии, локализации, дифференцировки опухоли и возраста больных. Только один автор отмечает, что при плоскоклеточном раке ротоглотки ВПЧ-16 выявляется чаще всего у молодых людей и при опухолях низкой степени дифференцировки [17]. Однако проведенный анализ установил преобладание опухолей высокой степени дифференцировки (41,2%; [33,9–48,7%]). Медиана развития ВПЧ-ассоциированного рака ротоглотки составляет 58 лет [18].
Известно, что пациенты с ВПЧ-положительным раком ротоглотки имеют более высокую выживаемость по сравнению с пациентами с ВПЧ-отрицательным раком ротоглотки. Высокий уровень инфильтрации CD8+ Т-клетками является важным фактором, способствующим повышению выживаемости таких пациентов [19, 20].
Обзор литературы показывает, что ВПЧ-положительный РГШ может ассоциироваться с мужским полом, высоким социально-экономическим статусом [21] и высшим образованием [22].
Заключение
В результате проведенного исследования была дана характеристика пациента с потенциально ВПЧ-ассоциированным РГШ в Российской Федерации. Так, основной локализацией этого заболевания является глотка (С10-13), ВПЧ-16 – наиболее часто обнаруживаемый тип папилломавируса. Средний возраст выявления потенциально ВПЧ-ассоциированного рака – 58,6 года. Чаще всего данную патологию обнаруживали у мужчин. Преобладают больные с III и IV стадией заболевания. Плоскоклеточный рак высокой степени дифференцировки – наиболее часто встречаемый тип опухоли. Трехлетняя выживаемость выше в случае ВПЧ-положительного РГШ, чем в случае ВПЧ-отрицательного. В большинстве случаев пациенты – женатые/замужние лица, имеющие нормальную массу тела, средний уровень дохода и высшее образование.
Такие пациенты с подтвержденным ВПЧ-ассоциированным РГШ будут включены в основную группу аналитического эпидемиологического исследования типа «случай–контроль» для дальнейшего изучения клинико-эпидемиологических характеристик и научного обоснования основных направлений профилактики ВПЧ-ассоциированного РГШ.
Результаты анализа клинико-эпидемиологических характеристик пациентов с потенциально ВПЧ-ассоциированным РГШ могут быть использованы в дальнейшей разработке направлений оптимизации систем эпидемиологического надзора и профилактики папилломавирусной инфекции.


