Менингококковая инфекция (МИ) относится к числу наиболее актуальных и проблемных инфекций в мире, что обусловлено значительной тяжестью течения заболевания, длительной реабилитацией больных, высокими показателями смертности и значительным социально-экономическим ущербом. Причины заболеваемости населения МИ являются предметом пристального внимания науки и практического здравоохранения всего мира [1–5]. Отечественными и зарубежными исследователями второй половины ХХ века была установлена гетерогенность популяции Neisseria meningitidis, изучена роль штаммов разных серогрупп в эпидемическом процессе инфекции. Были идентифицированы клональные комплексы, появление которых на различных территориях земного шара связано с подъемом заболеваемости МИ [6–10]. К современным достижениям в области изучения МИ следует отнести формирование международной общедоступной базы данных (http://pubmlst.org/neisseria/), в которую включены расширенные информационные параметры по штаммам N. meningitidis, позволяющие определять эпидемиологические взаимосвязи и выявлять опасные «гипервирулентные» клоны [11, 12]. В этой связи мониторинг заболеваемости МИ на современном этапе требует внедрения и применения технологий генотипирования бактерий, в частности метода мультилокусного секвенирования-типирования (МЛСТ), с целью слежения за появлением на территории высоковирулентных штаммов N. meningitidis, что позволит своевременно разработать стратегию предотвращения подъема заболеваемости [11, 13].
Целью настоящей работы являлась оценка эпидемической ситуации по МИ на территории Омской области.
Материалы и методы
При выполнении работы был использован комплекс эпидемиологических, лабораторных и статистических методов исследования.
Для изучения проявлений эпидемического процесса МИ на территории области были использованы данные официальной учетной и отчетной документации Управления Роспотребнадзора по Омской области за 1999–2011 гг.: статистические отчетные формы № 2 «Сведения об инфекционных и паразитарных заболеваниях» (с 1999 по 2011 г.), № 6-05 «Сведения о работе микробиологической (бактериологической, особо опасных инфекций, вирусологической, паразитологической) лабораторий федеральных государственных учреждений здравоохранения – центров гигиены и эпидемиологии», данные территориального органа Федеральной службы государственной статистики о численности различных возрастных групп населения области за указанный период.
Изучение проявлений эпидемического процесса МИ на территории области проводилось на основе ретроспективного анализа заболеваемости населения за тринадцатилетний период (1999–2011 гг.) по следующим основным параметрам: уровень и структура заболеваемости, многолетняя и внутригодовая динамика заболеваемости, летальность, смертность, интенсивность эпидемического процесса в различных территориях и социально-возрастных группах населения. Оценка лабораторного подтверждения диагноза генерализованной формы менингококковой инфекции (ГФМИ) проводилась за период 2000–2011 гг. Серогрупповая характеристика штаммов N. meningitidis, выделенных от пациентов с диагнозом ГФМИ и от погибших, проводилась за период 2004–2011 гг.
Исследования на территории области проводили на базе медицинских организаций сельских районов и Омска, ФБУЗ Центр гигиены и эпидемиологии в Омской области, Академического центра лабораторной диагностики Омской государственной медицинской академии Минздрава России.
Для лабораторного подтверждения диагноза обследовали заболевших МИ, находившихся на стационарном лечении в медицинских организациях Омска и сельских районов Омской области. Лабораторное подтверждение диагноза проводили с использованием как классических [микробиологическое культивирование образцов спинномозговой жидкости или крови пациентов с ГФМИ, или бактериологическое исследование носоглоточной слизи при локализованных формах], так и современных (некультуральных) методов [выявление антигенов N. meningitidis методом латекс-агглютинации и в полимеразной цепной реакции (ПЦР)].
В ходе работы были проведены иммуноэпидемиологические обследования населения с целью определения соотношения серонегативных и серопозитивных контингентов: исследовано 3057 сывороток крови путем постановки реакции непрямой гемагглютинации за период 2006–2011 гг.
Важно отметить, что диагноз считался подтвержденным только на основании объективных показателей и тех критериев, которые используются в международной практике, а именно выделения культуры или обнаружения специфического антигена в стерильных жидкостях организма (ликвор, кровь) [14].
Генотипирование для антигенной (серогруппа, субтипирование и аллель фрагмента VR белка FetA) и генетической характеристики штаммов (определением сиквенс-типа и клонального комплекса, в который входит исследованный штамм) проводили в Центре молекулярной диагностики ФБУН Центральный НИИ эпидемиологии Роспотребнадзора.
Клинический материал от 58 больных с подозрением на ГФМИ из медицинских учреждений Омской области был исследован методом ПЦР с использованием тест-систем производства ФБУН Центральный НИИ эпидемиологии Роспотребнадзора. Этиологическая диагностика проведена с использованием тест-системы «АмплиСенс Neisseria spp., Haemophilus spp., Streptococcus spp.-EPh». Определение серогрупповой принадлежности исследуемых образцов проведено с помощью тест-системы «АмплиСенс Neisseria meningitidis А, В, C-EPh». Типирование проводили согласно международным требованиям для проведения МЛСТ и антигенной характеристики бактерий вида N. meningitidis. Присвоение номеров аллелей, определение сиквенс-типов и обозначение клональных комплексов осуществляли согласно общепринятой международной номенклатуре через Интернет-ресурс http://pubmlst.org/neisseria/.
Материалы исследований подвергнуты статистической обработке с использованием математических методик, адекватных цели исследования, объему и структуре анализируемых выборочных совокупностей. Для представления средних и относительных показателей была использована дескриптивная статистика – относительные величины приводились с указанием 95% доверительного интервала (ДИ). Для определения статистической силы структурных различий в таблицах сопряженности были использованы коэффициент сопряженности Пирсона (φ2) и коэффициент Чупрова, для оценки значимости различий между интенсивными показателями – метод ANOVA (дисперсионный анализ). Для обоснования корректности применения параметрического метода были проверены гипотезы об отклонении распределения от нормального по критерию Шапиро–Уилка и равенства дисперсий (критерии Левене и Хартли–Бартлетта). Для оценки статистической значимости таблиц сопряженности была использована информационная 2I-статистика Кульбака. Критический уровень значимости (p) нулевой гипотезы был принят 0,05. Обработка данных проводилась с использованием электронных таблиц Microsoft Excel 2000 и программы Statisticа 6.0.
Результаты и обсуждение
На протяжении 1999–2011 гг. на территории Омской области регистрировалась спорадическая заболеваемость населения МИ. Среднемноголетний показатель заболеваемости МИ в регионе составил 3,09 (3,44 в областном центре и 2,47 в сельских районах области) на 100 тыс. населения и был в 1,4 раза выше среднего по Российской Федерации. В многолетней динамике заболеваемость имела выраженную тенденцию к снижению (Тсн. = -8,5%; p < 0,01) при этом инцидентность в 2011 г. составила 1,58 случая на 100 тыс. населения и была статистически значимо ниже показателя 1999 г. (p = 0,0005).
За период наблюдения в Омской области было зарегистрировано 726 случаев ГФМИ, распределение которых по районам области было неоднородным. Сельские муниципальные образования были сгруппированы с использованием метода процентилей в 3 группы: с низким (до 25-го процентиля), средним (25–75-й процентиль) и высоким (более 75-го процентиля) уровнем заболеваемости населения. Таким образом, было выделено 8 территорий, отнесенных к «рисковым» по заболеваемости населения ГФМИ: Кормиловский (3,20/0000) Называевский (3,30/0000), Нововаршавский (3,30/0000), Омский (5,10/0000), Павлоградский (3,60/0000), Таврический (3,80/0000), Шербакульский (3,60/0000) районы и Омск (3,40/0000).
Была проверена гипотеза о связи наличия железнодорожного сообщения на территории района и уровня заболеваемости ГФМИ. Железная дорога проходит по территории 10 районов области: Исилькульского, Калачинского, Кормиловского, Любинского, Марьяновского, Москаленского, Нововаршавского, Называевского, Омского, Русско-Полянского, Таврического, а также через областной центр. Остальные 22 района железных дорог не имеют. Так как уровни заболеваемости ГФМИ в 2 сравниваемых группах (как и по области в целом) имели распределение, которое при использовании критерия Шапиро–Уилка не позволило отвергнуть гипотезу о нормальном распределении (для области p = 0,687, для «железнодорожных» районов – 0,476 и для прочих – 0,616), а также гипотезу о равенстве генеральных дисперсий (по критерию Хартли–Бартлетта p = 0,650, по критерию Левене p = 0,840), то для определения статистической силы и значимости различий между уровнями заболеваемости ГФМИ был использован дисперсионный анализ (ANOVA). В результате этого анализа было установлено, что показатели заболеваемости в «железнодорожных» районах были значимо (p = 0,013) выше (3,5 ± 1,42 на 100 тыс. населения), чем в прочих (2,2 ± 1,26 на 100 тыс. населения). Статистическая сила различия в уровнях заболеваемости была средней (р = 0,43). Таким образом, была подтверждена гипотеза о прямой связи наличия железнодорожного сообщения и уровня заболеваемости населения ГФМИ на территории Омской области.
Положительная динамика заболеваемости населения МИ в Омской области сопровождалась аналогичной тенденцией и в отношении инцидентности ГФМИ (Тсн. = -6,3%, p < 0,01; рис. 1). Показатель заболеваемости ГФМИ в регионе составил за период наблюдения 2,710/0000 (2,930/0000 в областном центре и 2,430/0000 в сельских районах области), а доля случаев ГФМИ возросла с 72,9% в 1999 г. до 100,0% в 2011 г.
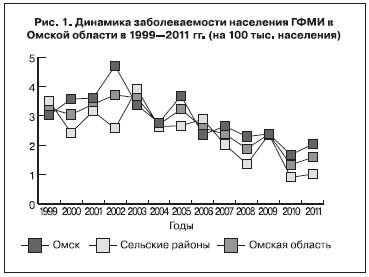
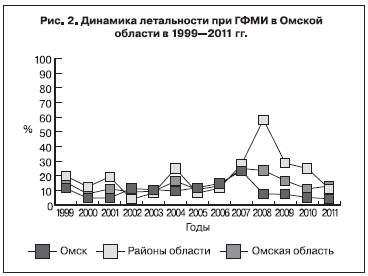
За исследуемый период наблюдалась умеренная тенденция к снижению смертности от ГФМИ в регионе (с 0,51 случая на 100 тыс. населения в 1999 г. до 0,1 случая – в 2011 г. Тсн. = -3,2%; p > 0,05). В 1999–2011 гг. показатель летальности демонстрировал тенденцию к росту (Тпр. = +2,2%; p > 0,05). Однако если в 1999–2007 гг. летальность увеличивалась (Тпр. = +7,6%; p > 0,05), то в 2008–2011 гг. наблюдалась выраженная тенденция к снижению (Тсн. = -13,2%; p > 0,05) (рис. 2).
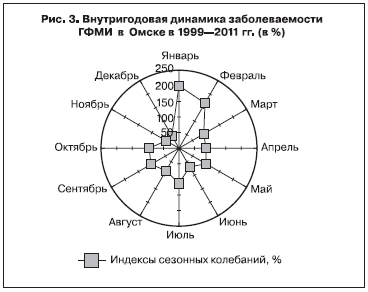
Внутригодовая динамика заболеваемости ГФМИ в Омске и сельских районах Омской области существенно различалась. В городе заболеваемость была выше среднегодового показателя в январе–феврале и июле (сезонный фактор обусловил 25,2% случаев заболеваний; рис. 3).
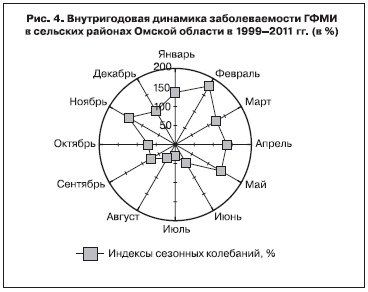
Эпидемический подъем в сельских районах области наблюдался в ноябре–мае (удельный вес заболевших за счет влияния сезонных факторов составлял 45,5%; рис. 4). Распределение случаев заболеваний ГФМИ по месяцам в Омске и сельских районах Омской области имело значимые отличия (2I = 23,7; p < 0,05).
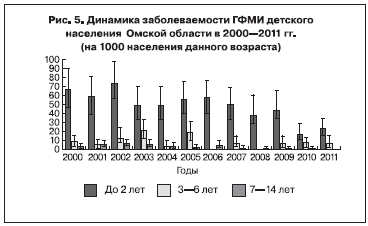
Особенностей распределения заболевших ГФМИ по возрастным группам в регионе не отмечалось. Наиболее высокие показатели заболеваемости регистрировались у детей до 2 лет – 46,5‰ (95% ДИ 41,7÷51,6), уменьшаясь с возрастом: от 3 до 6 лет – 7,7‰ (95% ДИ 6,0÷5,8), от 7 до 14 лет – 3,1‰ (95% ДИ 3,8÷2,3; рис. 5).
В структуре клинических форм МИ наибольший удельный вес занимали смешанные формы (менингит + менингококцемия) – 44,1% (95% ДИ 40,46÷47,72; Тпр. = +1,2%; р < 0,001) (см. таблицу).
Примечание. В скобках – 95% ДИ.
В среднем за период 2000–2011 гг. диагноз ГФМИ получил лабораторное подтверждение в 47,7% случаев (95% ДИ 43,90÷51,54) от числа обследованных (Тпр. = +1,4%) и демонстрировал слабые (j = 0,20) статистически значимые изменения (2I=27,0; p = 0,005).
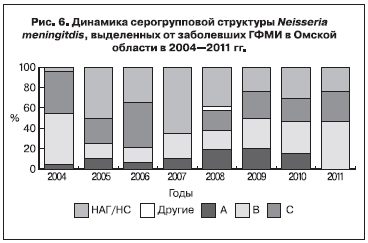
Серогрупповая характеристика N. meningitidis, выделенных от пациентов с диагнозом ГФМИ за период 2004–2011 гг., характеризовалась высоким удельным весом N. meningitidis, не принадлежащих к какой-либо серогруппе (неагглютинирующиеся – НАГ) или не прошедших процедуру серогруппирования (несерогруппированные – НС).
Показатели колебались от максимального в 2007 г. – 65,0% (95% ДИ 43,34÷83,82) до минимального в 2004 г. – 4,5% (95% ДИ 0,00÷16,91). Удельный вес N. meningitidis серогруппы В (NMВ) составил 27,8% (95% ДИ 21,48÷34,68), на долю N. Meningitidis серогруппы С (NMС) приходилось 27,3% (95% ДИ 20,96÷34,08), удельный вес N. meningitidis серогруппы А (NMА) и прочих серогрупп составил 11,4% (95% ДИ 7,11÷16,46) и 0,6% (95% ДИ 0,00÷2,21) соответственно (рис. 6).
В 2004–2011 гг. случаи летальных исходов при ГФМИ были обусловлены: NMВ – 52,0% (95% ДИ 32,76÷70,93), NMС – 24,0% (95% ДИ 9,66÷42,29), N. meningitidis НАГ/НС – 20,0% (95% ДИ 6,99÷37,56), NMА – 4,0% (95% 0,00÷14,98).
Значимой разницы среди заболевших в 2004–2011 гг. по серологическим характеристикам возбудителя между возрастными группами до 2 лет, 3–7, 8–14 и 15 лет и старше обнаружено не было (2I = 14,7; p = 0,258). При использовании коэффициента Чупрова различия в структуре были слабыми (Т = 0,17).
При сравнении серогрупповой структуры N. meningitidis, выделенных от умерших в возрастных группах до 2 лет и 15 лет и старше, было установлено средней силы (φ = 0,64) статистически значимое различие (2I = 10,5; p = 0,015). Установлено, что доля NMB среди умерших от ГФМИ в возрастной группе до 2 лет составила 68,4% (95% ДИ 46,39÷86,79) и была умеренно (φ = 0,58) и в высокой степени статистически значимо выше (p = 0,002), чем в группе 15 лет и старше. Доли N. meningitidis других серогрупп по возрастным группам у погибших значимо не различались.
Иммуноэпидемиологические исследования подтвердили наличие у 4,8% населения антител в защитном титре (1:20 и выше) к NMA и в 0,7% случаев – к NMС, что свидетельствовало о низкой интенсивности циркуляции менингококков этих серогрупп на территории Омской области, указывало на спорадический характер заболеваемости МИ и продолжающемся межэпидемическом периоде.
По результатам исследования методом МЛСТ менингококков в Российском референс-центре по мониторингу за бактериальными менингитами была дана генетическая и антигенная характеристика возбудителей ГФМИ, циркулирующих на территории Омской области. Были исследованы 8 штаммов Neisseria meningitidis: 1 штамм NMА, 3 – NMС, 4 – NMВ. Результаты типирования опубликованы в общедоступной базе данных (http://pubmlst.org/neisseria/; №№ idl5021, idl5028, idl5037 и idl3167, idl9175, idl9176, idl9177, idl9178). 2 штамма NMС и 2 штамма NMВ были отнесены к клональному комплексу «ST-41/44 complex/Lineage 3», типичному для штаммов этой серогруппы: менингококки серогрупп В и С, входящие в этот клональный комплекс, были выделены ранее на других территориях. Выявленный штамм серогруппы А с сиквенс-типом ST-7639 не входил ни в один из известных клональных комплексов.
Применение метода МЛСТ и антигенной характеристики на основании секвенирования позволяет следить за региональной эволюцией популяции N. meningitidis, своевременно выявлять наиболее опасные штаммы (клональные комплексы) и отслеживать закономерности их циркуляции, что необходимо для более полного и всестороннего эпидемиологического надзора за патогенными бактериями, циркулирующими на территории области [3].
Выводы
1. Заболеваемость населения ГФМИ в Омской области за последние 13 лет имела выраженную тенденцию к снижению (Тсн. = -6,3%; p < 0,01). По заболеваемости населения ГФМИ «территориями риска» являлись 7 сельских районов и город Омск, контингентом риска – дети в возрасте до двух лет, временем риска – зимне-весенний период с различными сроками и продолжительностью эпидемического сезона в областном центре и сельской местности.
2. Для Омской области была характерна умеренная тенденция к снижению смертности от ГФМИ (Тсн. = -3,2%; p > 0,05).
3. Среди заболевших МИ на территории Омской области преобладали смешанные клинические формы – 44,1% (95% ДИ 40,46÷47,72. Тпр. = +1,2%; р < 0,001).
4. В этиологической структуре заболевших ГФМИ доли серогрупп В и С были равными (соответственно 27,8 и 27,3%), при летальных исходах наибольший удельный вес (52,0%) в этиологии приходился на долю NMВ.
5. Среди обследованных лиц специфические антитела в защитном титре (1:20 и выше) к NMА были выявлены у 4,8%, к NMС – у 0,7%, что свидетельствует о низкой интенсивности циркуляции менингококков указанных серогрупп на территории Омской области.
6. Применение современных методов идентификации возбудителей позволили выявить новый штамм NMА, циркулирующий на территории Омской области.


