Стафилококк является одним из основных возбудителей, выявляемых при бактериемиях [1, 2]. Бактериемия, вызванная стафилококком, может приводить к таким осложнениям, как сепсис и септический шок [3]. Востребованность быстрых и эффективных методов этиологической диагностики метициллин-резистентных (МР) штаммов в крови обусловлена непосредственной угрозой для жизни пациентов с бактериемией, вызванной устойчивыми к большинству антибактериальных препаратов микроорганизмами [4, 5]. По данным ВОЗ, вероятность смерти людей, инфицированных МР золотистым стафилококком, на 64% выше по сравнению с пациентами, инфицированными метициллин-чувствительными штаммами [6]. На сегодня для идентификации МР стафилококков используют традиционные микробиологические методы, средняя продолжительность выполнения которых составляет от 2 до 7 дней. При этом ПЦР позволяет выявить ДНК МР стафилококка в течение нескольких часов. Внедрение быстрых диагностических тестов может снизить смертность и сроки госпитализации [7].
Целью нашей работы было сравнение результатов молекулярно-биологических и бактериологических методов для выявления МР стафилококка в крови.
Материалы и методы
В исследование было включено 240 пациентов с признаками инфекции, находившихся на лечении в многопрофильном стационаре Москвы в 2016–2017 гг., которым проводили параллельное бактериологическое и молекулярно-биологическое (ПЦР) исследование на наличие в крови МР стафилококков. Среди участников было 95 (40%) женщин и 145 (60%) мужчин. Возраст больных составлял от 18 до 96 лет (медиана – 56 лет).
Сбор, транспортирование, хранение и подготовку образцов материала осуществляли в строгом соответствии с требованиями СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I–IV групп патогенности» и рекомендациями «Взятие, транспортировка, хранение клинического материала для ПЦР-диагностики». Показаниями к бактериологическому и ПЦР-исследованию крови были катетер-ассоциированный тромбофлебит, фебрильная нейтропения (у пациентов с онкологическими заболеваниями), наличие у пациента 2 или более симптомов (гипотермия или лихорадка, лейкоцитоз, тахикардия, гипотензия).
Биологическим материалом для исследования методом ПЦР была кровь из периферической вены, взятая в вакуумные пробирки с ЭДТА с соблюдением правил асептики. Выделение ДНК МР стафилококков проводили с помощью комплекта реагентов «РИБО-преп» из плазмы, полученной путем отстаивания цельной крови. Количественное определение ДНК МP стафилококков выполняли с использованием набора реагентов «АмплиСенс®MRSA-скрин-титр-FL» (ФБУН ЦНИИЭ, Россия). Амплификацию осуществляли на приборе с системой детекции флуоресцентного сигнала в режиме реального времени Rotor-Gene Q (Qiagen, Германия). Для параллельного бактериологического исследования взятие крови проводили в стандартные флаконы с питательной аэробной и анаэробной средой (BACTEC™ Plus Aerobic/F Medium и BACTEC™Plus Anaerobic/F Medium). Флаконы культивировали в анализаторе BACTEC 9050 (Becton Dickinson, США). При выявлении роста микроорганизмов проводили идентификацию и определяли их чувствительность на бактериологическом автоматизированном анализаторе VITEK 2 Compact (bioMérieux, Франция) с применением международных критериев EUCAST (версия 7.1). Для внутрилабораторного контроля определения чувствительности к метициллину использовали референс-штаммы из коллекции ATCC (Staphylococcus aureus ATCC®43300, Staphylococcus aureus ATCC®33591).
Накопление, корректировку и систематизацию исходной информации осуществляли в электронных таблицах Microsoft Office Excel. Материалы исследования были подвергнуты статистической обработке методами параметрического и непараметрического анализа с использованием ресурса Epitools (https://epitools.ausvet.com.au/) [8]. Пороговое значение концентрации ДНК в исследуемых образцах определяли путем ROC-анализа (https://epitools.ausvet.com.au/roccurves).
Результаты
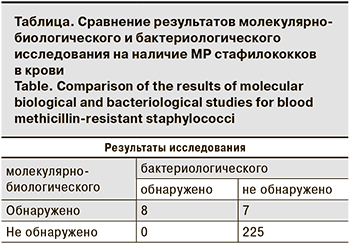 Методом ПЦР МР стафилококки были выявлены у 15 (6,3%) пациентов с признаками инфекции, а с помощью бактериологических методов – у 8 (3,3%).
Методом ПЦР МР стафилококки были выявлены у 15 (6,3%) пациентов с признаками инфекции, а с помощью бактериологических методов – у 8 (3,3%).
Проведенные молекулярно–биологические исследования подтвердили наличие гена mecA в образцах крови от 15 пациентов, ген mecC ни в одном из образцов обнаружен не был. В 7 из 15 случаев, подтвержденных методом ПЦР, посевы роста не дали. По отрицательным образцам полное совпадение двух методов наблюдалось для биоматериала от 225 пациентов (см. таблицу).
Чувствительность метода ПЦР в сравнении с бактериологическим методом в нашем исследовании составила 100%, специфичность – 97%. Одним из средств оценки эффективности диагностического теста является метод, основанный на анализе так называемой операционной характеристической кривой (ROC-анализ) [9]. Для оценки качества метода ПЦР ДНК МP стафилококков в крови был проведен ROC-анализ. При построении ROC-кривой получен следующий график (см. рисунок). Площадь под кривой AUC (которая располагается в интервале от 0 до 1, где 1 – идеальная модель) в нашем случае составила 0,98, что максимально приближено к идеальному случаю.
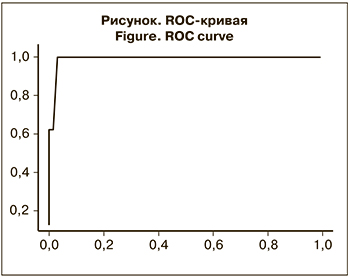 Результаты ПЦР и бактериологического метода совпали в 97% проб (для 233 пациентов). Для 7 (3%) проб были получены дискордантные результаты. ROC-анализ показал, что 100% специфичности метода ПЦР относительно бактериологического метода можно добиться, если порогом положительного результата будет концентрация ДНК МP стафилококков 1200 копий/мл и выше. Но тогда чувствительность метода ПЦР упадет до 63%. Учитывая, что концентрация стафилококков в крови обычно невысока, повышая порог, можно получить ложноотрицательные результаты. Поэтому оптимальным порогом положительного результата для выявления ДНК МР стафилококков в крови считаем значение 100 копий/мл и выше. В этом случае чувствительность составляет 100%, а специфичность – 97%. Наличие дискордантных результатов можно объяснить как ложноположительным результатом теста ПЦР, так и, возможно, большей чувствительностью метода ПЦР по сравнению с бактериологическим методом. Для 7 пациентов с дискордантными результатами бактериологический посев был отрицательным по всем возбудителям (роста культуры не было). При этом у всех 7 пациентов имели место признаки инфекции различной локализации, подтвержденные клиническими, лабораторными и инструментальными данными: в 2 случаях диагностирована пневмония, в 2 – инфекция кожи и мягких тканей, у 1 пациента была инфекция мочевыводящих путей, еще 2 больных гематологического профиля страдали фебрильной нейтропенией после перенесенной высокодозной химиотерапии. Для 5 из 7 пациентов с дискордантными результатами известны данные по биомаркеру сепсиса – пресепсину. Уровень пресепсина, при котором инфекционный процесс маловероятен, – 200 пг/мл [10]. У этих 5 пациентов уровень пресепсина превышал этот порог и составлял от 303 до 1107 пг/мл (медиана – 558 пг/мл). Показатель пресепсина выше 1000 пг/мл трактуется как высокий риск развития системной инфекции (сепсис, септический шок) [10]. У 1 из пациентов с пневмонией, отрицательными результатами бактериологического исследования крови и положительными результатами ПЦР имели место клинические проявления сепсиса, оценка по SOFA составила 6 баллов, показатель пресепсина были на уровне 1107 пг/мл, а прокальцитонина – 7,5 нг/мл. Это дает основания предполагать, что данные, полученные с помощью бактериологического метода, могли быть ложноотрицательными. Наблюдений, когда с помощью метода ПЦР в крови были выявлены гены МР стафилококков, а с помощью бактериологического – какие-либо другие микроорганизмы, в нашем исследовании не отмечено.
Результаты ПЦР и бактериологического метода совпали в 97% проб (для 233 пациентов). Для 7 (3%) проб были получены дискордантные результаты. ROC-анализ показал, что 100% специфичности метода ПЦР относительно бактериологического метода можно добиться, если порогом положительного результата будет концентрация ДНК МP стафилококков 1200 копий/мл и выше. Но тогда чувствительность метода ПЦР упадет до 63%. Учитывая, что концентрация стафилококков в крови обычно невысока, повышая порог, можно получить ложноотрицательные результаты. Поэтому оптимальным порогом положительного результата для выявления ДНК МР стафилококков в крови считаем значение 100 копий/мл и выше. В этом случае чувствительность составляет 100%, а специфичность – 97%. Наличие дискордантных результатов можно объяснить как ложноположительным результатом теста ПЦР, так и, возможно, большей чувствительностью метода ПЦР по сравнению с бактериологическим методом. Для 7 пациентов с дискордантными результатами бактериологический посев был отрицательным по всем возбудителям (роста культуры не было). При этом у всех 7 пациентов имели место признаки инфекции различной локализации, подтвержденные клиническими, лабораторными и инструментальными данными: в 2 случаях диагностирована пневмония, в 2 – инфекция кожи и мягких тканей, у 1 пациента была инфекция мочевыводящих путей, еще 2 больных гематологического профиля страдали фебрильной нейтропенией после перенесенной высокодозной химиотерапии. Для 5 из 7 пациентов с дискордантными результатами известны данные по биомаркеру сепсиса – пресепсину. Уровень пресепсина, при котором инфекционный процесс маловероятен, – 200 пг/мл [10]. У этих 5 пациентов уровень пресепсина превышал этот порог и составлял от 303 до 1107 пг/мл (медиана – 558 пг/мл). Показатель пресепсина выше 1000 пг/мл трактуется как высокий риск развития системной инфекции (сепсис, септический шок) [10]. У 1 из пациентов с пневмонией, отрицательными результатами бактериологического исследования крови и положительными результатами ПЦР имели место клинические проявления сепсиса, оценка по SOFA составила 6 баллов, показатель пресепсина были на уровне 1107 пг/мл, а прокальцитонина – 7,5 нг/мл. Это дает основания предполагать, что данные, полученные с помощью бактериологического метода, могли быть ложноотрицательными. Наблюдений, когда с помощью метода ПЦР в крови были выявлены гены МР стафилококков, а с помощью бактериологического – какие-либо другие микроорганизмы, в нашем исследовании не отмечено.
Обсуждение
Высокая встречаемость МР штаммов среди клинических изолятов стафилококков делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество медицинской помощи. В этих условиях появляется необходимость совершенствования методов микробиологического мониторинга, проводимого в стационарах. В нашем исследовании было показано, что молекулярно-биологические методы могут успешно выявлять МР стафилококки в крови при бактериемии. Различия между результатами, полученными с помощью бактериологического метода и ПЦР, демонстрируют, что использование только посева может упустить важную информацию о присутствующих МР стафилококках в крови. Молекулярные методы могут быть использованы для получения ускоренного результата. При этом, учитывая более высокую чувствительность метода ПЦР, крайне важно соблюдать все правила асептики при заборе биологического материала, чтобы не допустить получения ложноположительных результатов.
Заключение
Проведенное исследование показало, что метод ПЦР в режиме реального времени обладает высокой чувствительностью и специфичностью. Использование молекулярно-биологических методов для выявления и идентификации микроорганизмов в крови не может быть альтернативой традиционным бактериологическим исследованиям, так как выявляет ограниченный спектр микроорганизмов. Однако внедрение метода ПЦР необходимо для проведения оперативной диагностики осложнений, ассоциированных с МP штаммами стафилококка. Это позволит увеличить возможность идентификации этиологического агента при бактериемии и сепсисе, значительно сократить срок диагностического исследования, а значит своевременно назначить адекватную антимикробную терапию.


