Проблема пневмоний всегда представляла большой научный и практический интерес. В последнее время она привлекает к себе еще большее внимание в связи с широким распространением ОРВИ, гриппа и приобретенных иммунодефицитых состояний, которые способствуют росту удельного веса пневмоний в структуре общей заболеваемости населения.
Широкое использование в диагностике пневмоний рентгенологических методов исследования ставит вопрос о необходимости улучшения лучевой диагностики как в организационном (обеспечение доступности КТВР и МСКТ), так и в научном плане (разработка алгоритмов рентгенологической дифференциальной диагностики пневмоний, различных в этиологическом и в патогенетическом отношении).
В настоящее время особую важность приобретают также вопросы бактериологической диагностики пневмоний. Можно согласиться с мнением ряда исследователей о том, что разделение этиологического и патогенетического фактора при пневмониях не всегда просто и подчас условно. Однако этиологическая роль эндогенных микробов не должна оспариваться. Точное установление возбудителя приводит к рациональному выбору лекарственного препарата (антибактериального, антимикотического, противовирусного и др.) и выздоровлению пациента.
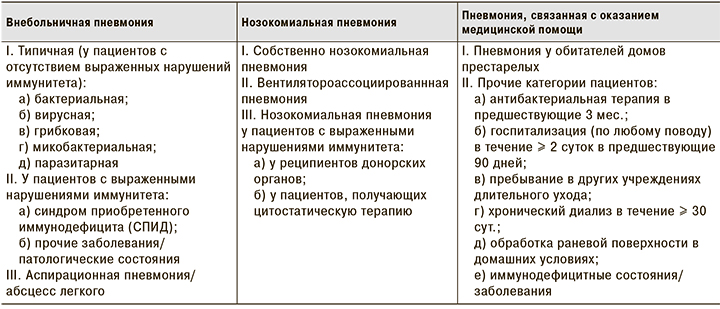
Согласно классификации академика А.Г. Чучалина, (см. таблицу) пневмонии подразделяются на внебольничные, нозокомиальные (госпитальные, приобретенные в лечебном учреждение при длительном нахождение в нем) и связанные с оказанием медицинской помощи [1].
Этиологическим агентом пневмоний могут быть вирусы, грибы, бактерии, простейшие, гельминты. Некоторых возбудителей можно отнести к облигатным пнеймотропам (пневмококки, Klebsiella pneumoniae или палочка Фридлендера, микобактерии туберкулеза и т. д.). Другие микроорганизмы, находящиеся в полости рта и верхних дыхательных путях, являются условно патогенными (стафилококки, стрептококки, вирусы гриппа и т. д.) и вызывают заболевание при определённых условиях, приводящих к снижению резистентности организма [1].
Одной из ведущих патологий в группе заболеваний органов дыхания является внебольничная пневмония. Согласно предложенной классификации, выделяют внебольничную пневмонию типичную и аспирационную и пневмонию у пациентов с нарушениями иммунной системы [1].
Показатель заболеваемости внебольничной пневмонией на территории Российской Федерации в 2011 г. составлял 316,0 на 100 тыс. населения, а в 2017 г. – уже 413,15, темп прироста составил 30,7%. Известно, что данные официальной статистики не отражают истинной картины заболеваемости пневмонией, и по мнению ученых [2, 3], ежегодно число заболевших превышает 1,5 млн человек.
В проблеме пневмоний первостепенного внимания заслуживает изучение вопросов реактивности организма, которая обусловливает по существу не только возникновение большинства пневмоний («пневмониями не заражаются, ими заболевают»), но и всю динамику заболевания [4].
В связи с массовым применением антибактериальных препаратов возникла серьезная проблема значительного изменения поведения и пейзажа возбудителей. Поэтому при изучении этиологической структуры пневмоний в настоящее время следует непременно учитывать следующие факторы:
- высокую эффективность антибактериальных препаратов, приводящих к купированию большинства пневмококковых пневмоний;
- подавление en masse пневмококковой флоры, уменьшение активности и снижение выработки токсинов;
- изменчивость возбудителей, что сказывается на возникновении резистентности штаммов пневмококков и стрептококков;
- значительное увеличение в связи с лекарственным дисбактериозом удельного веса патогенных стафилококков и отчасти стрептококков в этиологии пневмоний, особенно детского возраста;
- широкое необоснованное применение антибиотиков широкого спектра действия, приводящее к развитию микотических пневмоний;
- увеличение регистрации атипичных и вирусных пневмоний в ослабленных организмах.
Бактериальная пневмония является основной причиной заболеваемости и смертности среди ВИЧ-инфицированных лиц, при этом вероятность ее развития в 25 раз выше, чем среди обычного населения [5–8]. Известно, что бактериальная пневмония, исключая пневмонию, вызванную Pneumocystis jirovecil, была главной причиной летального исхода среди зараженного ВИЧ контингента в Соединенных Штатах в течение 1990–1999 [9].
С появлением антиретровирусной терапии (АРТ), отмечено снижение регистрации оппортунистических инфекции, связанные со СПИДом [10, 11]. Тем не менее в настоящее время при широком применении АРТ, заболеваемость бактериальными пневмониями не уменьшается. По мнению ряда авторов [12, 13], в Италии показатель заболеваемости бактериальной пневмонией в период высокого охвата АРТ (около 65,0%) составил 7700 и 9100 случаев на 100 тыс. ВИЧ-инфицированных пациентов [12, 13]. В Европе у пациентов в стадии СПИДа развитие рецидивирующей бактериальной пневмонии увеличилось в 3 раза (с 1,5 до 4,6%) после начала АРТ [14]. В период 1996–2000 гг. в Бронксе бактериальная пневмония была самым частым диагнозом у ВИЧ-инфицированных пациентов, получающих АРТ, при обращении в стационары [15].
Рецидивирующая бактериальная пневмония в стадии СПИДа в Европе чаще регистрировалась у женщин, что являлось частой причиной их госпитализаций [16]. Было установлено, что риск развития этого заболевания гораздо выше у женщин, с количеством СD4+-лимфоцитов от 201 до 500 клеток /мкл, принимающих АРТ менее 12 мес. или наркотические препараты как инъекционным, так и аэрогенным путем [17].
Среди возбудителей внебольничной пневмонии лидирующее место занимает Streptococcus pneumonia. Инфекции респираторной системы у ВИЧ-инфицированных больных часто вызывают S. aureus, H. influenzae, K. pneumoniae, P. аeruginosa, энтеробактерии, а также атипичные возбудители, такие как Legionella pneumophila, Mycoplasma pneumonia и Chlamydophila pneumoniae, которые у пациентов с ВИЧ-инфекцией регистрируют значительно реже, чем у ВИЧ-отрицательных лиц [18–20].
S. pneumoniae – это факультативно-анаэробные грамположительные диплококки, для которых были определены более 90 серотипов [21]. Этот возбудитель колонизирует носоглотку, оттуда он может распространяться через дыхательные пути в легочную ткань и вызывать пневмонию. S. pneumoniae также способны вызывать синуситы, отиты, ларингиты, бактериальные менингиты и т. д. [22, 23]. Иногда возбудитель может попасть в легочную ткань воздушно-капельным или контактным путем, особенно в местах большого скопления людей.
Геном S. pneumoniae обладает высокой вариативностью. Известно, что микроорганизм заимсвует информацию ДНК из различных источников, в том числе и из клеток макроорганизма, тем самым приобретая гены множественной лекарственной устойчивости [24].
Клеточная стенка S. pneumoniae представлена пептидогликаном со встроенными углеводами, тейхоевой кислотой, липопротеинами и поверхностными белками. Полисахаридная капсула микроорганизма является мощным защитным механизмом, который препятствует опсонизации и последующему фагоцитозу. В зависимости от антигенных свойств и особенностей строения капсулы выделяют 93 различных серотипа S. pneumoniae. Вирулентность их различна. Одни серотипы (3, 6A, 6B, 9N и 19F) увеличивают риск развития летального исхода в период бактериемии, другие (1, 7F, 8), наоборот, связаны с низким риском смерти [25]. По мнению других авторов, пневмококки с иными серотипами (1, 2, 3, 5, 7, 14, 16, 25, 28, 36, 43, 46 и 47) обладают более высокой вирулентностью и выделяются преимущественно при инвазивных инфекциях. Серотипы 6, 18, 19 и 23 выявляются и локализуются преимущественно у бактерионосителей [26]. Колонизирующие штаммы у лиц с сопутствующей патологией ведут себя как «оппортунистические инфекции», однако заражение вирулентными серотипами у пациентов в группах риска однозначно приведет к возникновению бактериальной пневмонии.
Совершенно очевидно, что возникновению любого аутоинфекционного процесса, в том числе пневмонии, должны предшествовать изменения в состоянии организма. Эти изменения, играющие основную роль в возникновении пневмонии, могут быть чрезвычайно разнообразными и вызываться многими причинами. К первой группе относятся изменения организма, способствующие попаданию возбудителя в дыхательные пути и задержке их в легочной ткани. Это могут быть различные виды нарушений защитных функций органов дыхания: снижение мукоцилиарного клиренса, присутствие других микроорганизмов и вирусов в носоглотке и т. д. Вторую группу составляют изменения общего состояния макроорганизма, снижение его реактивности: изменение иммунобиологической реакций, обменных процессов, воспалительной реакции и т. д. Известно, что у пациентов после спленэктомии, при наличии серповидно-клеточной анемии, дефиците Т- и В-клеточного иммунитета часто развивается пневмококковая инфекция [26]. Вследствие этого микроорганизмы, попавшие и задержавшиеся в легочной ткани, не уничтожаются, а наоборот, получают возможность размножаться в степени, необходимой для развития воспалительного процесса. Пневмококки заносятся в дистальные отделы респираторной системы, прикрепляются к стенке альвеолы и начинают распространяться не только бронхогенным путем, но и через поры Кона, от альвеолы к альвеоле [26].
Пневмококковая пневмония протекает по типу крупозной плевропневмонии либо очаговой бронхопневмонии. В результате исследований В.Д. Цизерлинга, Т.А. Штейн, В.Н. Фадеевой и других установлено, что воспалительный процесс в данном случае имеет тенденцию к распространению по легочной ткани наподобие масляного пятна вследствие растекания отечной жидкости, содержащей размножающихся возбудителей через поры в межальвеолярных перегородках. На периферии очага образуются наиболее свежие изменения в виде микробного отека, в центре которого – лейкоцитарный или лейкоцитарно-фибринозный экссудат, в котором часто уже не содержатся микробы. На участках на границе с отеком обнаруживаются фагоцитированные кокки. При крупозной плевропневмонии микробный отек выражен сильнее, чем при других бактериальных поражениях, и процесс захватывает большую часть доли легкого. Некроза ткани не происходит. Лишь в редких случаях при обширных поражениях могут наблюдаться некробиотические изменения в результате нарушения кровообращения.
Для пневмококковой пневмонии характерно быстрое, нередко внезапное начало болезни, постоянная фебрильная лихорадка выше 38 °С и явления выраженной интоксикации. Некоторые исследователи отмечали наличие одышки (70,0%), кашля (85,0%), лихорадки (88,0%), плеврального выпота (59,0%), тахикардии от 92 до 104 ударов в минуту [27]. При аускультации часто выслушиваются хрипы, как влажные (54,3%), так и сухие (32,3%). Рентгенологически отмечали наличие инфильтрации средней интенсивности в 40,8% случаев с двусторонним поражением, в 43,6% – поражение двух сегментов одного легкого. У каждого 5-го пациента в патологический процесс вовлекалась плевра с развитием сухого (фибринозного) плеврита, который хорошо поддавался лечению антибактериальными препаратами [28].
Летальность при пневмококковых пневмониях составляет от 8,8 до 34,3%, что зависит от возраста (старше 65 лет); сопутствующей патологии, особенно ВИЧ-инфекции; распространенности поражения в легочной ткани; уровня креатинина и С-реактивного белка [29, 30]. При этом отмечена частая смертность в первые 15 дней нахождения в стационаре в связи с прогрессирующим отеком головного мозга. Причиной летального исхода в течение первых 30 дней пребывания в стационаре могут служить гнойный менингит и менингоэнцефалит, развитие респираторного дистресс-синдрома, острая почечная недостаточность и септический шок [27, 28].
По данным M. Saindou и соавт. [31], у ВИЧ-инфицированных пациентов на фоне, казалось бы, нетяжелого течения пневмококковой пневмонии в 10–25,0% случаев наблюдалась бактериемия, что объясняло возникновение бактериальных осложнений в других органов (синуситы, отиты и т. д.).
На эффективность лечения влияла выявленная лекарственная резистентность S. pneumonia к пенициллину в 11% случаев, эритромицину – в 7%, к тетрациклинам – в 25%, к ко-тримоксазолу – в 39% [29, 32]. Полирезистентностью (устойчивостью к 3 и более классам антимикробных препаратов) обладают 14,5% штаммов пневмококка.
У ВИЧ-инфицированных лиц даже при АРТ из-за медленного, неполного восстановления иммунитета отмечается предрасположенность к развитию тяжелых пневмококковых заболеваний. Этот риск повышается за счет особенностей образа жизни, например, курения табака и вдыхания других психоактивных веществ, которые усиливают иммуносупрессию, подавляя альвеолярные макрофаги, и оказывают повреждающее, токсическое действие на респираторную систему. R.E. Hirschtick и соавт. [33] утверждают, что у ВИЧ-инфицированных при инъекционном употреблении наркотических веществ риск развития бактериальных пневмоний в 7 раз выше, чем при половом пути передачи инфекции.
При анализе 148 штаммов пневмококка, выделенных в четырех российских региональных центрах по профилактике и лечению СПИДа от пациентов с инфекциями верхних дыхательных путей, была выявлена резистентность к кларитромицину и азитромицину у 43,2% больных [34].
По данным разных авторов [33, 35, 36], S. pneumonia выявлялется у ВИЧ-инфицированных больных в 10,9–24,5% случаев при количестве СD4+-лимфоцитов менее 300 клеток/мкл.
Клиницисты часто указывают на невозможность прижизненного определения этиологии пневмоний. Нередко необходимость выделения пневмоний различных этиологий недооценивается. При этом обычно ссылаются на то, что лечение их все равно будет одинаково. На самом деле незнание и неумение отличать разные формы пневмоний может стать причиной смерти больных, которых безуспешно лечили пенициллинами.
Диагностика S. pneumonia сложна в связи с повышенной чувствительностью микроорганизма, требовательностью к условиям культивирования и способностью к быстрому аутолизу. Чаще всего в литературе описан метод ПЦР-диагностики соскоба из зева и носа на S. pneumoniae. Также возможна верификация возбудителя методом микроскопии (позволяющим получить предварительное заключение) и бактериологическим методом (посев крови, мокроты, бронхолаважной, плевральной и спиномозговой жидкости) [37].
H. influenzae вызывает у ВИЧ-инфицированных 10–15% случаев бактериальных пневмоний [38, 39], которые обычно возникают в возрасте 20–49 лет и встречается в 100 раз чаще, чем у ВИЧ-негативных пациентов [40]. В исследовании, проведенном E. Cordero и соавт. [41], начало клинических проявлений было острым в 70,0% случаев, в остальных 30,0% наблюдалось подострое течение продолжительностью 15–20 дней. Основными признаками были лихорадка (100%), кашель (96,2%) с гнойной мокротой (57,7%), одышка (53,8%) и боль в груди (38,5%). Кровохарканье было отмечено у 7,7% пациентов. Средняя продолжительность указанных симптомов составила 6 дней, и ни у одного пациента не было выявлено септического шока. Используя метод мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки, авторы определили инфильтраты с поражением одной доли у 34,6% пациентов, двух долей – у 7,7%, двустороннее поражение – в 57,7% случаев. У пациентов с односторонним поражением, которые часто являлись курильщиками табака, в 3,8% случаев выявили плеврит на стороне поражения. При двусторонних инфильтративных изменениях в легких у ВИЧ-инфицированных больных регистрировали сопутствующую бактериальную инфекцию (чаще ЛОР-органов).
S. aureus – третья по частоте причина бактериальной пневмонии у ВИЧ-инфицированных [28], однако определяющим фактором является употребление инъекционных наркотических веществ. При нем часто развивается бактериальный эндокардит, вызванный S. aureus, нередко с поражением трикуспидального клапана и возникновением эмболов, которые могут мигрировать в сосудах больного [36].
По данным В.В. Николенко и соавт. [28], пневмонии, вызванные S. аureus, начинались остро с выраженного синдрома интоксикации, лихорадки выше 38 °С у 87,3% пациентов, появления кашля с первых дней заболевания. При проведении рентгенологического исследования поражение двух сегментов одного легкого было выявлено у 71,7% ВИЧ-инфицированных больных, двусторонние поражения – у 43,7%. По клиническим признакам сложно отличить пневмонию, вызванную S. pneumoniae, но многие авторы отмечают нестабильность гемодинамики у пациентов со стафилококковым поражением, более высокий процент развития септического шока, вторичных гнойных поражений и высокую летальность в 30% случаев [28].
D. Christensen и соавт. в своем исследовании в 14% случаев выявляли метициллин-резистентный золотистый стафилококк (MRSA), вызывающий вспышки пневмоний у лиц нетрадиционной сексуальной ориентации, преимущественно с уровнем СD4+-лимфоцитов менее 15 клеток/мкл [42]. В некоторых случаях стафилококковая пневмония развивалась у пациентов после использования центральных венозных катетеров, при выраженной нейтропении, что необходимо учитывать при назначении терапии [43].
Pseudomonas aeruginosa является возбудителем пневмоний у лиц с иммунодефицитными состояниями (как врожденными, так и приобретенными), в том числе у пациентов с ВИЧ-инфекцией [18]. В эпоху отсутствия АРТ этот возбудитель был частой причиной внебольничных пневмоний, особенно при уровне СD4+-лимфоцитов менее 50 клеток/мкл [44].
Имеются данные о высокой резистентности P. aeruginosa: к цефтазимдиму – в 50,0% случаев, тикарциллину – в 41,5%, имипенему – в 15,0%, меропенему – в 24,2% [45].
Очень часто у ВИЧ-инфицированных пациентов регистрируют несколько возбудителей пневмоний, например, бактерии в сочетании с вирусами, микобактериями или грибковой микрофлорой что изменяет клиническое течение, рентгенологические показатели и прогноз заболевания.. Нередко встречается туберкулез в сочетании с бактериальной и микотической пневмониями, что увеличивает процент летальных исходов у ВИЧ-инфицированных больных.
В современных условиях заболеваемость пневмониями, очевидно, не может быть полностью устранена, так как всегда возможны изменения физиологического состояния организма и инфицирование органов дыхания микробами, находящимися на слизистых оболочках ротовой полости и дыхательных путей. Однако несомненно, что дальнейшего ее снижения можно добиться, используя уже имеющиеся сведения, в частности, о защитных функциях организма человека, а также в результате дальнейшего изучения этиологии, патогенеза и совершенствования профилактики, особенно у пациентов в период эпидемии ВИЧ-инфекции.


