Острые кишечные инфекции (ОКИ) занимают одно из ведущих мест в структуре инфекционной заболеваемости на планете. Общее число ежегодно регистрируемых в мире случаев ОКИ составляет 250–300 млн. Более половины всех зарегистрированных диарей остаются этиологически не расшифрованными [1–3].
Элементы глобализации (рост миграционных потоков, интенсивное развитие международного туризма, изменение структуры питания и водопотребления, изменения технологий производства, хранения и реализации пищевых продуктов) сопровождаются преобразованием популяции микроорганизмов, изменением вирулентности и резистентности, распространением возбудителей с множественной устойчивостью к антимикробным препаратам [1]. Одним из последствий глобализации является широкое распространение дисбиотических нарушений в кишечнике. Снижение колонизационной резистентности способствует угнетению функций иммунной системы организма, что в свою очередь приводит к увеличению частоты развития хронических заболеваний пищеварительного тракта [4]. Это приводит к смене превалирующих ранее возбудителей ОКИ [5–9]. Условно-патогенные энтеробактерии, присутствующие в качестве комменсалов в составе нормальной микрофлоры людей, в настоящее время рассматриваются как энтеропатогены многих инфекционных диарей [2, 9].
Нередко врачи необоснованно стремятся назначить антибактериальную терапию всем без исключения пациентам c диареей, не принимая во внимание тяжесть состояния больного, спектр возбудителей, приводящих в настоящее время к развитию ОКИ, а именно превалирование условно-патогенной микрофлоры (УПФ) и вирусов в качестве этиологических причин развития заболевания [3, 10]. Кроме того, следует учитывать широко распространенную устойчивость представителей условно-патогенной и патогенной микрофлоры к используемым антибактериальным препаратам [11, 12].
В связи с нарастающей антибиотикорезистентностью бактерий все больше внимания уделяется использованию препаратов, способных оказывать иммуномодулирующий и противовоспалительный эффект на патологический процесс в кишечнике, развивающийся при ОКИ [2, 13, 14]. В ранее проведенных экспериментальных и клинических исследованиях было продемонстрировано позитивное влияние аминодигидрофталазиндиона натрия (АДФNa – галавит®) на состав интестинальной микрофлоры и функциональное состояние кишечника через подавление активности провоспалительных и стимуляцию синтеза противовоспалительных цитокинов [15, 16].
В связи с этим целью нашей работы явилась оценка состояния УПФ при ОКИ у взрослых и эффективности использования АДФNa в составе их комплексной терапии.
Материалы и методы
Под наблюдением находилось 60 пациентов с ОКИ, проходивших стационарное лечение в инфекционном отделении № 5 Городской больницы № 1 им. Н.А. Семашко (Ростов-на-Дону) в 2014–2016 гг. Отбор больных для клинического исследования проводили на основе критериев включения/исключения. Из исследования исключили лиц моложе 18 и старше 60 лет; пациентов с тяжелой соматической патологией, сопутствующими заболеваниями желудочно-кишечного тракта в стадии обострения; лихорадкой свыше 38,5 оС; наличием прожилок или примеси крови в кале; длительностью заболевания более 48 ч; указанием в анамнезе на какую-либо терапию с использованием антибактериальных препаратов и употребление алкогольных напитков в течение 2 недель, предшествующих госпитализации.
Средний возраст больных составил 41,4 ± 5,6 года, распределение по полу было равным. Забор материала из прямой кишки производили в день поступления (1-й день болезни) до начала терапии дакроновыми стерильными зондами-тампонами на пластиковой оси, для чего тампон, медленно вращая вокруг оси, вводили в задний проход на глубину 4–5 см, собирая материал с крипт кишечника. После извлечения тампон погружали в транспортную среду Кери–Блейера и доставляли в бактериологическую лабораторию. Посев кала осуществляли на среды обогащения с дальнейшим высевом на элективные и дифференциально-диагностические питательные среды отечественного производства с последующей идентификацией возбудителя и определением его чувствительности к различным антимикробным препаратам, используя рутинные методами. Проводили также ПЦР-исследование супернатантов кала с использованием наборов «АмплиСенс ОКИ скрин-FL» и «АмплиСенсEnterovirus» («ИнтерЛабСервис», Россия).
Методом рандомизации пациенты были распределены в 2 равные группы по 30 человек в каждой. Пациенты 1-й группы получали стандартную регидратационную терапию. Им также назначали энтеросорбенты, спазмолитики и метоклопрамид (по показаниям) и с 4–5-го дня болезни – пробиотики. Больным 2-й группы с момента поступления в стационар дополнительно к схеме терапии 1-й группы назначали АДФNa по 2 таблетки однократно под язык и далее по 1 таблетке 4 раза в сутки в течение 4–5 дней.
В основном больные обеих групп поступали в стационар в 1-й день болезни. Большинство пациентов как 1-й, так и 2-й группы имели сопутствующие заболевания желудочно-кишечного тракта в стадии ремиссии. В обеих группах превалировала гастроэнтероколитическая форма ОКИ. На момент поступления в стационар пациенты обеих групп оказались сопоставимы по основным клиническим и лабораторным параметрам, что позволило провести дальнейшее сравнительное исследование.
Статистическую обработку полученных данных производили с помощью программы SPSS Statistica V.20.0. В соответствии с характером исследуемых показателей и задачами анализа использовали однофакторный дисперсионный анализ и парный критерий Стьюдента. Полученные различия считали статистически значимыми при p < 0,05.
Результаты и обсуждение
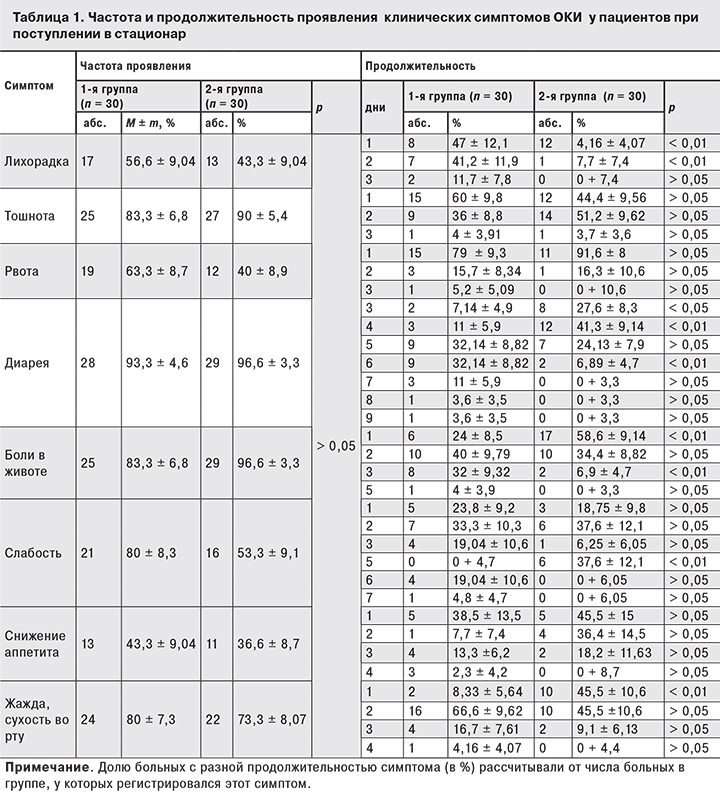
Сравнительный анализ основных клинических проявлений в динамике заболевания выявил следующее. Лихорадка в дебюте заболевания отмечалась у всех пациентов. К моменту госпитализации в стационар (1–2-й день болезни) она сохранялась у 56,6 ± 9,04% больных 1-й группы и у 43,3 ± 9,04% больных 2-й группы (табл. 1). Продолжительность лихорадки у большинства пациентов 1-й группы составляла 2–3 суток, тогда как во 2-й группе у 92,3% пациентов – менее 1 суток. По частоте встречаемости и длительности тошноты и рвоты различий между группами не было. Ключевой симптом ОКИ – диарея – наблюдалась с одинаковой частотой в обеих группах (93,3 и 96,6% соответственно), но во 2-й группе доля пациентов, у которых продолжительность диареи сократилась до 3–4 дней, была существенно выше. У 64,3% больных 1-й группы диарея продолжалась 5–6 дней, а у 7,2% – более 7 дней. Продолжительность схваткообразных болей в животе практически соответствовала длительности диареи в обеих группах. Симптомы астении (общая слабость, снижение аппетита), жажду и сухость во рту отмечали большинство больных, однако во 2-й группе они носили менее затяжной характер. Изменения воспалительного характера в общем анализе крови исчезали к концу терапии у подавляющего большинства пациентов 1-й группы и у всех больных 2-й группы.
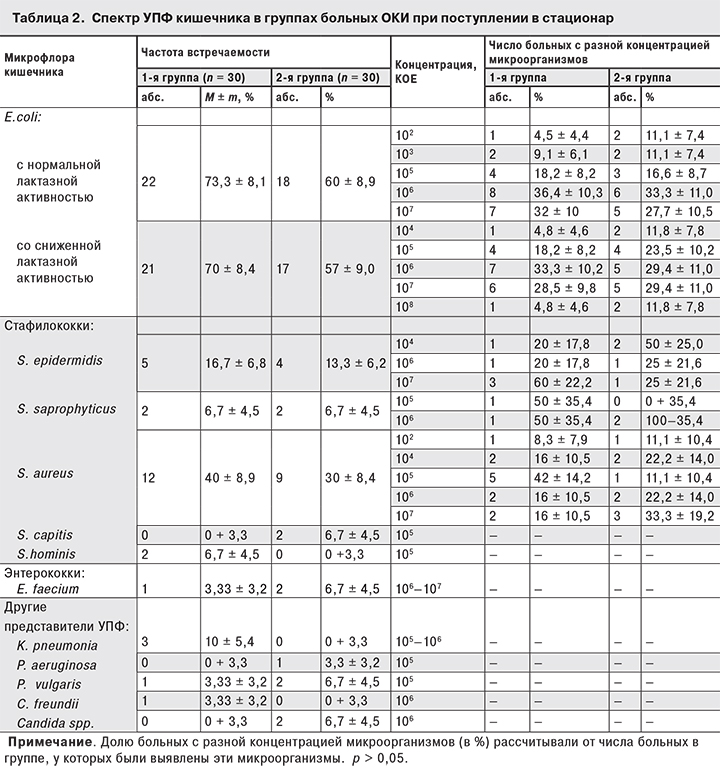
У больных обеих групп при бактериологическом исследовании ректальных мазков в разгаре болезни выявлялись представители только УПФ (табл. 2). Патогенная флора, ротовирусы, вирус Норуолок и астравирусы выявлены не были. В 100% случаев основу микробного пейзажа составляла E. coli с нормальной и/или сниженной лактазной активностью в ассоциации с другими микроорганизмами. Чаще всего наблюдались ассоциации с S. aureus, S. epidermidis, S. capitis, S. epidermidis и S. hominis. Несколько реже E. coli обнаруживали совместно с Citrobacter freundii, Proteus vulgaris, Pseudomonas aeruginosa. В единичных случаях наблюдалась ассоциация с дрожжевыми грибами рода Candida. У всех больных при бактериологическом исследовании кала идентифицировали как минимум 2 микроорганизма, в 20% случаев отмечалась ассоциация трех микроорганизмов, в 40% – четырех. Во многих случаях повысилась концентрация E. coli со сниженной лактазной активностью до 106–108 КОЕ на фоне снижения репрезентативности E. coli с нормальной лактазной активностью, появление S. aureus в концентрации от 102 до 107 КОЕ. У отдельных больных в обеих группах было отмечено повышение концентрации S. saprophyticus, K. pneumonia, P. vulgaris, Citrobacter freundii, дрожжевых грибов рода Candida до 105–106 КОЕ. Достоверных различий в качественном и количественном составе основной УПФ толстого кишечника в группах в разгаре болезни не выявлено.
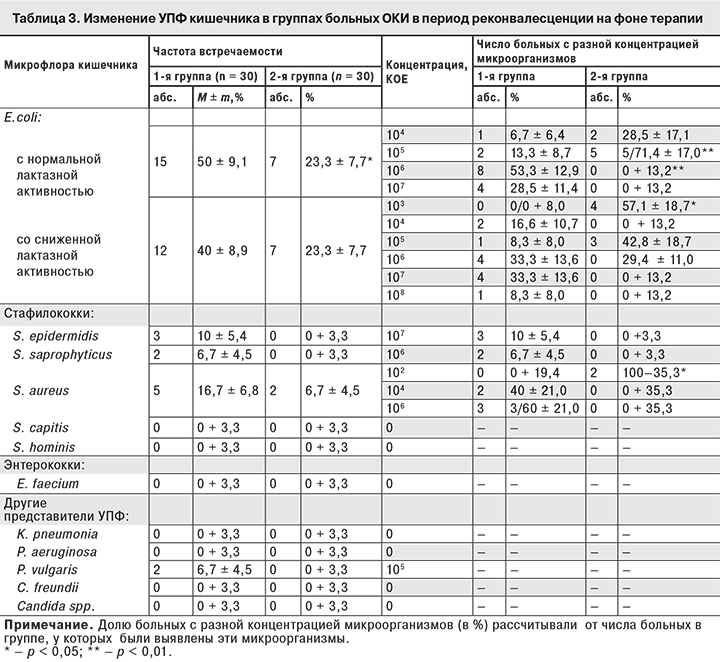
Поскольку в начале исследования в разгаре болезни микробный пейзаж у пациентов в обеих группах был схожим, стало возможно объективно оценить влияние на процесс реконвалесценции АДФNa, добавленного к стандартной схеме терапии ОКИ во 2-й группе. У больных 2-й группы нарушения качественного и количественного состава микрофлоры кишечника в период реконвалесценции были значительно менее выражены, и микробный пейзаж практически приблизился к норме. Об этом свидетельствует достоверное снижение частоты встречаемости и количества E. coli cо сниженной и нормальной лактазной активностью, количества S. aureus, исчезновение S. epidermidis и S. saprophyticus и P. vulgaris (табл. 3).
У больных обеих групп в разгаре болезни установлен высокий уровень устойчивости выделенных микроорганизмов к широко используемым антибиотикам (см. рисунок). Так, устойчивость кишечной микрофлоры к цефалоспоринам I, II и III поколения, хлорамфениколу, макролидам, тетрациклинам, пенициллинам, фторхинолонам отмечена более чем у 83% больных; к аминогликозидам – у 73,3% больных 1-й группы и у 80,0% больных 2-й группы, к карбапенемам – у 60,0 и 73,3% больных соответственно. Достоверных различий чувствительности микрофлоры кишечника к антимикробным препаратам у пациентов 1-й и 2-й групп в разгаре болезни не выявлено.
При оценке резистентности микрофлоры кишечника к отдельным группам антибактериальных препаратов в периоде реконвалесценции были выявлены существенные различия. Так, у пациентов 2-й группы по сравнению с пациентами 1-й группы установлено статистически значимое (более чем в 2 раза) снижение уровня устойчивости микрофлоры к пенициллинам, цефалоспоринам I, II и III поколения, являющимся антибактериальными препаратами первой линии, а также к фторхинолонам.

В результате проведенного исследования ни у одного больного ОКИ не обнаружены патогенные микроорганизмы и основные возбудители вирусных диарей. Между тем наличие воспалительных изменений в общем анализе крови у всех пациентов в разгаре болезни с последующей их регрессией в динамике заболевания у подавляющего большинства пациентов свидетельствовали о том, что наиболее вероятной причиной диареи была ассоциация разных представителей УПФ. По всей видимости, благоприятным фоном для развития заболевания являлись дисбиотические изменения в кишечнике и снижение колонизационной резистентности интестинальной микрофлоры, приводящие к угнетению местной неспецифической антиинфекционной резистентности. Исследование чувствительности микрофлоры кишечника к антибактериальным препаратам выявило высокий уровень устойчивости идентифицированной микрофлоры практически ко всем классам антибактериальных препаратов, используемых в качестве стартовой терапии.
Несмотря на то, что пациенты не получали антибиотики до поступления в стационар, изменения качественного и количественного состава микрофлоры кишечника в разгаре болезни соответствовали дисбиотическим изменениям резидентной микрофлоры на фоне антибактериальной терапии, наблюдаемым другими авторами [17–19]. В частности, Е.В. Голошва [18] установила повышение в составе нормальной микрофлоры количества эшерихий со сниженной ферментативной активностью и условно-патогенных микроорганизмов, особенно протея и гемолитических эшерихий. Таким образом, при ОКИ происходят изменения состава интестинальной микрофлоры, соответствующие ее дисбиотическим сдвигам на фоне антибактериальной терапии.
По всей вероятности, этим и объясняется тот факт, что микроорганизмы, выделенные у больных ОКИ в нашем исследовании, демонстрировали высокую устойчивость к антибактериальным препаратам, несмотря на то, что они не были включены в схемы лечения ОКИ.
Одними из основных неспецифических факторов противоинфекционной защиты являются фагоцитарная активность местных макрофагов, лизоцим, интерфероны [20]. Тотальная устойчивость к антимикробным препаратам, нарушения качественного и количественного состава микрофлоры кишечника, приводящие к снижению резистентности местного иммунитета, – все это указывает на целесообразность использования препаратов с иммуномодулирующими и противовоспалительными свойствами в терапии ОКИ. К их числу относится АДФNa. В проведенных ранее исследованиях [15, 16] была доказана его способность повышать функциональную активность макрофагов, синтез интерферонов и лизоцима, регулировать баланс про- и противовоспалительных цитокинов. Проведенное нами исследование убедительно продемонстрировало положительное влияние этого препарата на динамику нивелирования основных клинических проявлений заболевания и восстановление биоценоза кишечника. Но наиболее ценным результатом, на наш взгляд, явилось снижение резистентности микрофлоры кишечника к антибактериальным препаратам, наиболее часто используемым в качестве стартовой терапии. Вероятно, это обусловлено способностью АДФNa активировать вышеуказанные факторы местной неспецифической резистентности кишечника, в частности, усиливать макрофагальный фагоцитоз. Приведенные выше доводы позволяют рекомендовать включение АДФNa в состав комплексной терапии ОКИ.
Выводы
- В настоящее время доминирующей причиной развития ОКИ у взрослых являются различные ассоциации УПФ, основу которых составляет E. cоli.
- Условно-патогенные микроорганизмы желудочно-кишечного тракта в 68–90% случаев обладают устойчивостью к антимикробным препаратам, используемым в качестве стартовой терапии заболеваний, ассоциированных с инфекционными агентами.
- Выявленные дисбиотические изменения в кишечнике, присутствующие у всех без исключения больных ОКИ, свидетельствуют о нецелесообразности использования в комплексной терапии антибактериальных средств, усугубляющих нарушения микрофлоры и снижающих местный иммунитет кишечника.
- Использование иммуномодулятора АДФNa дополнительно к стандартным схемам лечения ОКИ способствует сокращению основных клинических проявлений заболевания (диареи, лихорадки, интоксикации) и восстановлению нормального состава микробного пейзажа кишечника, что позволяет рекомендовать включение его в состав комплексной терапии ОКИ.
- АДФNa оказывает положительное влияние на микробиоту кишечника, снижая резистентность микроорганизмов к пенициллинам, цефалоспоринам I, II и III поколения, делает целесообразным его совместное применение с указанными классами антибиотиков для усиления терапевтического эффекта.


