Инфекция вирусом гепатита В (ВГВ) считается одной из самых распространенных в мире. Более 2 млрд людей имели контакт с вирусом, и более 350 млн человек стали хроническими носителями вируса и группой риска прогрессирования болезни печени и развития цирроза и гепатоцеллюлярной карциномы (ГЦК) [1–3]. Подавляющее большинство носителей ВГВ сконцентрировано в Юго-Восточной Азии, где доминирует вертикальный путь передачи вируса, что способствует хронизации инфекции, так как у детей хронические формы инфекции ВГВ развиваются приблизительно в 90% случаев. И наоборот, инфицирование ВГВ во взрослом возрасте более чем в 90% случаев заканчивается полным выздоровлением и формированием стойкого пожизненного иммунитета к данной инфекции. Однако во взрослой популяции существуют дополнительные факторы, которые приводят к более высокой частоте развития хронического заболевания печени, и один из них – наличие сопутствующей ВИЧ-инфекции. По данным различных исследований, частота хронической инфекции ВГВ у ВИЧ-позитивных пациентов составляет 10–15% случаев [4, 5].
ВИЧ-инфекция также усугубляет естественное течение хронического гепатита В (ХГB): на ее фоне усиливается репликация ВГВ, быстрее развиваются фибротические процессы, и формируется цирроз с дальнейшей декомпенсацией функции печени [4, 6]. Кроме того, частота развития ГЦК в популяции больных гепатитом В с ВИЧ-инфекцией значимо выше, чем в популяции пациентов с гепатитом В без ВИЧ-инфекции [5, 7].
В многоцентровом когортном исследовании MACS риск смерти от поражения печени у больных с сочетанной инфекцией был в 8 раз выше, чем у ВИЧ-инфицированных, не зараженных ВГВ, и был особенно высоким у больных с низким количеством CD4+-лимфоцитов [8].
 Все это свидетельствует о необходимости особого подхода к ведению пациентов с сочетанной инфекцией ВИЧ/ВГВ и выбору оптимального режима терапии обеих инфекций. При ВИЧ/ВГВ существует несколько факторов, влияющих на сроки начала и выбор режима лечения как ВИЧ-инфекции, так и гепатита В.
Все это свидетельствует о необходимости особого подхода к ведению пациентов с сочетанной инфекцией ВИЧ/ВГВ и выбору оптимального режима терапии обеих инфекций. При ВИЧ/ВГВ существует несколько факторов, влияющих на сроки начала и выбор режима лечения как ВИЧ-инфекции, так и гепатита В.
В соответствии с международными и российскими рекомендациями, терапию ВИЧ-инфекции следует начинать в зависимости от количества CD4+-лимфоцитов. Как в российских, так и международных рекомендациях пороговое значение для безусловного начала антиретровирусной терапии (АРТ) составляет менее 350 клеток/мкл. Однако при наличии ХГВ терапию ВИЧ-инфекции следует начинать как можно быстрее, вне зависимости от иммунного статуса [9, 10].
В ряде случаев, когда количество CD4+-лимоцитов превышает 500 клеток/мкл и пациент не готов к началу АРТ, но при этом есть показания к лечению ХГВ, можно рассмотреть возможность терапии ХГВ пегилированным интерфероном альфа (ПегИФН-а). Однако существует ряд ограничений в применении этой терапии, включая неблагоприятный профиль переносимости и снижение эффективности при наличии высокой концентрации вируса в крови, низкой активности трансаминаз, отсутствии HBeAg [11, 12], а также при ВГВ генотипа D, который доминирует в популяции российских пациентов [13]. В качестве альтернативы также может быть предложен препарат телбивудин, однако его эффективность и профиль резистентности уступают другим нуклеоз(т)идным аналогам, таким как тенофовир (TDF) и энтекавир [14].
Назначение для лечения ХГВ монотерапии TDF, энтекавиром или ламивудином (3TC) при сопутствующей ВИЧ-инфекции неприемлемо, так как это приведет к быстрой селекции мутаций устойчивости ВИЧ к нуклеоз(т)идным ингибиторам обратной транскриптазы ВИЧ (НИОТ) и существенному ограничению в выборе будущих режимов АРТ [15].
Таким образом, для пациентов с сочетанной инфекцией ВИЧ/ВГВ оптимально более раннее начало АРТ, в состав которой входят НИОТ, также активные в отношении ДНК-полимеразы ВГВ [TDF в комбинации с эмтрицитабином (FTC) или 3TC] .
 В России долгое время TDF был недоступен для включения в режимы первой линии АРТ, и выбор НИОТ ограничивался тимидиновыми аналогами (чаще азидотимидин – AZT) или абакавиром (ABC) в комбинации с 3TC. Принимая во внимание отсутствие активности у этих препаратов в отношении ВГВ и низкий барьер резистентности у 3TC, у пациентов, получающих такие режимы АРТ, можно ожидать быстрое развитие устойчивости ВГВ к 3TC и возобновление его активной репликации с быстрым прогрессированием заболевания печени [16]. В таких ситуациях к режиму АРТ возможно добавление энтекавира в дозе 1 мг в сутки [9]. Учитывая все рекомендации по тактике лечения пациентов с сочетанной инфекцией ВИЧ/ВГВ и специфику доступности антиретровирусных препаратов в России, нами было принято решение провести фармакоэкономический анализ применения различных схем АРТ и выявить наиболее экономически оптимальную, что в свою очередь обеспечит сокращение затрат на лечение данной группы больных.
В России долгое время TDF был недоступен для включения в режимы первой линии АРТ, и выбор НИОТ ограничивался тимидиновыми аналогами (чаще азидотимидин – AZT) или абакавиром (ABC) в комбинации с 3TC. Принимая во внимание отсутствие активности у этих препаратов в отношении ВГВ и низкий барьер резистентности у 3TC, у пациентов, получающих такие режимы АРТ, можно ожидать быстрое развитие устойчивости ВГВ к 3TC и возобновление его активной репликации с быстрым прогрессированием заболевания печени [16]. В таких ситуациях к режиму АРТ возможно добавление энтекавира в дозе 1 мг в сутки [9]. Учитывая все рекомендации по тактике лечения пациентов с сочетанной инфекцией ВИЧ/ВГВ и специфику доступности антиретровирусных препаратов в России, нами было принято решение провести фармакоэкономический анализ применения различных схем АРТ и выявить наиболее экономически оптимальную, что в свою очередь обеспечит сокращение затрат на лечение данной группы больных.
Целью настоящего исследования стало изучение экономической эффективности фиксированной комбинации доз TDF/FTC в сравнении с фиксированными комбинациями доз ABC/3TC и AZT/3TC, у пациентов с сочетанной инфекцией ВИЧ/ ВГВ.
Дизайн исследования – моделирование.
Материалы и методы
Для проведения фармакоэкономического исследования за основу были взяты «Протоколы диспансерного наблюдения и лечения больных ВИЧ-инфекцией» [9], «Клинические рекомендации Российской гастроэнтерологической ассоциации Российского общества по изучению печени по диагностике и лечению взрослых больных гепатитом В» [17], а также «Клинические рекомендации Европейской ассоциации по изучению болезней печени: лечение хронического гепатита В»[18]. Данные рекомендации позволили создать модель ведения пациентов с сочетанной инфекцией ВИЧ/ВГВ в пятилетнем горизонте на базе программного обеспечения Microsoft Excel.
Мы сравнивали прямые медицинские затраты на терапию двух гипотетических когорт пациентов (100 человек) с ВИЧ/ВГВ в пятилетнем временном горизонте. Принято допущение, что в обеих когортах пациенты ранее не получали лечения и нуждались в назначении первой линии АРТ согласно современным протоколам и клиническим рекомендациям. Также в обеих когортах у пациентов не были выявлены причины и состояния, при которых необходимо было бы назначить альтернативные схемы первой линии АРТ.
Таким образом, первая когорта пациентов в модели получала схему TDF/FTC + эфавиренз (EFV), вторая – схемы AZT/3TC + EFV и ABC/3TC + EFV в соотношении 50:50. В модели предполагается, что все пациенты, у которых развилась резистентность ВГВ к АРТ, будут переведены на схемы AZT/3TC + EFV + энтекавир и ABC/3TC + EFV + энтекавир. Данная последовательность режимов терапии соответствует современным клиническим рекомендациям, а также является широко распространенной в отечественной клинической практике.
Для оценки данных о клинической эффективности и безопасности режимов, используемых в модели, нами были изучены российские и зарубежные рекомендации по лечению инфекций, вызванных ВИЧ и ВГВ.
Экономическая оценка лечения пациентов с сочетанной инфекцией ВИЧ/ВГВ включала в себя оценку следующих видов затрат:
- на препараты для проведения АРТ:
- фиксированная комбинация доз TDF/FTC + EFV (300 + 200 мг 1 раз в сутки + 600 мг 1 раз в сутки);
- фиксированная комбинация доз ABC/3TC + EFV (600 + 300 мг 1 раз в сутки + 600 мг 1 раз в сутки);
- фиксированная комбинация доз AZT/3TC + EFV (300 + 150 мг 2 раза в сутки + 600 мг 1 раз в сутки);
- на препараты для проведения АРТ в случае развития резистентности к терапии первой линии:
-
- фиксированная комбинация доз ABC/3TC + EFV + энтекавир (600 + 300 мг 1 раз в сутки + 600 мг 1 раз в сутки + 1 мг 1 раз в сутки);
- фиксированная комбинация доз AZT/3TC + EFV + энтекавир (300 + 150 мг 2 раза в сутки + 600 мг 1 раз в сутки + 1 мг 1 раз в сутки);
- на медицинское обследование перед назначением АРТ и диспансерное наблюдение в процессе лечения, в том числе консультации специалистов, лабораторные и инструментальные методы исследования.
 Для оценки затрат на препараты ABC/3TC, AZT/3TC, EFV и энтекавир в модели были использованы зарегистрированные предельные отпускные цены на лекарственные препараты, полученные из базы данных Государственного реестра лекарственных средств с предельной оптовой надбавкой и НДС (все перечисленные препараты включены в перечень жизненно необходимых и важнейших лекарственных препаратов – ЖНВЛП). Поскольку фиксированная комбинация доз TDF/FTC не включена в данный перечень, в расчетах была использована ориентировочная предельная стоимость упаковки в 30 таблеток, указываемая компанией-производителем в случае включения препарата в перечень ЖНВЛП.
Для оценки затрат на препараты ABC/3TC, AZT/3TC, EFV и энтекавир в модели были использованы зарегистрированные предельные отпускные цены на лекарственные препараты, полученные из базы данных Государственного реестра лекарственных средств с предельной оптовой надбавкой и НДС (все перечисленные препараты включены в перечень жизненно необходимых и важнейших лекарственных препаратов – ЖНВЛП). Поскольку фиксированная комбинация доз TDF/FTC не включена в данный перечень, в расчетах была использована ориентировочная предельная стоимость упаковки в 30 таблеток, указываемая компанией-производителем в случае включения препарата в перечень ЖНВЛП.
Перечень необходимых медицинских услуг и их кратность были определены, исходя из «Протоколов диспансерного наблюдения и лечения больных ВИЧ-инфекцией» [9] и «Клинических рекомендаций Российской гастроэнтерологической ассоциации Российского общества по изучению печени по диагностике и лечению взрослых больных гепатитом В» [17], а также «Клинических рекомендаций Европейской ассоциации по изучению болезней печени: лечение хронического гепатита В» [18]. Для расчета затрат на медицинские услуги, предоставляемые только женщинам (например, консультация гинеколога), нами был использован коэффициент 0,5, так как мы исходили из предположения, что женщины составляют 50% каждой когорты.
Затраты на медицинские услуги определяли на основании тарифов, принятых Фондом обязательного медицинского страхования в 2014 г. (по Москве) с учетом поправочного коэффициента на бюджетную составляющую, равного 1,46.
Результаты и обсуждение
Для моделирования нами были использованы данные, полученные из статьи J.M. Pawlotsky и соавт. [19], в которой проводился анализ развития резистентности к разным схемам терапии ХГВ. Авторы ставили своей целью подробное изучение и описание вирусологических маркеров и тестов, а также возможность их оптимального использования как при проведении клинических исследований, так и в реальной практике. Результаты анализа резистентности, развивающейся на фоне применения 3ТС и TDF в лечении ХГВ, представлены в табл. 1.
В модели было принято допущение, что все пациенты, получающие лечение комбинацией препаратов, содержащей 3ТС, с развивающейся резистентностью в течение n-го года, на следующий год начинают получать энтекавир в дополнение к существующей схеме АРТ. Поскольку резистентность к TDF не выявлена, все пациенты, получающие фиксированную комбинацию доз TDF/FTC, продолжают лечение неизменно на протяжениеи 5 лет.
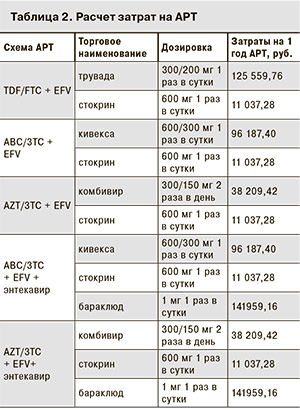
Затраты на АРТ в модели представлены в табл. 2.
Результаты расчета прямых медицинских затрат в модели в пятилетнем временном горизонте представлены в табл. 3.
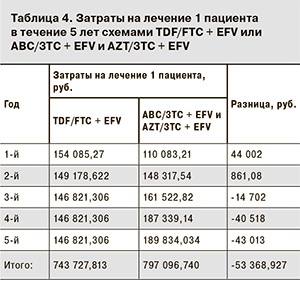 Нами были вычислены ожидаемые средние прямые медицинские затраты на 1 пациента (табл. 4). Было выявлено, что назначение фиксированных комбинаций доз, содержащих 3ТС, в пятилетнем горизонте обходится на 53 400 руб. (или на 7%) дороже, чем исходное назначение TDF/FTC.
Нами были вычислены ожидаемые средние прямые медицинские затраты на 1 пациента (табл. 4). Было выявлено, что назначение фиксированных комбинаций доз, содержащих 3ТС, в пятилетнем горизонте обходится на 53 400 руб. (или на 7%) дороже, чем исходное назначение TDF/FTC.
Таким образом, кажущаяся доступность терапии фиксированными комбинациями доз, содержащими 3ТС, с течением времени нивелируется. В модели увеличение затрат происходит уже на 2-й год за счет дополнительного назначения энтекавира пациентам, у которых развивается резистентность к первой линии АРТ. Поскольку с каждым годом доля таких пациентов неуклонно возрастает, пропорционально увеличиваются и медицинские затраты.
В построенной нами модели доказана клиническая и экономическая эффективность фиксированной комбинации доз TDF/FTC в сравнении с комбинациями, содержащими 3ТС, при лечении пациентов с сочетанной инфекцией ВИЧ/ВГВ.
Необходимо отметить, что данная модель имеет ряд допущений. Например, когорта пациентов, получающих режимы, содержащие 3ТС и сформированные из двух фиксированных комбинаций доз. В реальной практике часто невозможно назначение оригинального многокомпонентного препарата, и приходится прибегать к его замене на более доступные комбинации монопрепаратов. В качестве третьего агента в модели использовался только EFV, что также не полностью соответствует общепринятой клинической практике. Такой вариант может быть рассмотрен в дальнейших исследованиях.
Также нами не учитывались затраты на устранение побочных эффектов, возникающих при проведении АРТ. Чтобы получить более полную картину профиля затрат, связанных с безопасностью и переносимостью АРТ, мы провели поиск фармакоэкономических исследований, оценивающих подобные параметры. Не было найдено ни одного исследования, изучающего экономическую эффективность TDF/FTC у пациентов с сочетанной инфекцией ВИЧ/ВГВ. Мы расширили поиск до исследований, включающих только пациентов с ВИЧ, без сопутствующей инфекции ВГВ. Так, в работе R. Sanchez-de la Rosa и соавт. [20] сравнивали экономическую эффективность TDF/FTC и AZT/3TC в комбинации с EFV у пациентов с ВИЧ- 1, ранее не получавших АРТ. Авторы учитывали прямые медицинские затраты на проведение АРТ, на терапию побочных эффектов, а также непрямые затраты. Были использованы данные об эффективности каждого из препаратов, полученные в открытом рандомизированном исследовании GS-934. Вирусологического ответа после 96 недель терапии удалось добиться у 75% пациентов, получавших TDF/FTC + EFV, и у 62% пациентов, получавших AZT/3TC + EFV (р = 0,004). Частота возникновения побочных эффектов в группах составила 5 и 12% соответственно. Затраты на лечение пациентов, получавших режим TDF/FTC + EFV, составили 3 484 800 руб.1 , в то время как затраты на АРТ с режимом AZT/3TC + EFV составили 4 214 850 руб. на 1 пациента. Таким образом, экономия составила 730 050 руб. на 1 пациента, получающего TDF/FTC + EFV, за счет увеличения затрат на терапию побочных эффектов, а также непрямых затрат в когорте AZT/3TC + EFV. Отношение «затраты/эффективность» в исследовании составило 46 464 и 67 981 руб. для TDF/FTC + EFV и AZT/3TC + EFV соответственнно. Учитывая высокую клиническую эффективность препарата, авторы делают вывод, что комбинация TDF/FTC + EFV может рассматриваться в качестве доминантной стратегии терапии у пациентов с ВИЧ-1, ранее не получавших лечения.
Следует отметить, что назначение фиксированной комбинации доз TDF/FTC является оправданным не только с точки зрения клинической и экономической эффективности. Неоднократно было показано [21, 22], что применение именно фиксированных комбинаций доз способно повысить успешность терапии, так как они позволяют повысить приверженность пациентов к лечению.
Выводы
- Согласно современным отечественным и зарубежным протоколам лечения и клиническим рекомендациям, фиксированная комбинация доз TDF/FTC является препаратом выбора для первой линии АРТ у пациентов с сочетанной инфекцией ВИЧ/ВГВ.
- Использование данного препарата является экономически выгодным в условиях отечественной клинической практики лечения пациентов с сочетанной инфекцией ВИЧ/ВГВ. В пятилетнем временном горизонте назначение фиксированных комбинаций доз, содержащих 3ТС, обходится на 53 400 руб. (или на 7%) дороже, чем исходное назначение TDF/FTC.
_______________
1) Все расчеты в исследовании переведены из евро в рубли по курсу ЦБ на 05.02.2015.


