В современном мире сердечно-сосудистые заболевания (ССЗ) являются ведущей причиной смертности населения. В то же время доказано, что существуют гендерные особенности их развития. У женщин эстрогены оказывают протективное действие на сердечно-сосудистую систему благодаря биологическим механизмам регуляции активности клеток эндотелия и миоциотов [1]. Известно, что рецепторы к эстрогенам экспрессируются как миокардом, так и эндотелием, позволяя им воздействовать на сердечно-сосудистую систему, предупреждая развитие атеросклероза и снижая сердечно-сосудистый риск. В то же время экспрессия эстрогеновых рецепторов снижается с возрастом и в поздней менопаузе (через 10 лет после её наступления), а влияние эстрогенов на развитие сердечно-сосудистой патологии нивелируется [2]. Важность роли эстрогеновых рецепторов на развитие ССЗ подтверждается тем фактом, что у женщин со сниженной экспрессией эстрогеновых рецепторов отмечается раннее развитие атеросклероза [3]. Также эстрогены влияют на выделение эндотелий-релаксирующего фактора монооксида азота, приводя таким образом напрямую к вазодилятации и косвенно снижая тромбогенность и провоспалительный статус, препятствуя агрегации тромбоцитов и пролиферации гладкомышечных клеток [4].
Помимо прямого влияния эстрогенов на сердечно-сосудистую систему важную роль играет системное воздействие на факторы риска. Известно, что у женщин по сравнению с мужчинами ниже уровень общего холестерина (ОХС), липопротеидов низкой (ЛПНП) и очень низкой плотности (ЛПОНП) и триглицеридов (ТГ) и выше уровень липопротеидов высокой плотности (ЛПВП). Причём степень влияния эстрогенов на разные фракции липидного профиля неодинакова. Уровень ОХС и ЛПНП ниже на 5–15%, ТГ – на 20–25%, ЛПВП – выше на 10% [5, 6]. Эта разница начинает наиболее ярко проявляться после полового созревания и нивелируется после достижения женщинами 70-летнего возраста и мужчинами – 60-летнего [7]. Эстрогены оказывают также воздействие на систему гемостаза. Имеются данные о том, что у женщин в постменопаузе выше уровень фактора Виллебранда, фибриногена и VII фактора [8]. Кроме того, показано влияние эстрогенов на хроническое воспаление. Было продемонстрировано, что у женщин в постменопаузе уровень С-реактивного белка (СРБ) и интерлейкина-6 (ИЛ-6) выше, чем в пременопаузе [9, 10].
В связи с этим очевидно, что в общей популяции риск развития ССЗ у мужчин выше, чем у женщин. В последние годы, учитывая широкую распространённость ВИЧ-инфекции (более 34 млн человек во всем мире), значимое увеличение продолжительности жизни в данной субпопуляции (при уровне CD4+-лимфоцитов более 400 клеток/мкл продолжительность жизни равна среднепопуляционной [11]), широкую распространённость ССЗ среди ВИЧ-инфицированных и общепризнанность ВИЧ-инфекции в качестве независимого фактора риска [12], актуальной стала оценка роли гендерного фактора в данной субпопуляции. Имеются данные, что в субпопуляции ВИЧ-позитивных пациентов сохраняются гендерные различия по риску развития ССЗ и, как и в общей популяции, риск этот выше у мужчин. Так, в исследовании, которое включало 931 мужчину и 1455 женщин с ВИЧ-инфекцией, получающих антиретровирусную терапию (АРВТ), было показано, что к группе высокого риска развития ССЗ относятся 17% мужчин и 12% женщин (по Фрамингемской шкале) [13]. В ходе исследования, включавшего 1033 ВИЧ-инфицированных в возрасте от 17 до 70 лет (82,7% получали АРВТ), было показано, что риск развития ССЗ у мужчин на 25,9% выше, чем у с женщин [14]. Более того, в ходе исследования D:A:D была показана протективная роль женского пола в развитии ССЗ. В ходе исследования FRAM также была показана роль гендерного фактора в развитии ССЗ. У мужчин дополнительный риск составил 12,7%.
Несмотря на изучение вопросов гендерных различий среди ВИЧ-инфицированных пациентов, на сегодняшний день недостаточно информации о различиях в факторах риска между ВИЧ-позитивными мужчинами и женщинами. Таким образом, целью нашего исследования явилась оценка гедерных различий традиционных факторов риска и маркёров воспаления, относящихся к так называемым новым предикторам риска развития ССЗ, у ВИЧ-инфицированых пациентов в отсутствие АРВТ.
Материалы и методы
В ходе проведенного исследования был обследован 21 пациент с ВИЧ-инфекцией 3 стадии заболевания в возрасте от 25 до 40 лет (средний возраст 31,95 ± 0,84 года) без сопутствующих хронических заболеваний, со средним уровнем CD4+-лимфоцитов 399,05 ± 159,47 клеток/мл, с длительностью течения ВИЧ-инфекции не более 5 лет, не получающих АРВТ (основная группа). В этой группе курящие составляли 53%. В контрольную группу вошли 39 пациентов (средний возраст 32,08 ± 0,84 года) без сопутствующих хронических заболеваний, из них курящие – 33%. Полученные данные обрабатывались при помощи программы STATISTICA 8. Данные представлены в виде М ± m.
У всех пациентов определяли уровень ОХС, ЛПНП, ЛПОНП, ЛПВП, ТГ, апопротеина В (АПО-В), глюкозы, а также маркёров воспаления [фактора некроза опухоли α (ФНО-α), интерлейкина-12 (ИЛ-12) и интерлейкина-18 (ИЛ-18)]. Содержание ОХС, ЛПНП, ЛПОНП, ЛПВП, ТГ, АПО-В и глюкозы определяли в плазме крови на автоматическом биохимическом анализаторе Architect ci8200. Уровень инсулина определяли на автоматическом биохимическом анализаторе Immulite 2000. Уровень ФНО-α, ИЛ-12 и ИЛ-18 определяли методом иммуноферментного анализа с использованием стандартных планшет.
Результаты и обсуждение
В результате проведенного исследования было выявлено, что в основной группе уровень ОХС, ЛПНП и ЛПВП у женщин выше, чем у мужчин, в то время как в контрольной группе значимых различий между показателями у мужчин и женщин не наблюдалось. Уровень ЛПОНП и ТГ был выше у мужчин, чем у женщин в обеих группах. Уровень АПО-В существенно не различался у мужчин и женщин в обеих группах. По уровню глюкозы не было выявлено значимых различий между показателями в двух группах. В то же время была выявлена разница по уровню инсулина между ВИЧ-инфицированными мужчинами и женщинами, а разницы в уровнях инсулина среди мужчин и женщин в контрольной группе не выявлено (табл. 1). При сравнении показателей липидного профиля у мужчин и женщин в обеих группах было выявлено, что уровень ОХС, ЛПНП и ЛПВП достоверно ниже у мужчин в основной группе по сравнению с контрольной, в то время как между показателями у женщин в обеих группах значимых различий выявлено не было.
При гендерном анализе маркёров воспаления было выявлено, что более высокий уровень ФНО-α отмечался у женщин в сравнении с мужчинами как в основной, так и в контрольной группе. Уровень ИЛ-18 в основной группе был выше у мужчин в сравнении с женщинами, в то время как в контрольной группе по уровню ИЛ-18 значимых различий между мужчинами и женщинами не отмечалось. Уровень же ИЛ-12 в обеих группах был выше у мужчин, чем у женщин (табл. 2). При сравнении уровней маркёров воспаления у мужчин и женщин была выявлена достоверная разница уровней ФНО-α как между мужчинами в основной и контрольной группах, так и между женщинами в обеих группах.
В настоящее время многочисленные исследования подтверждают повышенный риск развития сердечно-сосудистой патологии у ВИЧ-инфицированных пациентов. Большое значение для раннего развития ССЗ у ВИЧ-инфицированных придают факторам риска как традиционным, так и специфическим для данной субпопуляции. Известно, что такие значимые традиционные факторы риска, как курение, дислипидемия и артериальная гипертензия более широко распространены среди ВИЧ-инфицированных по сравнению с общей популяцией [11]. Для ВИЧ-инфицированных характерно специфическое изменение липидного профиля, такое как снижение уровня как ЛПВП, так и ЛПНП [15], повышение уровня ТГ. Более того, выявлено, что у ВИЧ-инфицированных пациентов среди ЛПНП преобладают более атерогенные мелкие, плотные частицы [7]. У этих пациентов при наличии такого самостоятельного фактора риска, как ВИЧ, развиваются провоспалительные сдвиги, которые приводят к раннему развитию атеросклероза. Имеются данные о более высоком уровне СРБ у ВИЧ-инфицированных по сравнению с общей популяцией. Кроме того, имеются предположения, что ВИЧ сам по себе способен влиять на сосудистую стенку, приводя к развитию атеросклероза.
В то же время в ходе исследований, проведенных у ВИЧ-инфицированных пациентов, получающих АРВТ, был выявлен более низкий риск развития ССЗ у женщин по сравнению с мужчинами. Предположительно это связывают с протективным действием эстрогенов на развитие ССЗ, но по какой именно причине сохраняется протективная роль женского пола на фоне проатерогенного действия АРВТ, до сих пор неясно. К сожалению, во всех проведенных на данный момент исследованиях имеются данные только о роли протекции женского пола на фоне АРВТ, более того, нет данных о выраженности факторов риска у этих пациентов до начала АРВТ. Вероятно, более низкий риск развития ССЗ у женщин на фоне приёма АРВТ связан с меньшими изменениями в липидном, углеводном и провоспалительном фоне у ВИЧ-инфицированных женщин по сравнению с мужчинами изначально. В то же время нельзя исключить возможность противодействия эстрогенного фона влиянию АРВТ на метаболический профиль. Целью проведенного нами исследования было изучение липидного, углеводного и провоспалительного профиля у ВИЧ-инфицированных пациентов обоих полов с естественным течением ВИЧ-инфекции и сохранной функцией иммунной системы для оценки базовых гендерных различий по факторам риска развития ССЗ.
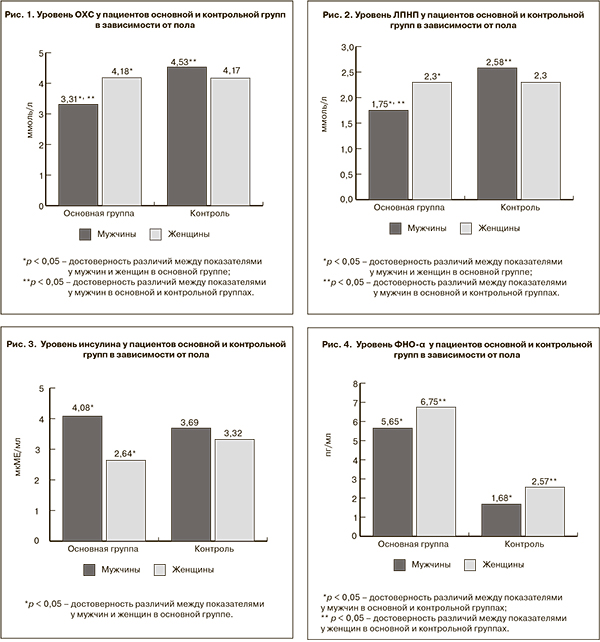
В ходе исследования были выявлены различия в липидном профиле у ВИЧ-инфицированных пациентов мужского и женского пола. Уровень ОХС и ЛПНП оказался выше у ВИЧ-позитивных женщин по сравнению с мужчинами. Достоверных различий по уровню ОХС и ЛПНП между женщинами основной и контрольной групп выявлено не было, в то время как у ВИЧ-позитивных мужчин уровень ОХС и ЛПНП был достоверно ниже, чем в контрольной группе (рис. 1, 2).
Уровень ЛПВП у ВИЧ-позитивных женщин по сравнению с мужчинами оказался выше, а уровень ТГ – ниже; оба этих результата являются характерными и для общей популяции. Таким образом, полученные результаты указывают на более проатерогенный профиль у женщин с естественным течением ВИЧ-инфекции. В то же время этот результат требует к себе критического отношения. В ходе исследования Women’s Interagency HIV было показано, что у ВИЧ-инфицированных не было выявлено ассоциации между уровнем ОХС и ЛПНП и толщиной комлекса интима-медиа, которая является сонографическим маркером раннего атеросклеротического поражения сосудистой стенки и не только отражает местные изменения сонных артерий, но и свидетельствует о распространенности атеросклероза [16]. В результате обследования неинфицированных и ВИЧ-инфицированных женщин, получающих АРВТ, было установлено, что у них уровень ЛПНП напрямую ассоциирован с толщиной комплекса интима-медиа [17]. К сожалению, при проведении исследования Women’s Interagency HIV оценку проводили только одномоментно, и нет проспективных данных о дальнейшем влиянии уровня липидов на толщину комплекса интима-медиа, в связи с чем полученные результаты требуют уточнения. Вероятно, в дальнейших исследованиях потребуется уточнение роли более высокого уровня ОХС и ЛПНП у ВИЧ-позитивных женщин без ВААРТ путём проспективного наблюдения за развитием у них атеросклеротического процесса. Более высокий уровень ЛПВП и более низкий уровень ТГ у ВИЧ-позитивных женщин по сравнению с ВИЧ-позитивными мужчинами вновь позволяет предположить сохранение протективного влияния эстрогенов на уровень ЛПВП И ТГ.
При сравнении показателей углеводного обмена достоверных различий по уровню глюкозы выявлено не было, уровень инсулина оказался ниже у ВИЧ-инфицированных женщин, чем у ВИЧ-инфицированных мужчин (рис. 3).
В настоящее время развитие инсулинорезистентности у ВИЧ-инфицированных пациентов связывают с применением антиретровирусных препаратов. Некоторые из них блокирует инсулин-зависимый переносчик глюкозы CLUT-4. Однако выявленное нами повышение уровня инсулина у ВИЧ-инфицированных пациентов-мужчин, не получающих АРВТ, с одной стороны, может указывать на наличие прямого влияния ВИЧ-инфекции на углеводный обмен и развитие инсулинорезистентности ещё до начала АРВТ, с другой – на протективную роль эстрогенов, нивелирующих действие ВИЧ, в нарушении углеводного обмена. Наличие более высокого уровня инсулина у мужчин с ВИЧ-инфекцией приводит к более высокому риску развития ССЗ в связи как с непосредственной ролью инсулина в развитии ССЗ, так и с его влиянием на развитие иных факторов риска, таких как повышение уровня ЛПНП, ТГ и снижение уровня ЛПВП.
По уровню маркёров воспаления между мужчинами и женщинами в основной группе достоверных различий выявлено не было. Вероятно, это связано с тем, что все обследованные пациенты имели сохранную функцию иммунной системы. В то же время, несмотря на отсутствие достоверных различий, у мужчин всё-таки выявляется более высокий уровень ИЛ-12 и ИЛ-18. Возможно, более высокая концентрация этих маркёров у мужчин связана с более быстрым прогрессированием у них ВИЧ-инфекции по сравнению с женщинами. В ходе проведенных ранее исследований было показано, что вирусная нагрузка в 2 раза ниже у женщин по сравнению с мужчинами при одинаковой длительности течения ВИЧ-инфекции [18]. Кроме того, более быстрое прогрессирование ВИЧ-инфекции также следует рассматривать как фактор, увеличивающий сердечно-сосудистый риск у мужчин, так как показано, что степень дислипидемии напрямую ассоциирована с прогрессированием ВИЧ – инфекции [7]. Выявленный более высокий уровень ФНО-α у женщин по сравнению с мужчинами также косвенно подтверждает данные о том, что ВИЧ-инфекция быстрее прогрессирует у мужчин, так как было выявлено, что ФНО-α скорее всего подавляет репликацию ВИЧ [19]. В то же время нами был выявлен достоверно более высокий уровень ФНО-α у ВИЧ-инфицированных мужчин и женщин по сравнению соответственно с мужчинами и женщинами в контрольной группе (рис. 4).
В результате проведенного исследования был выявлен более высокий уровень ОХС, ЛПНН, ЛПВН, ФНО-α и более низкий уровень инсулина, ИЛ-12 и ИЛ-18 в основной группе у женщин по сравнению с мужчинами. Исходя их полученных данных, можно предположить, что ВИЧ-инфекция стирает гендерные различия в развитии таких факторов риска развития ССЗ, как уровень ОХС и ЛПНП, в то же время более высокий уровень воспалительного ответа ассоциирован с принадлежностью к мужскому полу. Для оценки прогностической роли всех вышеуказанных маркёров требуется проведение дальнейших проспективных исследований.


