Количество факторов риска, учитываемых при прогнозе риска развития сердечно-сосудистых заболеваний (ССЗ) растет с каждым днём. И, несмотря на то что ни один из имеющихся на настоящий момент «новых» прогностических маркёров не может полностью заменить традиционные факторы риска, их также следует принимать во внимание. Одним из независимых факторов риска развития ССЗ является ВИЧ-инфекция. В настоящее время от ССЗ погибают 10% ВИЧ-инфицированных [до начала эры антиретровирусной терапии (АРВТ) погибал только 1%][1]. В то же время до сих пор однозначно не определена причина, по которой ССЗ развиваются у ВИЧ-инфицированных пациентов раньше и прогрессируют быстрее. Учитывается роль как традиционных факторов риска (курение, дислипидемия, нарушения углеводного обмена), так и непосредственно связанных с ВИЧ-инфекцией (прямое действие ВИЧ на сосудистую стенку, провоспалительные сдвиги и изменения в системе гемостаза на фоне хронической персистенции вируса, приём антиретровирусных препаратов). Известно, что среди ВИЧ-инфицированных пациентов распространённость традиционных факторов риска шире, чем в общей популяции. Так, в США курят более 50% ВИЧ-инфицированных (для сравнения: в общей популяции в США курят 16% взрослого населения), артериальная гипертензия в молодом возрасте (до 40 лет) встречается у 12–20% ВИЧ-инфицированных (в общей популяции, по данным ESC – у 4%), дислипидемия – у 23,3% (в общей популяции – у 17,6%) [2]. Более того, традиционные факторы риска ССЗ имеют особенности у ВИЧ-инфицированных пациентов и подчас оказывают более выраженное влияние на развитие и прогрессирование заболевания, чем у неинфицированных лиц. Имеются данные о повышении риска развития оппортунистических инфекций, хронической обструктивной болезни легких, остеопороза и других заболеваний у курящих ВИЧ-инфицированных пациентов по сравнению с некурящими, но аналогичных данных по ССЗ, к сожалению, нет. Однако имеются данные о снижении риска развития ССЗ у пациентов, получающих АРВТ, на фоне прекращения курения. При субанализе исследования D:A:D было показано, что риск сердечно-сосудистых катастроф в настоящее время снижается с 2,2 раза у курящих до 1,4 раза через 1 год после прекращения курения и до уровня никогда не куривших – через 3 года [3]. Эти данные позволяют говорить о роли курения в развитии ССЗ у ВИЧ-инфицированных пациентов. В то же время до конца не ясно, имеются ли какие-либо особые механизмы влияния курения на развитие ССЗ у ВИЧ-инфицированных или патогенез полностью соответствует таковому у неинфицированных лиц. Дислипидемия также имеет особенности у ВИЧ-инфицированных пациентов: характерно снижение уровня липопротеинов низкой плотности (ЛПНП), липопротеинов высокой плотности (ЛПВП) и повышение уровней триглицеридов (ТГ) и липопротеинов очень низкой плотности (ЛПОНП) [4].
Специфические для таких пациентов факторы риска включают в себя прямое действие ВИЧ на сосудистую стенку, провоспалительные изменения и изменения в системе гемостаза на фоне персистенции вируса, влияние АРВТ.
Несмотря на имеющиеся на настоящий момент обширные данные об изменениях метаболизма у ВИЧ-инфицированных пациентов, следует учитывать, что в основном они были получены от пациентов, получающих АРВТ и имеющих низкий уровень CD4+-клеток. Данных о подобных изменениях у ВИЧ-инфицированных с естественным течением ВИЧ-инфекции с сохранной функцией иммунной системы недостаточно.
Целью проведенного нами исследования явилась оценка липидного, углеводного и провоспалителного профиля у ВИЧ-инфицированных пациентов с естественным течением ВИЧ-инфекции с уровнем CD4+-лимфоцитов более 350 клеток/мл.
Материалы и методы
В ходе проведенного исследования был обследован 21 пациент с ВИЧ- инфекцией стадии 1–3 в возрасте от 25 до 40 лет (средний возраст 31,95 ± 0,84 года), без сопутствующих хронических заболеваний, со средним уровнем CD4+-лимфоцитов 399,05 ± 34,8 клеток/мл, длительностью естественного течения ВИЧ-инфекции не более 5 лет и не получающий АРВТ. Среди них было 52% мужчин и 48% женщин.
В контрольную группу вошли 39 пациентов (средний возраст – 32,08 ± 0,84 года) без сопутствующих хронических заболеваний. Мужчины составили 49%, женщины – 51%, курящие – 33%.
У всех пациентов определяли уровни общего холестерина (ОХС), ЛПНП, ЛПОНП, ЛПВП, ТГ, апопротеина В (АПО-В), глюкозы, а также маркёров воспаления: фактора некроза опухоли (ФНО-α), интерлейкина 12 (ИЛ-12) и интерлейкина 18 (ИЛ-18). ОХС, ЛПНП, ЛПОНП, ЛПВП, ТГ, АПО-В, глюкозу в плазме крови определяли на автоматическом биохимическом анализаторе Architect ci8200. Уровень инсулина определяли на автоматическом биохимическом анализаторе IMMULITE 2000. Уровень ФНО-α, ИЛ-12 и ИЛ-18 определяли методом иммуноферментного анализа с использованием стандартных планшет.
Результаты и обсуждение
В результате проведенного исследования было выявлено, что уровень ОХС был достоверно ниже у пациентов с естественным течением ВИЧ-инфекции в сравнении с контрольной группой. Это обусловлено в основном снижением уровня ЛПНП. Значимого различия по уровням ЛПОНП, ЛПВП, ТГ и АПО-В выявлено не было. Выраженных отличий в показателях углеводного обмена между группами также не выявлено (табл. 1).
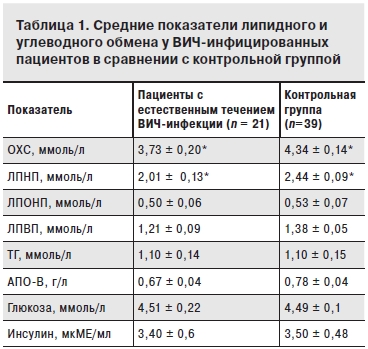
*р < 0,05.
Наиболее выраженные различия выявлены в уровне маркёров воспаления. Более того, выявлена положительная корреляционная связь между уровнями ФНО-α и ИЛ-18 (табл. 2).
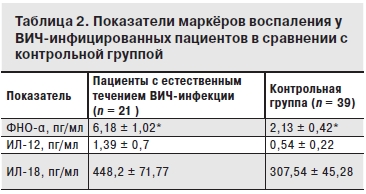
*р < 0,05.
После деления групп по статусу курения не было выявлено значимых различий по уровню ОХС, ЛПНП, ЛПОНП, ЛПВП, АПО-В. Однако нами были выявлены различия по уровню ТГ у курящих и некурящих пациентов в обеих группах: у курящих данный показатель оказался выше. При сопоставлении показателей углеводного обмена в группе с естественным течением ВИЧ-инфекции отмечался достоверно (р < 0,05) более высокий уровень глюкозы и инсулина у курящих пациентов в сравнении с некурящими. В контрольной группе уровень глюкозы и инсулина у курящих не был повышен (табл. 3).
*р < 0,05.
Уровень ФНО-α был выше у некурящих лиц в обеих группах. Уровень ИЛ-12 оказался выше у курящих в группе с естественным течением ВИЧ-инфекции. Уровень ИЛ-18 был выше у курящих лиц в обеих группах, более того, разница в показателях в группе с естественным течением ВИЧ-инфекции был выше, чем в контрольной группе. Кроме того, была выявлена положительная корреляционная связь между уровнем ИЛ-18 и инсулина (табл. 4).
*р < 0,05.
В настоящее время результаты большого числа исследований подтверждают повышенный риск развития сердечно-сосудистой патологии у ВИЧ-инфицированных пациентов. В то же время во всех крупномасштабных исследованиях (D:A:D, SMART) с оценкой таких конечных точек, как смерть или сердечно-сосудистая катастрофа принимали участие пациенты, уже получающие АРВТ на момент начала исследования и отсутствовали данные о наличии или отсутствии у них факторов риска ССЗ до начала АРВТ. Также в этих исследованиях не проводилось сравнений с ВИЧ-инфицированными пациентами с аналогичными исходными характеристиками, но не получающими АРВТ, что делает невозможным определение роли ВИЧ-инфекции и АРВТ по отдельности в развитии конечных точек. Более того, в эти исследования могли быть включены пациенты с сердечно-сосудистой патологией и сахарным диабетом в анамнезе [1]. К сожалению, на настоящий момент в литературе отсутствуют данные об этой подгруппе пациентов, но данные по ним включены в общие данные по исследованию. В то же время наличие у пациентов в анамнезе сердечно-сосудистой патологии может указывать на наличие у них выраженного атеросклероза до начала исследования, что могло изначально влиять на их конечные точки.
Кроме того, в исследования включали лиц с низким уровнем CD4+-лимфоцитов (допускалось включение лиц с уровнем 250 клеток/мл), что говорит о высокой активности вируса и малой эффективности АРВТ и также может влиять на полученные результаты. При оценке цитокинового профиля в исследовании SMART была выявлена только корреляция ИЛ-6 с уровнем общей смертности [4]. На отсутствие выраженного влияния хронического воспаления может влиять АРВТ, на фоне которой воспалительный процесс должен затихать, а также доминирующая роль развивающейся на фоне АРВТ дислипидемии.
Имеются ограничения в экстраполяции данных, полученных в ранее проведённых исследованиях, в которых участвовали пациенты с естественным течением ВИЧ-инфекции. Так, в исследовании, в которое были включены 419 ВИЧ-инфицированных, средний уровень CD4+-лимфоцитов составил 216 клеток/мл, и у 26% участников исследования имелись проявления СПИДа [5]. Поэтому полученные данные нельзя экстраполировать на популяцию с естественным течением ВИЧ-инфекции с сохранным уровнем CD4+-клеток. Таким образом, на настоящий момент отсутствуют исследования, в которых оценивалась бы роль вируса в развитии факторов риска кардиоваскулярной патологии при сохранной иммунной системе.
О роли дислипидемии в развитии ССЗ у ВИЧ-инфицированных пациентов до сих пор нет единого мнения. Неясно, является ли она следствием прямого действия ВИЧ-инфекции на липидный обмен или связана с действием АРВТ. Вероятно, изначально нарушения липидного обмена вызваны ВИЧ, а АРВТ усугубляет уже имеющиеся изменения. Но возможна и иная точка зрения. Изменения, происходящие в липидном профиле под действием ВИЧ-инфекции, нивелируются при подавлении репликации вируса, а развивающиеся в дальнейшем изменения липидного профиля являются побочным эффектом АРВТ, не связанным с исходными изменениями. Обе точки зрения соответствуют имеющимся литературным данным. Известно, что у пациентов с естественным течением ВИЧ-инфекции снижается уровень ЛПНП и ЛПВП и повышается уровень ТГ и ЛПОНП. Более того, имеющиеся изменения были напрямую ассоциированы со снижением уровня СD4+-клеток [4]. Кроме того, нельзя утверждать, что снижение уровня ЛПНП оказывает антиатерогенное действие, так как известно, что у данной группы пациентов среди ЛПНП преобладают мелкие плотные частицы, концентрация которых напрямую связана с развитием ССЗ как в общей популяции, так и среди ВИЧ-инфицированных пациентов [6]. Полученные нами данные об уровне ЛПНП у ВИЧ-инфицированных соответствуют данным литературы. Выявленное снижение уровня ОХС также не противоречит литературным данным, так как оно связано со снижением уровня ЛПНП. Но в отличие от проведенных ранее исследований, нами не было выявлено повышения уровня ТГ и ЛПОНП и снижения уровня ЛПВП. Это может быть связано с более высоким уровнем CD4+-клеток у наших пациентов: мы включали в исследование ВИЧ-инфицированных с уровнем CD4+-лимфоцитов не менее 350 клеток/мл, в то время как в исследованиях, проводимых ранее, принимали участие больные с уровнем CD4+-лимфоцитов менее 250 клеток/мл [7].
После дифференцировки групп по статусу курения не было выявлено различий в уровне ОХС, ЛПНП, ЛПОНП, ЛПВП у курящих лиц с ВИЧ-инфекцией по сравнению с некурящими. Вероятно, это отсутствие различий связано с преобладающим влиянием на липидный профиль самой инфекции в сравнении с воздействием курения. Известно, что на фоне курения повышается уровень ЛПНП, но учитывая, что при ВИЧ-инфекции уровень ЛПНП снижается, изменения данного показателя могут отсутствовать. Отсутствие этих изменений позволяет сделать предположение о преобладании влияния ВИЧ-инфекции на развитие дислипидемии по сравнению с курением. В то же время в ходе субанализа исследования D:A:D была продемонстрирована роль курения в повышении риска развития ССЗ. Было показано, что риск развития инфаркта миокарда в 3,4 раза выше у курильщиков и в 1,73 раза выше у куривших в прошлом по сравнению с некурящими. После прекращения курения в течение 1–2 лет риск снижался до 3,0 раз, 2–3 лет – до 2,62 раза и после 3 лет – до 2,07 раза [3]. Также следует учитывать, что уровень ТГ у курящих лиц с ВИЧ-инфекцией оказался выше, чем у некурящих. Вероятно, это связано с взаимопотенцирующим действием ВИЧ-инфекции и курения на развитие хронического воспаления, так как известно, что повышение уровня ТГ ассоциировано с повышением уровня интерферона альфа, которое происходит как на фоне курения, так и на фоне ВИЧ-инфекции.
Нами не было выявлено различий в уровне глюкозы и инсулина у ВИЧ-инфицированных пациентов по сравнению с контрольной группой, хотя в литературе имеются данные о развитии инсулинорезистентности у больных ВИЧ-инфекцией, не получающих АРВТ. В данном случае опять следует учесть тот факт, что степень выраженности инсулинорезистентности напрямую ассоциирована с уровнем CD4+-лимфоцитов, что позволяет предположить её развитие на фоне активной репликации вируса, в то время как у пациентов в проведенном нами исследовании, как уже упоминалось, уровень CD4+-лимфоцитов был не ниже 350 клеток/мл [8]. В то же время после дифференцировки по статусу курения нами был выявлен более высокий уровень глюкозы и инсулина у курящих ВИЧ-инфицированных пациентов по сравнению с некурящими, что соответствует данным, полученным в общей популяции [5]. Важность роли хронического воспаления подтверждают результаты исследования SMART, в котором отмечалось повышение уровня ИЛ-10, ИЛ-6 и ФНО-α при перерывах в АРВТ [9]. В ходе проведенного нами исследования было показано, что уровень провоспалительных маркёров выше у ВИЧ-инфицированных пациентов по сравнению с контролем. Это может рассматриваться как непосредственный фактор риска развития ССЗ. Кроме того, прогрессирование ВИЧ-инфекции ассоциировано с ростом концентрации маркёров воспаления, а риск развития ССЗ напрямую ассоциирован с уровнем CD4+-клеток. Следовательно, чем выше концентрация маркёров воспаления, тем выше активность репликации вируса и выше риск ССЗ. В то же время повышение уровня ФНО-α может быть расценено двояко в связи с его ролью в патогенезе прогрессирования ВИЧ-инфекции. С одной стороны известно, что повышение концентрации маркёров воспаления, к которым относится ФНО-α, является предиктором развития ССЗ. С другой стороны, исходя из того, что ФНО-α, возможно, подавляет репликацию ВИЧ, можно предположить, что, снижая вирусную нагрузку, ФНО-α уменьшает прямое влияние ВИЧ-инфекции на развитие атеросклероза [10]. Повышение уровня ИЛ-18 может оказывать проатерогенное действие как само по себе, так и путём влияния на развитие инсулинорезиситентности, которая также является фактором риска развития ССЗ. При анализе уровней маркёров воспаления у курящих и некурящих пациентов с ВИЧ-инфекцией было выявлено снижение уровня ФНО-α у курящих и повышение у них уровней ИЛ-12 и ИЛ-18 по сравнению с некурящими. Скорее всего, уровень ИЛ-18 повышен у курящих пациентов с ВИЧ-инфекцией по сравнению с некурящими по иной причине, чем в общей популяции курильщиков. Предполагается, что в общей популяции повышение уровня ИЛ-18 у курящих связанно с повышенной выработкой провоспалительных маркёров альвеолярными макрофагами курящих лиц, что подтверждается данными об уровнях ИЛ-18 в бронхоальвеолярном лаваже у лиц, не инфицированных ВИЧ [11]. В то же время данное объяснение не является рациональным для ВИЧ-инфицированных пациентов, так как было показано, что в данной субпопуляции курение снижает возможность альвеалярных макрофагов вырабатывать провоспалительные маркеры [12]. Можно предположить, что уровень ИЛ-18 и ИЛ-12 у курящих пациентов выше из-за более быстрого прогрессирования ВИЧ-инфекции у курящих по сравнению с некурящими, так как известно, что прогрессирование ВИЧ-инфекции напрямую ассоциировано с возрастанием уровня маркёров воспаления.
Таким образом, в ходе проведенного нами исследования был оценен липидный, углеводный и провоспалительный профиль у ВИЧ-инфицированных пациентов с естественным течением ВИЧ-инфекции. Наличие выраженных провоспалительных сдвигов у данной группы пациентов по сравнению с контрольной группой, вероятно, обусловливает ранее развитие у них ССЗ. Данные, полученные нами при анализе групп по статусу курения (более высокие показатели маркёров углеводного обмена, триглицеридов и маркёров воспаления) позволяют сделать вывод о более высоком риске развития ССЗ у курящих лиц с ВИЧ-инфекцией по сравнению с некурящими. Более того, известно, что добавление дополнительного фактора риска увеличивает риск развития ССЗ в геометрической прогрессии. Учитывая, что у данной субпопуляции уже имеется один фактор риска развития ССЗ (наличие ВИЧ-инфекции), что увеличивает вероятность развития ССЗ в 2 раза, присоединение такого дополнительного фактора риска, как курение приводит в повышению вероятности развития ССЗ в 6–8 раз [13].


