На сегодня самыми распространенными формами инфекционного поражения центральной нервной системы как у взрослых, так и у детей продолжают оставаться менингиты. Частота встречаемости серозных менингитов в структуре инфекционных заболеваний нервной системы достигает 70% и значительно превышает встречаемость гнойных поражений мозговых оболочек [1–7].
Наиболее частыми этиологическими агентами серозных менингитов у детей являются энтеровирусы (ЭВ). В последние годы наблюдается увеличение заболеваемости энтеровирусными менингитами (ЭВМ), которые постоянно регистрируются в виде локальных вспышек или спорадических заболеваний на разных территориях РФ и в других странах мира [8–11].
Активизация энтеровирусной инфекции (ЭВИ), наблюдаемая в разных регионах РФ, обусловлена постоянной циркуляцией ЭВ во внешней среде, их многочисленностью, высокой контагиозностью, изменчивостью, которая вместе с действующими резервуарами (длительное вирусоносительство, восприимчивый коллектив) определяет масштаб распространения данной инфекции на конкретной территории и ее клинико-эпидемиологические особенности [12].
Наиболее подвержены ЭВИ дети, в основном определяющие общий уровень заболеваемости и периодические подъемы ее в регионах.
В структуре клинических форм этой инфекции ЭВМ у детей занимает ведущее место.
Несмотря на благоприятное течение ЭВМ в остром периоде заболевания, в периоде реконвалесценции в 30–50% случаев регистрируются различного рода остаточные явления в виде церебрастенического, гипертензионного синдромов, невротических состояний и т. п., требующих проведения корригирующей терапии для повышения качества жизни. Все это определяет актуальность оптимизации базисной терапии ЭВМ путем включения средств этиотропной направленности, предпочтительно обладающих одновременно этиотропным эффектом и способностью к восстановлению иммунологических параметров, не имеющих существенных побочных явлений и возрастных ограничений. Таким требованиям в полной мере отвечают препараты интерферонов.
Наиболее быстрой ответной реакцией при встрече организма с вирусным агентом является продукция интерферона (ИФН), который формирует защитный барьер на пути вирусов намного раньше специфических защитных реакций иммунной системы. ИФН стимулирует клеточную резистентность, делая клетки непригодными для размножения вирусов, а также активирует макрофаги, естественные киллеры, которые затем синтезируют γ-ИФН, интерлейкины, в результате чего макрофаги и естественные киллеры приобретают способность лизировать вирус-инфицированные клетки. Интерфероны способны оказывать воздействие не только на инфицированные, но и на интактные клетки, что позволяет предотвратить дальнейшую диссеминацию вируса и тем самым снизить риск развития тяжелых и осложненных форм болезни.
Цель исследования – изучить клинико-эпидемиологические особенности ЭВМ у детей в Оренбургской области за период 2006–2011 гг. и оценить эффективность виферона в комплексной базисной терапии.
Материалы и методы
Проведен анализ показателей заболеваемости ЭВМ у детей в Оренбургской области за период с 2006 по 11 мес. 2011 г. с учетом эпидемиологических данных, представленных Управлением Роспотребнадзора по Оренбургской области (показатель заболеваемости детей до 17 лет по годам с определением наиболее поражённых групп), а также ретроспективный анализ [по данным историй болезни пациентов, историй развития детей (форма № 112)] заболеваемости ЭВМ у детей, пролеченных в Муниципальной клинической инфекционной больнице Оренбурга и находившихся на диспансерном наблюдении в поликлинике № 4 Оренбурга в течение 12 мес.
В 2010–2011 гг. в Муниципальной клинической инфекционной больнице Оренбурга проходили лечение 90 детей с ЭВМ: 12 из них были в возрасте от 1 года до 3 лет, 36 – 4–7 лет и 42 ребенка – 8–14 лет. Диагноз ЭВМ был подтвержден положительными результатами выделения РНК вируса и его идентификации в ликворе методом ПЦР с последующим частичным секвенированием генома ЭВ в Приволжском научно-методическом центре по изучению энтеровирусных инфекций.
В зависимости от вида получаемой терапии дети были разделены на 2 группы. 1-ю (основную) группу составили 50 детей, которые наряду с базисной терапией получали препарат виферон (рекомбинантный ИФН-α-2b). Во 2-ю группу (сравнения) вошли 40 детей, которые получали традиционное, патогенетическое и симптоматическое лечение.
Результаты исследования
По данным Управления Роспотребнадзора по Оренбургской области за 2006–2011 гг., ЭВМ занимает ведущее место в структуре клинических форм ЭВИ у детей, доля его ежегодно возрастала (с 27,3% в 2006 г. до 86% в 2010 г.), в 2,1 раза превысив показатели по РФ (рис. 1).
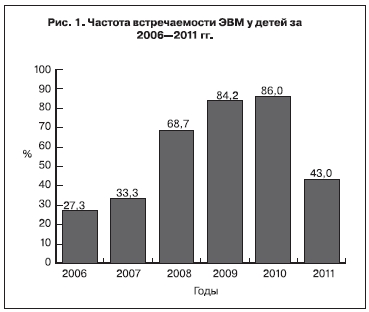
В 2011 г. показатели заболеваемости у детей как ЭВМ, так и ЭВИ снизились в 2,5 раза и продолжали снижаться в 2012 г.
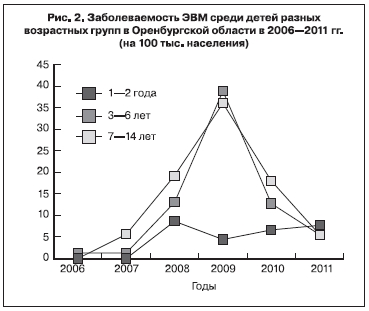
В возрастных группах 7–14 и 3–6 лет были наиболее высокие показатели заболеваемости, которые коррелировали с эпидемиологической кривой ЭВИ и до 2009 г. возрастали соответственно с 1,28 до 38,84 и с 5,6 до 36,01 на 100 тыс. населения, а с 2010 г. значительно снизились – соответственно до 1,81 и 5,52. В то же время наметилась тенденция роста заболеваемости у детей в возрасте от 1 года до 2 лет – с 6,64 на 100 тыс. населения в 2010 г. до 7,7 – в 2011 г. (рис. 2).
В этиологической структуре за указанный период произошла смена доминирующих групп возбудителей ЭВМ. Так, если в 2006 г. превалировали вирусы Коксаки (66,7%), превысив в 2 раза количество вирусов ЕСНО (33,3%), то в последующие 2 года их удельный вес снизился и достиг минимума в 2009 г. (0,91%). В то же время вирусы ЕСНО стали доминирующими возбудителями ЭВМ. В 2011 г. наметилась тенденция новой активизации группы вирусов Коксаки: их удельный вес возрос в 7 раз (14,29%) по сравнению с 2010 г. (2,17%) на фоне некоторого снижения удельного веса вирусов ЕСНО (21,4%) (рис. 3).
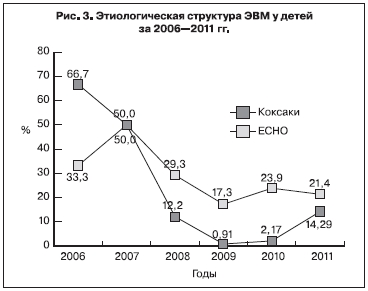
В 2012 г. увеличилось число случаев ЭВМ, вызванных серотипом ЕСНО 6 (34%).
Спектр типированных возбудителей ЭВМ у больных детей был представлен серогруппами вирусов ЕСНО (ЕСНО 6 – 13%, ЕСНО 19 – 31%, ЕСНО 9 – 4%, ЕСНО 30 – 26%), Коксаки В3 (3%) и коррелировал с видовым составом ЭВ, выделенных во внешней среде в ходе постоянно проводимого мониторинга [вирусы ЕСНО (2,6%) с превалированием серогрупп ЕСНО 30 (64%), ЕСНО 6 (21,4%) и ЕСНО 19 (24%)].
В круглогодичной заболеваемости ЭВМ прослеживается четко выраженная летнее-осенняя сезонность с пиком в августе–сентябре, во время которого регистрируется до 40–42% всех случаев заболеваний.
Проведенный анализ клинических данных показал, что начало серозного менингита у всех детей было острым, большинство (83%) из них обратились к врачу в первые 2 суток от начала заболевания. У всех регистрировался общеинфекционный синдром, проявляющийся повышением температуры тела (100%), недомоганием (67%), гиперемией лица (54%), тахикардией (100%), снижением аппетита (100%). На этом фоне отмечалось развитие общемозгового синдрома, сопровождающегося головной болью (94%), многократной рвотой, не приносящей облегчения (77%), а также определялся менингеальный синдром (100%). У некоторых детей были катаральные явления (8%): слизисто-серозное отделяемое из носовых ходов, першение в горле, гиперемия зева. У части (11%) больных имела место дисфункция кишечника в виде болей в животе, учащения стула до 5–7 раз за сутки, разжижения кала и появления в нём непереваренных комочков пищи, прозрачной слизи. Средняя продолжительность лихорадочного периода у 6% детей составила 3 ± 0,5 дня, рвота продолжалась не более 2 дней. Менингеальные симптомы у большинства детей сохранялись в течение 1 нед. Несколько дольше сохранялся симптом Кернига – 8 ± 0,5 дня.
При спинномозговой пункции ликвор у всех детей был прозрачный, бесцветный, вытекал частыми каплями. В цереброспинальной жидкости (ЦСЖ) определялся лимфоцитарный плеоцитоз (95%), который варьировал в пределах 100–500 клеток. Показатели белка и сахара не были изменены.
В гемограмме регистрировалась умеренная лейкопения и относительный лимфоцитоз.
Анализ лечебных мероприятий показал, что в группе детей, получавших в составе комплексной терапии человеческий рекомбинантный ИФН-α-2b (виферон-1, виферон-2 в виде суппозиториев для ректального введения) в дозе от 300 тыс. ЕД до 2 млн ЕД в сутки в течение 10 дней в зависимости от возраста, уже в первые дни заболевания наблюдалось клиническое улучшение (через 1–2 сут после начала терапии). Средняя продолжительность интоксикации не превышала 3,3 ± 0,3 дня, менингеального синдрома – 4,8 ± 0,5 дня. У детей, получавших традиционную терапию, продолжительность клинических синдромов и их регресс были больше: синдрома интоксикации – 5,5 ± 0,4 дня, менингеального синдрома – 6,5 ± 0,9 дня. Сроки санации ЦСЖ также зависели от вида получаемой терапии: в группе детей, получавших виферон, санация ЦСЖ наступала на 9–10-й день, у детей, не получавших препарат – на 10–14-й день (табл. 1).
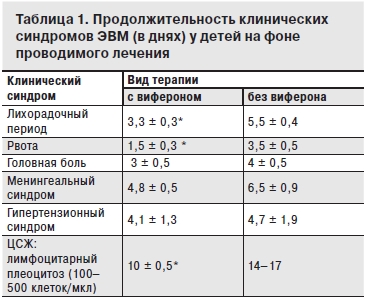
* p < 0,001.
При исследовании ликвора (ПЦР) у большинства детей (85%) была обнаружена РНК вируса. Причиной заболеваний были преимущественно вирусы ЕСНО 9, 19, 30. В 93% случаев заболевание имело среднетяжелое течение.
Мониторинговый анализ исходов ЭВМ (рис. 4, см. на вклейке) показал, что у части детей после выписки из стационара были выявлены функциональные нарушения центральной нервной системы: церебрастенический (36%) и неврозоподобный (27%) синдромы.
Дети с церебрастеническим синдромом предъявляли жалобы на головную боль, чаще в височных областях, эмоциональную лабильность, общую слабость, снижение памяти, невнимательность, физическую и психическую утомляемость. Неврозоподобный синдром у них проявлялся расстройством сна, ночными страхами, эмоциональной лабильностью, нарушением поведения в виде повышенной агрессивности, плаксивости (11%), энуреза (6%). Данные изменения сохранялись и через 6 мес. с наибольшей частотой и выраженностью неврологических расстройств у детей, не получавших виферон (31%). Помимо этого, у 32% детей наблюдался синдром дисфункции желудочно-кишечного тракта (ЖКТ) (из них боли в эпигастральной области – у 15%, нарушение стула – у 32%, тошнота – у 4%) и у 19% – увеличение частоты инфекционно-воспалительных заболеваний (ОРЗ, риносинуситы, гаймориты, кишечные инфекции), которые через 6 мес. Отмечались в основном у детей школьного возраста и регистрировались лишь в группе детей, не получавших виферон.
Через 12 мес. проспективного наблюдения синдромы нарушения центральной нервной системы (церебрастенический, неврозоподобный) сохранялись только в группе детей, не получавших в комплексной терапии виферон (24,5%). Особенно это касается синдрома дисфункции ЖКТ и частоты инфекционно-воспалительных заболеваний, которые в первые 6 мес. в группе детей, получавших виферон, не регистрировались и отмечались лишь у 9% из них в течение последующих 6 мес. В отличие от них у детей, не получавших виферон, дисфункции ЖКТ и частота инфекционно-воспалительных заболеваний наблюдались в 2,5 раза чаще почти у того же количества детей, что и через 6 мес.
Таким образом, ЭВМ у детей в Оренбургской области за период 2006–2011 гг., коррелируя с эпидемиологической кривой заболеваемости ЭВИ на этапах ее подъема и снижения, занимает лидирующие позиции, сохраняя классические черты нейроинфекции и летнее-осеннюю сезонность.
Наиболее поражёнными возрастными группами ЭВМ являются дети 7–14 и 3–6 лет. Наибольшую эпидемическую значимость имели ЭВ группы ЕСНО серогрупп 6, 9, 19, 30, спектр которых коррелировал с видовым составом ЭВ, циркулирующим во внешней среде. ЭВМ у большинства детей протекал в среднетяжелой форме с формированием остаточных явлений у 1/3 детей.
Включение виферона в комплексное лечение ЭВМ у детей не только сокращает сроки регресса острого периода заболевания, оказывая выраженный иммуномодулирующий эффект, но и положительно влияет на состояние здоровья детей в период реконвалесценции, что обосновывает целесообразность включения виферона в протокол комплексной терапии ЭВМ.


