В ближайшие десятилетия ожидается дальнейшее увеличение числа больных с отдаленными последствиями хронических вирусных гепатитов, рост их смертности и расходов, связанных с лечением терминальных форм поражения печени. При этом обычные клинические показатели не всегда позволяют дифференцировать минимальный фиброз от тяжелого и важное клиническое значение приобретает представление о факторах риска прогрессирования вирусной инфекции [1].
Поражение печени при хронических вирусных гепатитах проходит через определенные стадии: инфицирование вирусом клеток печени → развитие персистирующего иммунного воспаления → фиброз → цирроз → дисплазия гепатоцитов → рак печени [2]. На каждой из этих стадий ведущую роль играют цитокины, которые регулируют межклеточные взаимоотношения путем воздействия на определенные клеточные рецепторы. Цитокины синтезируются в печени как гепатоцитами, так и непаренхиматозными клетками [макрофагами, клетками Ито (звездчатыми клетками), лимфоцитами, эндотелиоцитами и др.)]. Ключевую роль в развитии персистирующего воспаления с последующим апоптозом и некрозом паренхимы печени играют провоспалительные цитокины интерлейкин-1 и фактор некроза опухоли α (ФНО-α), которые наряду с перекисями, протеазами, оксидом азота, эндотелином, тромбоцит-активирующим фактором, активатором плазминогена, трансформирующим фактором роста β1 (ТФР-β1) выделяются из поврежденных вирусом гепатоцитов и активируют макрофаги печени, а также эндотелий синусоидов. Последние, в свою очередь, секретируют цитокины, в частности ФНО-α, под действием которого звездчатые клетки выходят из состояния покоя и претерпевают ряд превращений [3].
Известно, что на первом этапе (этап инициации) покоящиеся звездчатые клетки под действием секреторных продуктов макрофагов и эндотелия утрачивают депо ретиноидов и начинают секретировать ТФР-β1 – фактор, который играет ключевую роль в развитии последующей аутоактивации звездчатых клеток и приобретении ими способности мигрировать в участки воспаления. Следующий этап (этап закрепления) сопровождается превращением звездчатых клеток в миофибробласты – клетки вытянутой формы, содержащие фибриллы альфа-актина (что придает им некоторую способность к сокращению). Эти клетки продолжают секретировать ТФР-β1 и активно делятся в участках воспаления [4, 5]. Их профиброгенный потенциал связан со способностью синтезировать белки внеклеточного матрикса (коллаген I типа, фибронектин, гиалуроновую кислоту) как и компоненты, угнетающие распад фиброза [6].
Исследование сопутствующих этому процессу иммунных механизмов показало, что основную роль в негативном контроле продукции ТФР-β1 при вирусных гепатитах выполняет провоспалительный цитокин ФНО-α [7, 8].
Многофакторность влияния на течение хронических гепатитов В (ХГВ) и С (ХГС), в том числе и генетически обусловленная, высокая опасность хронических вирусных гепатитов в качестве предшественников цирроза печени и гепатоцеллюлярной карциномы требуют разработки критериев, которые помогали бы врачу определять риск неблагоприятного исхода заболевания у каждого конкретного пациента, а на роль одного из критериев в полной мере может претендовать ФНО-α.
В соответствии с отмеченными положениями целью настоящей работы служило определение патогенетического и возможного критериального значения ФНО-α в развитии неблагоприятных исходов ХГВ и ХГС путем сопоставления сывороточного уровня этого цитокина и гистологических изменений в биопсийном материале ткани печени больных с учетом их национальной принадлежности.
Исследование выполнено при финансовой поддержке Министерства образования и науки Российской Федерации (Государственный контракт №11.519.11.2034 от 01.11.2011 г.)
Материалы и методы
Работа основана на результатах исследования сыворотки крови и пункционного биопсийного материала ткани печени 230 больных ХГВ и ХГС из разных регионов Республики Казахстан, находившихся на лечении в РГП Национальный научный медицинский центр Министерства здравоохранения Республики Казахстан в период с 2004 по 2009 г.
В соответствии с целью и задачами исследования больные были разделены на группы: 1-ю группу из 123 (53,5%) человек составили пациенты казахской национальности, во 2-ю группу вошли 107 (46,5%) пациентов некоренной национальности (славяне). Принадлежность к той или иной популяции определялась отсутствием в родословных смешанных браков на протяжении трех поколений. Возраст больных варьировал от 18 до 60 лет. Критериями отбора пациентов в исследование служили: подтвержденный диагноз ХГВ (HBeAg-негативного, без D-агента) или ХГС; отсутствие противовирусной терапии в анамнезе; отсутствие в анамнезе и результатах клинико-лабораторного обследования сведений, позволяющих причислить обследуемых к категориям лиц, часто и длительно болеющих, злоупотребляющих алкоголем или страдающих заболеваниями печени невирусной этиологии. Критерием постановки диагноза ХГВ служило присутствие HBsAg вируса гепатита В в крови пациентов более 6 мес., ХГС – обнаружение анти-HCV и РНК HCV в крови больных дольше 6 мес.
Из 230 обследованных 123 (53,5%) человека страдали ХГВ и 107 (46,5%) человек – ХГС. Всего в исследовании участвовали 140 (60,9%) мужчин и 90 (39,1%) женщин. Среди больных ХГВ было 78 (63,4%) мужчин и 45 (36,6%) женщин, среди больных ХГС также преобладали мужчины (57,9%). К 1-й группе относилось 64 (52,0%) пациента с ХГВ, ко 2-й (лица некоренной национальности) – 59 (48,0%) пациентов. В 1-ю группу вошли 59 пациентов с ХГС (55,1%), во 2-ю – 48 (44,9%). Изучение генотипического спектра вируса гепатита С показал преобладание 1b генотипа. Из 107 пациентов с ХГС у 63 (58,9%) определялся этот генотип вируса в крови, из них у 34 мужчин (31,8%) и 29 женщин (27,1%), тогда как 2 и 3 генотипы вируса присутствовали в крови лишь у 44 (41,1%) пациентов, в числе которых было 28 (26,2%) мужчин и 16 (14,9%) женщин.
Для оценки динамики фиброзного процесса в ходе исследования всем пациентам дважды с интервалом в 48 нед. проводили пункционную биопсию печени с последующим морфологическим изучением биопсийного материала. Морфологическое исследование проводили в отделении патоморфологии РГП Национальный научный медицинский центр Министерства здравоохранения Республики Казахстан. Стадию фиброза печени устанавливали по шкале METAVIR [9]: F0 – отсутствие фиброза; F1 – звездчатое расширение портальных трактов без образования септ; F2 – расширение портальных трактов с единичными порто-портальными септами; F3 – многочисленные порто-центральные септы без цирроза; F4 – цирроз.
Определение уровня ФНО-α в крови больных проводили методом иммуноферментного анализа проб сыворотки крови больных с использованием микропланшетного ридера Opsys MR («ThermoLabsystems», Финляндия) в соответствии с инструкцией по применению аппаратуры и комплекта моноклональных антител anti-ФНО-α МКАТ (ЗАО «Вектор-Бест», Новосибирск).
Статистическое сопоставление данных при отсутствии их нормального распределения проводили методами непараметрической статистики с использованием критерия Манна-Уитни для абсолютных величин и критерия χ² при сопоставлении частотных значений. Критериальную роль ФНОα по соответствию высоких значений этого цитокина стадиям фиброза печени определяли с помощью уравнений линейной регрессии (пакет статистических программ SPSS 17.0).
Результаты и обсуждение
Исследование уровня ФНО-α у больных ХГВ и ХГС разных национальностей показало результаты, представленные на рис. 1.
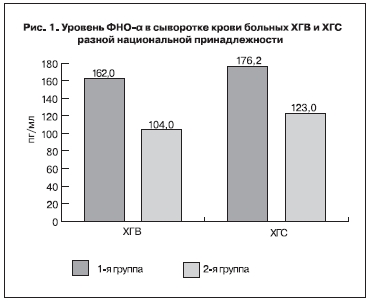
Как следует из полученных данных, и при ХГВ, и при ХГС у больных 1-й группы уровень ФНО-α был достоверно выше, чем у представителей 2-й группы (рХГВ= 0,027, рХГС=0,034). Интересно отметить, что достоверных отличий по уровню тестируемого цитокина в крови между больными хроническими гепатитами различной этиологии получено не было. Это позволяет предполагать, что содержание ФНО-α в сыворотке крови зависит не столько от этиологического фактора, сколько от степени фиброзных изменений в печени, и может иметь генетическую основу, связанную с национальной принадлежностью.
Для проверки этого предположения больные обеих групп в дальнейшем были разделены на подгруппы в соответствии со стадией фиброза печени, как представлено в табл. 1.
Как видно из табл. 1, соотношение численного состава подгрупп на разных стадиях цирроза печени и в группе ХГВ, и в группе ХГС разной национальной принадлежности примерно соответствует друг другу, что допускает их сопоставление при проведении дальнейших исследований.
Далее в каждой подгруппе больных выдели еще по 2 категории: категория А, в которой уровень ФНО-α превышал 87 пг/мл, т. е. был выше физиологической нормы, и категория В, в которой содержание ФНО-α в сыворотке крови было ≤ 87 пг/мл. Подобное распределение больных отражено в табл. 2.
При ХГВ уровень ФНО-α изучали у 123 больных, из них к категории А относились 74 (60,2%) человека, к категории В – 49 (39,8%) человек. На стадии F0 уровень ФНО-α не превышал нормальных значений независимо от национальной принадлежности. На стадии F1 были отмечены определенные различия: в 1-й группе высокий уровень ФНО-α был зарегистрирован в 36% случаев, а во 2-й группе – только у 19% больных. На остальных стадиях доля больных с высоким уровнем ФНО-α неуклонно возрастала по мере роста тяжести фиброзного процесса уже вне зависимости от национальности.
Аналогичная ситуация наблюдалась и при ХГС, при этом общая доля больных с высоким уровнем ФНО-α была примерно такой же – 61,7%.
Таким образом, генетические особенности на уровне национальной принадлежности больных ХГВ и ХГС, оцененные по содержанию ФНО-α в крови наблюдаемых пациентов, проявляются только на стадии F1 и не связаны с этиологией вирусного гепатита.
Чтобы оценить патогенетическое и прогностическое значение этих данных, их изучали в динамике. Повторное исследование проводили через 48 нед, а его результаты вне зависимости от этиологии заболевания представлены на рис. 2 (см. на вклейке).
Как видно на рис. 2, отличия между группами различной национальной принадлежности отчетливо выявлялись еще при анализе исходных данных. У больных хроническими вирусными гепатитами 1-й группы наиболее высокий уровень ФНО-α в крови, как и следовало ожидать, был отмечен при развитии цирроза печени (стадия F4). Во 2-й группе высокое содержание этого цитокина в крови на стадии F1 встречалось в 2,2 раза реже, чем в 1-й. Иными словами, есть все основания считать, что повышение уровня ФНО-α в крови больных казахской национальности наступает гораздо раньше.
Степень прогрессирования заболевания определяли на основе динамического наблюдения за больными ХГВ и ХГС в течение 48 нед с последующей констатацией изменений частоты регистрации высоких значений уровней ФНО-α в крови и их соответствия стадиям фиброза печени. Было установлено, что переход от одной стадии фиброза к другой (более высокой) у больных 1-й группы был зарегистрирован в 17,3% случаев, у больных 2-й группы – в 16,4% случаев. Для статистической оценки результатов этих наблюдений был использован регрессионный анализ, результаты которого представлены на рис. 3 и 4.
Формула регрессии, отражающая соотношение высоких значений ФНО-α в крови и стадии фиброза печени по шкале METAVIR, имела вид:
y = a•x + b,
где y – уровень ФНО-α, a – скорость изменения уровня ФНО-α при переходе от одной стадии фиброза к другой, b – свободный член уравнения.
У 64 больных ХГВ 1-й группы скорость роста ФНО-α по стадиям фиброза, рассчитанная с помощью уравнения линейной регрессии: y=18,93x+125,42 с коэффициентом корреляции (r), равным 0,67, составила 18,9 пг/мкл (см. рис. 3). У 59 больных ХГВ 2-й группы этот показатель вычисляли, применяя уравнение: у=15,33х+137,21. Он составил 15,3 пг/мкл при r=0,57, т. е. был ниже. Различия в скорости роста ФНО-α между группами были достоверны (p=0,041).
Для 59 пациентов 1-й группы с ХГС график соотношения величины ФНО-α и стадии фиброза печени представлен на рис. 4. r линейной зависимости ФНО-α – стадия фиброза, описываемая уравнением: y = 20,55x + 118,57 – составил 0,68, а скорость роста ФНО-α при переходе из одной стадии фиброза в другую по этой зависимости составила 20,55 пг/мкл.
Для 48 больных 2-й группы с ХГС зависимость ФНО-α от стадии фиброза печени выражалась уравнением линейной регрессии: у = 18,11х+122,44 с r=0,61. Скорость роста уровня ФНО-α в этой группе составила 18,11 пг/мкл и была ниже, чем в 1-й группе, с достоверной разницей в 2,44 пг/мкл (р=0,048), что, как и в случае с ХГВ, свидетельствует о меньшей скорости развития фиброзных изменений в печени у больных 2-й группы.
Проведенные исследования показали, что у больных ХГВ и ХГС казахской национальности уровень ФНО-α в крови был достоверно выше, чем у пациентов некоренной национальности Республики Казахстан. Генетические особенности в виде более высокого содержания ФНО-α в крови таких больных проявлялись в наибольшей степени на стадии фиброза печени F1 и не были связаны с этиологией вирусного гепатита. Уровень ФНО-α > 87 пг/мкл у больных ХГВ и ХГС на стадии фиброза F1 по шкале METAVIR позволял прогнозировать риск прогрессирующего течения заболевания. У больных ХГВ и ХГС 2-й группы высокое содержание ФНО-α в крови на стадии F1 встречалось в 2,2 раза реже, чем у пациентов 1-й группы, т. е. развивалось значительно позже. Изучение r зависимости ФНО-α и скорости роста фиброза печени выявило более высокую скорость роста заболевания у пациентов 1-й группы (18,93 при ХГВ и 20,55 при ХГС) по сравнению с пациентами 2-й группы (15,33 при ХГВ и 18,11 при ХГС). Сохранявшееся на протяжении 48 нед повышение ФНО-α при ХГВ и ХГС являлось неблагоприятным прогностическим фактором формирования и прогрессирования фиброза печени и, с точки зрения тактики ведения больного, требовало проведения пункционной биопсии печени с целью исключения вирусного цирроза.
Выводы
1. Генетическим фактором риска развития цирроза печени при ХГВ и ХГС являлся более высокий уровень ФНО-α у больных 1-й группы.
2. С ростом ФНО-α наблюдалось усиление структурных изменений ткани печени в виде роста стадии фиброза.
3. У больных ХГВ и ХГС 1-й группы скорость повышения уровня ФНО-α достоверно коррелировала со скоростью развития фиброзных изменений в печени и была выше, чем у представителей 2-й группы.
4. Уровень ФНО-α > 87 пг/мкл у больных ХГВ и ХГС на стадии фиброза печени F1 по шкале METAVIR позволял прогнозировать риск прогрессирующего течения заболевания.


