Хронический гепатит С (ХГС) является одной из наиболее серьезных проблем российского здравоохранения в связи с широким распространением, потенциальной угрозой жизни больных, а также отсутствием государственных программ противовирусного лечения. Россия входит в десятку стран-лидеров по распространенности хронической инфекции, вызванной вирусом гепатита С (ВГС) [1]. Общее число больных ХГС в Российской Федерации составляет на сегодняшний день 2,5–3,2 млн человек [2], из которых более половины инфицированы ВГС генотипа 1 [3]. До 2011 г. единственным вариантом противовирусного лечения ХГС оставалась комбинированная двойная терапия пегилированными интерферонами в сочетании с рибавирином (ПегИФН/РБВ), которая наименее эффективна у больных с ВГС генотипа 1 и продвинутыми стадиями фиброза печени [4, 5]. Разработка препаратов прямого противовирусного действия (ПППД) привела к революционным изменениям в лечении ХГС и открыла новые перспективы перед пациентами, ранее не имевшими шансов на излечение. Включение ПППД в сочетании с ПегИФН/РБВ в схемы тройной терапии ХГС, вызванного вирусом генотипа 1, значительно (до 69–85%) повысило их эффективность, но не улучшило безопасности и качества жизни пациентов во время лечения [6–8]. Появившиеся в 2012 г. данные об эффективности безинтерфероновых режимов (безИФН-режимы) противовирусной терапии (ПВТ) знаменовали начало новой, «безинтерфероновой» эры лечения ХГС: с 2014 г. по результатам клинических исследований началась регистрация безИФН-режимов и отдельных их компонентов в Европе, США, Японии и других странах.
В настоящем обзоре представлены данные об основных классах ПППД, а также результаты клинических исследований эффективности и безопасности безИФН-режимов ПВТ.
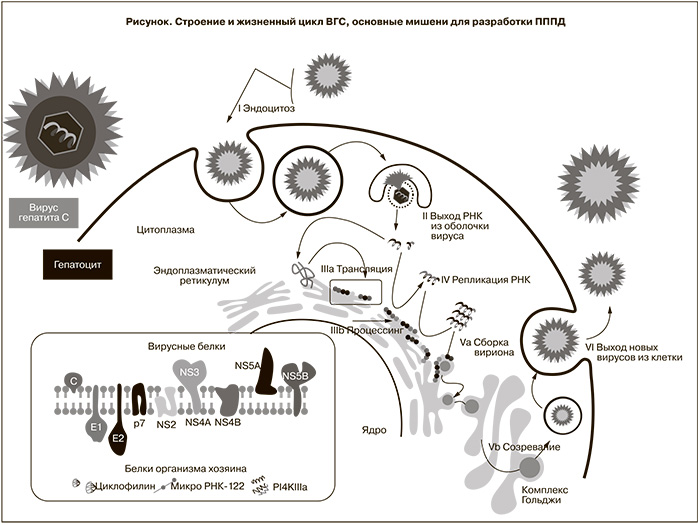
ВГС – оболочечный РНК-содержащий вирус размером около 25 нм, принадлежит к семейству Flaviviridae, роду Hepacivirus [9]. Жизненный цикл ВГС начинается со связывания вируса с рецепторами, проникновения в клетку хозяина и слияния. В результате растворения вирусного нуклеокапсида освобождается вирусная РНК с положительной полярностью, которая имеет одну открытую рамку считывания и кодирует единственный белок-предшественник, называемый полипротеином (см. рисунок). Полипротеин состоит из 3008–3037 аминокислотных остатков и расщепляется пептидазами клетки-хозяина, а также аутопротеазой NS2 и сериновой протеазой NS3-4A ВГС до образования структурных и неструктурных зрелых вирусных белков, которые выполняют различные функции в жизненном цикле вируса [9].
Структурные белки являются компонентами вириона: капсидный белок С образует нуклеокапсид, гликопротеины оболочки E1 и E2 являются рецепторами для прикрепления вируса и проникновения в клетку, p7 (виропорин) – гидрофобный белок, вероятно, формирует ионные каналы в вирусной липидной мембране и играет важную роль в репликации вируса [10]. Шесть неструктурных белков входят в состав комплекса репликации вируса. NS2 – цинк-зависимая аутопротеаза, разрезающая белки NS2 и NS3, высвобождает NS3 (сериновую протеазу, хеликазу, нуклеотидтрифосфатазу), которая образует устойчивую нековалентную связь со своим кофактором – протеином NS4А. Протеаза NS3/4A является высококонсервативной среди большинства штаммов ВГС [9, 11]. Фермент расщепляет соединения между NS3/NS4A, NS4A/NS4B, NS4B/NS5A и NS5A/NS5B. Помимо расщепления полипротеина протеаза NS3/4A встраивается в репликационный комплекс РНК ВГС и за счет геликазной активности обеспечивает раскручивание вирусной РНК. В пораженной клетке белок NS3 также инактивирует белки-адаптеры TRIF и Cardif противовирусных сигнальных путей врожденного иммунитета человека, опосредованных соответственно через toll-подобные рецепторы и цитозольные рецепторы RIG-I РНК-геликазы, и таким образом способствует персистенции ВГС [11]. Подавление активности NS3 способствует восстановлению поврежденных механизмов адаптивного иммунного ответа и элиминации ВГС. Функции NS4B до конца не ясны. Установлено, что данный протеин может связываться с другими неструктурными белками, участвует в гиперфосфорилировании NS5A и играет важную роль в формировании комплекса репликации. NS5A, ассоциированный с мембраной фосфопротеин, не являясь ферментом, играет роль ключевого регулятора репликации ВГС [12]. Этот белок является многофункциональным, состоит из трех структурных доменов. За счет домена I NS5A модулирует репликацию вируса путем взаимодействия с другими вирусными протеинами и определенными белками клетки-хозяина для образования репликационного комплекса. В области домена II содержится участок, определяющий чувствительность клетки к ИФН, сокращенно называемый ISDR (interferon sensitivity determining region), который модулирует ответ на интерферонотерапию [13]. Домен III, предположительно, участвует в сборке вирусных частиц. Белок NS5B (РНК-зависимая РНК-полимераза) катализирует репликацию вирусной РНК в клетке хозяина и является основным компонентом репликативного комплекса ВГС. Пространственная структура данного протеина напоминает правую кисть руки человека – выделяют субдомены «ладонь», «пальцы», «большой палец». Активный центр расположен в основании «ладони» [14]. Вирусный репликативный комплекс располагается в специализированном домене эндоплазматического ретикулума клетки-хозяина, который участвует в липидном обмене. Основная часть образованных вирусных частиц (около 80%) покидает клетку в виде комплекса с липопротеинами.
Данные о жизненном цикле ВГС позволили рассматривать все белки, входящие в полипротеин, в качестве потенциальных мишеней для разработки ПППД [11, 12, 14, 15]. Тем не менее, в связи с ключевым значением для репликации, предметом особого изучения стали ВГС-индуцированные ферменты: NS3/4A (сериновая протеаза), полимераза NS5B, а также ключевой регулятор репликации вируса – NS5А. Большая часть известных препаратов является ингибиторами вышеуказанных белков. В процессе исследований также возникло понимание необходимости применения комбинаций ПППД для преодоления вирусной резистентности, которая может стать значимой проблемой в связи с особенностями репликации возбудителя. ВГС размножается с огромной скоростью – за сутки в организме человека воспроизводится около 1012 вирионов [16, 17]. При наличии ошибающейся полимеразы в среднем за цикл репликации вируса происходит одна случайная мутация. Высокая скорость размножения ВГС означает ежедневное возникновение мутаций в каждом сайте вирусного генома. Таким образом, в организме пациента одновременно находится огромное количество квазивидов ВГС. Большинство мутаций не приводит к повышению жизнеспособности вируса. Однако некоторые мутантные варианты могут случайно оказаться более устойчивыми к противовирусному препарату, эффективному в отношении диких штаммов вируса, и в случае применения одного ПППД резистентный штамм будет размножаться быстрее, чем дикий, и вскоре станет доминирующим [17, 18].
Основные классы ПППД
ПППД (Direct-Acting Antivirals – DAAs) – вещества, которые специфическим образом нарушают репликацию вируса за счет прямого взаимодействия с вирусными протеинами или нуклеиновыми кислотами [15]. За основу их классификации взяты белки-мишени, с которыми непосредственно взаимодействуют препараты. Выделяют классы ингибиторов протеазы (ИП) NS3/4A, ингибиторов NS5A, ингибиторов полимеразы NS5B и другие.
ИП NS3/4A. Блокирование протеазы NS3/4A приводит к прекращению размножения вируса. Данный регион генома был первой мишенью для создания ПППД. ИП I поколения 1-й волны боцепревир и телапревир (табл. 1) эффективны только в отношении ВГС генотипа 1, имеют низкий барьер резистентности, часто вызывают нежелательные явления (НЯ), а также имеют широкий спектр лекарственных взаимодействий (метаболизм осуществляется через систему цитохрома P450 – CYP34A). Препараты были зарегистрированы для тройной терапии с ПегИФН/РБВ в США и Европе в 2011 г., в нашей стране – в 2013 г. В 2014 г. в РФ был зарегистрирован ИП NS3/4A I поколения 2-й волны симепревир с хорошим профилем безопасности, удобной схемой приема (1 таблетка в сутки), активный в отношении ВГС генотипов 1, 2 и 4, но все еще обладающий низким барьером резистентности как в виде перекрестной с телапревиром и боцепревиром замены аминокислот в положениях V36, R155, A156, D168, N54 и V170, так и в виде уникальной для симепревира замены в положении Q80K в протеазе NS3. Характеристики других представителей ИП I поколения 2-й волны (паритапревира, асунапревира, фалдапревир) сходны с характеристиками симепревира [15]. Представители II поколения ИП NS3/4A – MK-5172 (гразопревир) и АCH-2684 – обладают высокой активностью в отношении всех генотипов, включая генотип 3, и существенно более высоким, чем препараты первого поколения, барьером резистентности (табл. 2) [17, 18].
Ингибиторы полимеразы NS5B. Связываясь с РНК-зависимой РНК-полимеразой, ингибиторы NS5B нарушают жизненный цикл вируса [14, 19]. Данный класс препаратов делится на 2 группы: нуклеоз(т)идные и ненуклеоз(т)идные ингибиторы полимеразы NS5B. Участки для связывания с ПППД находятся в разных сайтах фермента.
Нуклеоз(т)идные аналоги. Мишенью для них является высококонсервативный для всех генотипов ВГС каталитический сайт фермента. Препараты данной группы прекращают синтез РНК, являясь ложными субстратами для ее сборки, характеризуются мощной противовирусной активностью в отношении всех генотипов (1–6), высоким барьером резистентности, низким потенциалом межлекарственных взаимодействий, небольшим числом описанных НЯ. История разработки нуклеоз(т)идных аналогов не была безоблачной. Во время клинических исследований IIа фазы для четырех препаратов данной группы были зарегистрированы случаи тяжелой клеточной токсичности [валопицитабин (гастроинтестинальная токсичность), R1626 (гематотоксичность – лимфопения), PSI-938 (гепатотоксичность), BMS-986094 (кардиальная токсичность)], что привело к остановке их изучения. Все вышеперечисленные препараты являлись аналогами гуанозина [20]. В связи с клеточной токсичностью FDA приостановила разработку препаратов с похожей структурой и подвергла тщательному изучению все нуклеоз(т)идные аналоги. Полученные результаты оказали негативное влияние на дальнейшее развитие этой группы препаратов. В данный момент в стадии клинических исследований находятся всего 2 – ACHN-3422 (Achillion), IDX-21437 (Idenix) [15].
Софосбувир (SOF), уридиновый нуклеоз(т)идный аналог – единственный, для которого завершены клинические исследования III фазы, в настоящий момент одобрен для применения в США, Европе и других странах. В клинических исследованиях SOF было пролечено в общей сложности около 3000 пациентов, в том числе с циррозом печени (ЦП) и ожидающих трансплантации печени. Вопреки предыдущему негативному опыту с гуанозиновыми аналогами препарат продемонстрировал отличный профиль безопасности без признаков токсичности [20].
Ненуклеоз(т)идные аналоги. Мишенью для них является 1 из 4 аллостерических сайтов полимеразы NS5B: 2 сайта располагаются в области так называемой «ладони» [дасабувир (DSV), ABT-072, сетробувир] и 2 – в области «большого пальца» (Thumb-16 – BMS-791325, TMC647055; Thumb-2 – ломибувир, GS-9669). Ненуклеоз(т)идные аналоги ингибируют начальную стадию синтеза РНК, обладают узкой направленностью (в основном действуют на генотип 1b), меньшей противовирусной активностью и низким барьером резистентности. В связи с этим дальнейшая разработка некоторых препаратов данной группы (делеобувир, филибувир, тегобувир) была остановлена [15, 21].
Ингибиторы NS5A. Связываясь с доменом I, ингибиторы NS5A блокируют репликацию вируса, вирусную сборку и высвобождение из клетки. Двойной механизм действия обеспечивает быстрое снижение вирусной нагрузки непосредственно после начала приема препаратов [22]. Ингибиторы I поколения эффективны в отношении ВГС генотипов 1 и 4, некоторые активны и в отношении генотипов 2 и/или 3, характеризуются низким барьером резистентности, особенно в отношении генотипов 1а и 3. Наиболее часто при секвенировании NS5A замены наблюдаются в положениях M28, Q/A30, L31, Y39. После неудачного лечения мутантные штаммы обнаруживаются в крови большинства пациентов. Даклатасвир, первый в своем классе, обладает высокой противовирусной пангенотипической активностью, может применяться в составе ИФН-содержащих и безИФН-режимов. В настоящее время он зарегистрирован в Европе и Японии. Остальные препараты I поколения [омбитасвир (OBV), ледипасвир (LDV), саматасвир и др.] были исследованы в качестве компонентов безИФН-режимов. LDV в комбинации с SOF был зарегистрирован 10 октября 2014 г. в США под торговым наименованием Harvoni (Gilead). Ингибиторы NS5A II поколения – MK-8742 (элбасвир), АСH-3102, GS-5816 – находятся в стадии клинических исследований. Им свойственны высокая активность в отношении всех генотипов и более высокий барьер резистентности [12, 15, 22].
Требования к безИФН-режимам терапии ХГС
Во время ПВТ снижение вирусной нагрузки происходит в 2 фазы. В первую фазу (1–3-й день лечения) происходит резкое подавление репликации вируса, сопровождающееся быстрым снижением вирусной нагрузки. В оставшееся время (вторая фаза) продолжается неуклонное постепенное снижение концентрации РНК ВГС вплоть до полного исчезновения вируса в результате как апоптоза инфицированных клеток, так и их излечения (утрата оставшимися инфицированными клетками способности к репликации вследствие деградации внутриклеточной РНК) [23]. Если на момент прекращения терапии в организме пациента все еще сохраняются инфицированные клетки, происходит рецидив заболевания [15]. Таким образом, успех безИФН-режимов ПВТ зависит от двух условий. С одной стороны, используемая комбинация должна иметь высокую противовирусную активность для эффективного подавления вирусной репликации в инфицированных клетках в первой фазе лечения, с другой – высокий барьер резистентности, чтобы обеспечить постоянное подавление размножения вирусов во второй фазе лечения и предотвратить селекцию резистентных штаммов с последующим вирусологическим прорывом.
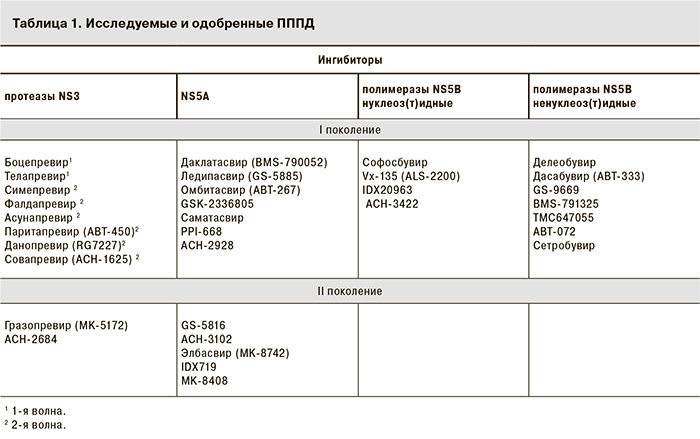
ПППД всех классов удовлетворяют первому условию (табл. 2) и обеспечивают снижение вирусной нагрузки на 3 и более десятичных логарифма в первые 3 дня приема препарата и ее дальнейшее постепенное снижение во второй фазе. В то же время их профиль резистентности существенно разнится. Высокий барьер резистентности является отличительной чертой всех представителей класса нуклеоз(т)идных ингибиторов NS5B. ИП NS3/4А I поколения, ненуклеоз(т)идные ингибиторы NS5B, ингибиторы NS5A I поколения обладают низким барьером резистентности. ИП NS3/4А, ингибиторы NS5A II поколения характеризуются уже значительно более высоким барьером резистентности [22]. Сочетая в безИФН-схеме препараты разных классов, можно предотвратить развитие лекарственной устойчивости (см. табл. 1). Варианты комбинаций могут быть следующими: 1) основной препарат из класса нуклеоз(т)идных ингибиторов NS5B в сочетании с одним или двумя препаратами с низким барьером резистентности; 2) комбинация трех препаратов I поколения разных классов с низким барьером резистентности (ИП NS3/4А, ненуклеоз(т)идный ингибитор NS5B, ингибитор NS5A); 3) сочетание двух препаратов, один из которых относится ко II поколению ИП NS3/4А или NS5A [24].
Результаты основных исследований безИФН-режимов лечения ХГС (эффективность, безопасность)
Первые сведения об эффективном применении безИФН-режимов лечения больных ХГС, вызванным ВГС генотипа 1, были опубликованы в 2012 г.: назначение комбинации ИП NS3/4A асунапревира с ингибитором NS5A даклатасвиром в течение 24 недель у 10 больных c отсутствием ответа («нулевой» ответ) на предшествующую двойную терапию ПегИФН/РБВ позволило достичь устойчивого вирусологического ответа (УВО) у 90% больных [25, 26]. Эффективность (УВО – 63,6%) и безопасность данной комбинации были также продемонстрированы в группе пациентов, имеющих противопоказания к ПВТ, включающей ИФН [27]. Затем в течение короткого периода были опубликованы результаты исследований II и III фазы целого ряда безИФН-режимов ПВТ ХГС, вызванного вирусом генотипов 1–4, которые не только превзошли все ожидания, но продемонстрировали целесообразность дальнейшей разработки и внедрения комбинаций с эффективностью более 90% [28]. На сегодняшний день все безИФН-режимы могут быть условно разделены на те, для которых регистрационные клинические исследования уже завершены, и находящиеся на разных стадиях исследований. Большинство безИФН-схем разрабатывались преимущественно для наиболее «трудного» для двойной терапии ВГС генотипа 1.
БезИФН-режимы терапии ХГС, вызванного вирусом генотипа 1
Режимы на основе ингибиторов полимеразы NS5B
SOF – нуклеоз(т)идный ингибитор полимеразы NS5B – единственный зарегистрированный препарат данной группы (GS-7977, ранее известный как PSI-7977), является пролекарством 2’-дезокси-2’-флюоро-2’-С-метилуридин монофосфат, которое в гепатоцитах превращается в активную форму – уридин трифосфат. Выведение препарата осуществляется в основном почками в виде неактивного нуклеозидного метаболита. При клиренсе креатинина более 30 мл/мин, а также при тяжелом поражении печени (цирроз) коррекции дозы SOF не требуется. Прием пищи не оказывает существенного влияния на фармакокинетику [20]. SOF как препарат с высоким барьером резистентности может применяться в качестве основного в комбинациях с ИП NS3/4A, ингибиторами NS5A и РБВ.
SOF и ингибиторы NS5A
SOF и LDV. Изначально высокая эффективность комбинации SOF 400 мг и ингибитора NS5A LDV 90 мг в одной таблетке (SOF/LDV) в сочетании с РБВ или без него у больных ХГС, вызванного ВГС генотипа 1, была показана в исследовании II фазы LONESTAR [28], в котором участвовал как больные, не получавшие ранее лечения («наивные») без ЦП (n = 60), так и пациенты с отсутствием ответа на предшествующую тройную терапию, включающую ИП (n = 40), у половины из которых был компенсированный ЦП. Эффективность в обеих группах составила от 95 до 100%. В 2014 г. были опубликованы результаты трех исследований III фазы (ION-1, ION-2, ION-3), в которых изучали эффективность и безопасность однократного приема SOF 400 мг/LDV 90 мг в одной таблетке в сочетании с РБВ или без него у больных ХГС, вызванным вирусом генотипа 1, различной длительности [29–31]. Частота УВО после 12 недель лечения у «наивных» пациентов в исследованиях ION-1 и ION-3 составила от 95 до 99%. Сокращение курса терапии до 8 недель в ION-3 привело к некоторой потере эффективности (УВО – 93–94%) за счет роста частоты рецидивов [31]. Результаты исследования показали равную эффективность схем с РБВ и без него при длительности лечения 8 и 12 недель у больных без ЦП. Исключение из схемы лечения РБВ снижало частоту НЯ [29–31]. В исследовании ION-2 изучали эффективность и безопасность четырех режимов лечения (SOF/LDV и SOF/LDV/РБВ в течение 12 и 24 недель) у пациентов, ранее получавших стандартную двойную или тройную терапию с ИП NS3/4A. Доля пациентов в исследовании с неудачей тройной терапии составила 52%, с субтипом 1а – 79%, генотипом не-СС по интерлейкину 28В (IL-28B) – 88%, ЦП в каждой группе – 20%. УВО через 12 и 24 недели терапии во всех группах был достигнут у 94–99% больных. Субанализ результатов при продолжительности лечения 12 недель выявил снижение эффективности у больных с ЦП в группе получавших SOF/LDV до 86% и в группе получавших SOF/LDV/РБВ – до 82%, в то время как у пациентов без ЦП – соответственно 95 и 100%. В обеих группах после 24 недель лечения частота УВО у больных с ЦП составила 99% [30].

SOF и даклатасвир (DCV). Эффективность комбинации SOF 400 мг в сутки и DCV 60 мг 1 раз в сутки изучали в исследовании AI444-040 у пациентов с ХГС, вызванным генотипами вируса 1, 2 и 3, а также у пациентов с генотипом 1, не ответивших на предыдущую тройную терапию с телапревиром или боцепревиром. «Наивные» пациенты получали терапию в течение 12 недель. УВО был достигнут у 100% больных, получавших SOF/DCV, и у 98% получавших SOF/DCV/РБВ. Больным, получавшим ранее тройную терапию (ПегИФН/РБВ/ИП NS3/4A), SOF/DCV и SOF/DCV/РБВ назначали в течение 24 недель. В результате все пациенты достигли УВО, несмотря на наличие неблагоприятных факторов (субтип 1а – у 80% больных, генотип не-СС по IL-28B – у 98%, F2 и более стадии фиброза – у 83%). Переносимость применявшейся комбинации у всех больных с ВГС генотипа 1 (n = 123) была хорошей: не было зарегистрировано случаев досрочного прекращения лечения, а серьезные НЯ наблюдали всего у двух (1,6%) больных [32]. Данная комбинация рекомендована экспертами Европейской ассоциацией по изучению печени (EASL, 2014) в качестве одной из опций безИФН-режимов терапии [33].
SOF и ИП
SOF и симепревир (SMV). Комбинация SOF 400 мг в сутки с SMV 150 мг в сутки в течение 12 недель также рекомендована EASL в 2014 г. в качестве одной из опций ПВТ ХГС, вызванного вирусом генотипа 1 [34, 35]. Для пациентов с отрицательными прогностическими факторами ответа на терапию (предшествующий «нулевой» ответ на ПВТ и/или ЦП) дополнительно рекомендовано назначение РБВ в дозе 1000 мг в сутки у больных с массой тела менее 75 кг или 1200 мг в сутки у больных с массой тела более 75 кг. В основе рекомендации лежат результаты клинического исследования II фазы COSMOS, в котором изучали безопасность и эффективность применения SOF в дозе 400 мг и SMV у 167 больных ХГС, вызванным вирусом генотипа 1, с РБВ или без него. Пациенты были разделены на 2 когорты. В первую были включены 80 больных с «нулевым» ответом на предшествующую терапию ПегИФН/РБВ со стадией фиброза F0–F2, у половины из которых заболевание было вызвано ВГС субтипа 1а с генетическим полиморфизмом Q80K до начала лечения, 94% больных имели аллель не-СС по IL-28B. Частота УВО через 12 недель составила от 79 до 96%. Субанализ выявил зависимость эффективности терапии от субтипа вируса и полиморфизма Q80K: у больных с субтипом 1b частота УВО через 12 недель составила 100%, у больных без полиморфизма – также 100%, в то время как среди больных с полиморфизмом Q80K – от 83 до 100%. В качестве прогностических факторов возможного отсутствия ответа на ПВТ SОF/SMV были определены наличие мутации Q80K у больных до начала лечения и аллель TT [34]. Вторая когорта (n = 87) включала «наивных» пациентов (n = 40) и больных с «нулевым» ответом на предшествующую терапию ПегИФН/РБВ (n = 47) с продвинутыми стадиями фиброза (F3 и F4 – компенсированный ЦП). Среди пациентов, прошедших 24-недельный курс лечения, эффективность в группе получавших двойную терапию SOF/SMV составила 100%, в группе получавших SOF/SMV/РБВ – 93%. При продолжительности терапии 12 недель частота УВО в обеих группах составила 93% (рецидивы были отмечены только у пациентов с ВГС субтипа 1а). Все пациенты с субтипом вируса 1b, как и в первой когорте, достигли УВО, независимо от продолжительности лечения. Наиболее распространенными НЯ в данном исследовании были головная боль, утомляемость и тошнота [35].
Таким образом, выраженное противовирусное действие и высокий порог резистентности позволяют в настоящее время выбирать SOF в качестве основы для многих безИФН-режимов, сочетая его с одним из препаратов другого класса (не принадлежащих к ингибиторам NS5B) с РБВ или без него.
БезИФН-схемы ИП NS3/4A и ингибиторов NS5A
DCV и асунопревир (ASV). В настоящее время доступны результаты двух исследований III фазы у больных с ВГС генотипа 1b – японского многоцентрового открытого [36] и международного многоцентрового рандомизированного плацебо-контролируемого мультикогортного исследования HALLMARK-DUAL [37]. В обоих исследованиях препараты назначали перорально по схеме: DCV 60 мг 1 раз в сутки + ASV 100 мг 2 раза в сутки. Изначально схема DCV/ASV была рассчитана на лечение «трудных» пациентов, поэтому в японском многоцентровом открытом исследовании участвовало 135 «наивных» больных ХГС, вызванным вирусом генотипа 1b, которым не могла быть назначена терапия, включающая ИФН, и 87 больных с «нулевым» и частичным ответом на двойную терапию ПегИФН/РБВ. Продолжительность лечения – 24 недели. УВО в первой группе составил 87,4%, во второй – 80,5%. В группе больных ЦП (10% включенных пациентов) УВО достигал 90,9% [36]. В 2014 г. закончилось международное исследование HALLMARK-DUAL (n = 747). В когорту ранее не получавших лечения пациентов (группа активного режима) было включено 205 больных; в когорту пациентов, которым по тем или иным причинам не могла быть назначена терапия, включающая ИФН, – 235, в когорту ранее не ответивших на двойную терапию ПегИФН/РБВ – 205. У «наивных» пациентов длительность курса лечения составляла 12 недель, в остальных когортах – 24 недели. Через 12 недель УВО наблюдали у 90% «наивных» больных, 82% ранее не отвечавших на двойную терапию и 82% больных с противопоказаниями к терапии, включающей ИФН [37]. Частота серьезных НЯ составила соответственно 6, 5 и 7%. Включение в схему третьего препарата, ненуклеоз(т)идного ингибитора NS5B BMS-791325, по данным клинических исследований IIa фазы, позволило повысить ее эффективность до 94% без изменения параметров безопасности лечения [38, 39].
Гразопревир (MK-5172) и элбасвир (MK-8742). В недавно завершившемся исследовании IIb фазы C-WORTHY были продемонстрированы высокая эффективность и безопасность комбинации ИП NS3-4A II поколения MK-5172 с ингибитором NS5A II поколения MK-8742 у «трудных» категорий пациентов с ХГС, вызванным вирусом генотипа 1. В исследование было включено 123 «наивных» пациентов с ЦП и 130 – с «нулевым» ответом на предшествующую терапию ПегИФН/РБВ, из них 37% – с ЦП. Доля больных с ВГС субтипа 1а составила 64%. Препараты (MK-5172 100 мг и MK-8742 50 мг) назначали в составе одной таблетки 1 раз в день в сочетании с РБВ или без него в течение 12 или 18 недель. Частота достижения УВО через 12 недель составила от 90 до 97%, независимо от исходных характеристик пациентов и вируса. У больных с ВГС субтипа 1b эффективность терапии была выше – 99%. Случаи неудачи лечения были зарегистрированы только у больных с субтипом 1а. По безопасности такая схема была сопоставима с другими безИФН-режимами. Наиболее распространенными НЯ были утомляемость (26%), головная боль (23%) и слабость (14%) [40]. В настоящее время изучение данной комбинации продолжено в клинических исследованиях III фазы.
Многокомпонентные безИФН-режимы терапии
[Паритапревир/r + омбитасвир + дасабувир (комбинация «3D»)] ± РБВ. БезИФН-режим для лечения ХГС, вызванного вирусом генотипа 1, разработанный компанией «AbbVie», представляет собой комбинацию трех ПППД: фиксированная доза ИП NS3-4A паритапревира (ранее ABT-450) 150 мг, бустированного ритонавиром (PTV/r) в дозе 100 мг, и ингибитора NS5A омбитасвира (OBV) 25 мг в одной таблетке (OBV/PTV/r) 1 раз в сутки и ненуклеоз(т)идного ингибитора полимеразы DSV для приема 2 раза в сутки в дозе 250 мг в сочетании с РБВ или без него («3D» или OBV/PTV/r + DSV]. РБВ во всех исследованиях применяли в дозе 1000 мг в сутки при массе тела менее 75 кг или 1200 мг при массе тела более 75 кг. Совместное применение данных препаратов позволило преодолеть проблему устойчивости – риск возникновения резистентных штаммов был минимален.
Впервые эффективность 12-недельного курса OBV/PTV/r + DSV в сочетании с РБВ была показана в исследовании II фазы AVIATOR, где частота УВО превышала 90%, независимо от демографических характеристик пациентов, генотипа IL28-В, субтипа вируса, стадии фиброза, вирусной нагрузки и предыдущего опыта лечения. В исследовании не было зарегистрировано серьезных НЯ, связанных с приемом исследуемых препаратов, а частота их не превышала 20% [41]. В дальнейшем эффективность и безопасность комбинации 3D была изучена у разных категорий пациентов с ХГС, вызванного вирусом генотипа 1, в шести клинических исследованиях III фазы (SAPPHIRE-I, SAPPHIRE-II, PEARL-II, PEARL-III, PEARL-IV, TURQUOISE-II) с общим числом пациентов 2300 человек [42–46].
Эффективность 12-недельной терапии 3D при ХГС, вызванном вирусом субтипа 1b, у ранее не получавших лечения пациентов (исследования SAPPHIRE-I, PEARL-III) составила 98–99%, независимо от наличия или отсутствия в схеме РБВ [42, 43]. При ХГС, вызванном вирусом субтипа 1а (SAPPHIRE-I и PEARL-IV), включение в схему лечения РБВ оказывало положительное влияние на частоту достижения УВО через 12 недель терапии (90% в группе получавших 3D и 97% в группе получавших 3D/РБВ) за счет снижения частоты вирусологического прорыва (7,8 и 2% соответственно).
Эффективность 12-недельного лечения в режиме 3D и 3D/РБВ у больных без ЦП, ранее не ответивших на терапию, была оценена в двух исследованиях III фазы – PEARL-II и SAPPHIRE-II [44, 45]. Исследование SAPPHIRE-II было плацебо-контролируемым, из 394 больных в группу активного режима (3D/РБВ) было включено 297 человек с ВГС субтипов 1а и 1b с разными вариантами предыдущего ответа на двойную терапию. Частота УВО через 12 недель в группе активного лечения в SAPPHIRE-II составила 96,3%, независимо от подтипа ВГС (для генотипа 1а – 96,0%, 1b – 96,7%). Двойной плацебо-контролируемый дизайн исследования позволил определить истинную частоту НЯ в группе активного лечения: среди НЯ, регистрировавшихся более чем у 10% больных, существенно чаще выявлялся только зуд; среди НЯ, возникавших менее чем у 10% – анемия, снижение гемоглобина и рвота. Снижение уровня гемоглобина от 80 до 100 г/л наблюдалось у 4,7% больных, 65–80 г/л – у 0,3%. Уровень менее 65 г/л не был зарегистрирован ни в одном случае [44].
Эффективность и безопасность безИФН-схемы 3D/РБВ у больных с ЦП класса А по Чайлду–Пью были продемонстрированы в отдельном клиническом исследовании III фазы TURQUOISE-II. В нем приняли участие 380 больных: 160 «наивных» и 220 пациентов с неудачей предшествующей двойной терапии ПегИФН/РБВ, из которых 75% демонстрировали ранее «нулевой» ответ на лечение. Как у «наивных», так и у ранее леченных больных изучали зависимость эффективности терапии от ее длительности (12 или 24 недели). Все «наивные» пациенты с субтипом вируса 1b, независимо от срока лечения, достигли УВО. В группе ранее не отвечавших на лечение общая частота УВО у больных с субтипами ВГС 1а и 1b после 12 недель ПВТ составила 90,2%, после 24 недель – 96,9%. Субанализ эффективности показал, что основным условием достижения УВО было наличие субтипа 1b ВГС: 98,7% больных с неудачей двойной терапии в прошлом достигли УВО через 12 недель, независимо от длительности курса. Более низкой была вероятность достижения УВО при ВГС субтипа 1а и предшествующем «нулевом» ответе на ПВТ [46]. Профиль безопасности комбинации 3D/РБВ у больных с ЦП был намного лучше, чем при ИФН-содержащих режимах: серьезные НЯ наблюдались у 5–6% больных, а досрочное завершение лечения в связи с развитием НЯ произошло в 2% случаев [6, 46]. Частота анемии не отличалась от таковой у больных без ЦП в других клинических исследованиях III фазы, где применялся аналогичный режим. Гематологические нарушения в виде анемии наблюдались у 62% больных. У 53% пациентов уровень гемоглобина был выше 100 г/л, у 8% – от 80 до 100 г/л и только у 1% – ниже 80 г/л. Коррекцию анемии при необходимости успешно осуществляли путем снижения дозы РБВ без потери эффективности.
По результатам всех исследований III фазы эффективность терапии 3D ± РБВ у больных с ВГС генотипа 1b составила 98,6% [47], что позволяет рассчитывать на эрадикацию вируса практически у всех больных, которым будет назначено лечение, в связи с доминированием в России этого генотипа [3]. Исключение из схемы РБВ значительно расширяет круг потенциальных кандидатов на ПВТ за счет лиц с тяжелой сопутствующей патологией сердечно-сосудистой системы, легких, почек, гемоглобинопатиями. В то же время для больных с ВГС генотипа 1а включение в схему РБВ является обоснованным, так как позволяет избежать вирусологического прорыва и повысить частоту УВО с 90 до 97%.
БезИФН-режимы терапии ХГС, вызванного ВГС генотипов 2 и 3
Среди зарегистрированных ПППД пангенотипическим действием обладают SOF и DCV. Эти препараты могут применяться в сочетании с рибавирином для лечения больных с ВГС генотипов 2 и 3. Для пациентов, инфицированных ВГС генотипа 2, EASL рекомендует комбинацию софосбувира в дозе 400 мг в сутки с РБВ в дозе 1000 мг в сутки при массе тела менее 75 кг или 1200 мг при массе тела более 75 кг в течение 12 недель [33]. Эффективность данного режима ПВТ в клинических исследованиях составила 93–97%. В исследовании FISSION УВО был достигнут у 97% «наивных» пациентов с ВГС генотипа 2 [48], в то время как у больных с ЦП – в 91% случаев. В исследовании III фазы Valence УВО у «наивных» и ранее получавших лечение пациентов составил 93% [49]. Более «скромные» результаты были получены у больных с ВГС генотипа 3: в исследовании FISSION эффективность 12-недельного курса лечения SOF/РБВ для «наивных» пациентов составила 67%. С учетом низкой эффективности такого курса дизайн начавшегося в то же время исследования Valence, в котором изучали эффективность данной комбинации у «наивных» и не ответивших ранее на терапию пациентов с ВГС генотипов 2 и 3, был скорректирован. Подавляющее большинство больных с ВГС генотипа 3 (n = 250) прошли 24-недельный курс терапии. Через 12 недель в группе пациентов, ранее не получавших лечения (n = 105), УВО составил 93%, в том числе у больных с ЦП – 92%. В группе ранее не ответивших на терапию (n = 145) УВО достигли всего 79% пациентов, в том числе в группе без ЦП – 87% (87 из 100), с ЦП – 60% (27 из 45) [49]. Исходя из полученных результатов, при ВГС генотипа 3 данную опцию не следует рассматривать как оптимальную для повторного лечения больных с ЦП. Альтернативой может служить комбинация SOF/DCV с эффективностью от 86 до 100% [33].
Таким образом, с 2014 г. для лечения ХГС в мире начали успешно применять безИФН-режимы ПВТ. Высокая (при субтипе вируса 1b приближающаяся к 100%) эффективность, минимальное влияние на качество жизни позволят успешно лечить всех больных: ранее не получавших лечения и не ответивших на предыдущие курсы ПВТ, с ЦП и без него, имеющих противопоказания к лечению ИФН. Частота достижения УВО при назначении комбинаций ПППД практически не зависит от негативных прогностических факторов пациента и вируса, которые определяют эффективность ПВТ на основе ИФН. Определенное значение для выбора длительности лечения может иметь наличие у пациента ЦП.


