Предупреждение распространения ВИЧ-инфекции продолжает оставаться одной из важнейших задач в России и в мире [1,2]. Одним из главных препятствий на пути ее решения является резистентность ВИЧ к антиретровирусной терапии (АРТ). Она возникает, если вирус мутирует и снижается сродство действующих веществ лекарственных препаратов к соответствующим белкам-мишеням вируса. Резистентность разделяют на приобретенную, то есть возникшую за счет мутаций вируса на фоне приема АРТ, и первичную, то есть переданную ранее не инфицированному человеку. Оба вида резистентности снижают эффективность терапии у отдельного пациента и в популяции в целом. Согласно данным, представленным на сайте www.hivresist.ru «Анализ Российской базы данных лекарственной устойчивости ВИЧ» на конец 2020 г. [3], была проведена оценка распространенности мутаций, важных для надзора за первичной резистентностью ВИЧ из списка SDRM. В результате проведенного анализа хотя бы одна надзорная мутация лекарственной устойчивости была обнаружена у 120 (5,5%) пациентов. Наиболее часто встречались мутации к ИП (M46I/L, I58V), НИОТ (M184V/I, M41L), ННИОТ (K103N/S, G190S). Важно отметить, что замена M184V сама по себе не вызывает перекрестной устойчивости к другим НИОТ, включая ZDV, ddI, ddC и ABC, поэтому ее присутствие не ограничивает возможности применения этих препаратов в последующих схемах АРТ. Обнаружение M184V/I не является противопоказанием к продолжению лечения ламивудином (3ТС) или эмтрицитабином (FTC), если в схеме присутствуют зидовудин (AZT), тенофовир (TDF) или ставудин (d4T), поскольку чувствительность к этим препаратам при наличии M184V/I повышается, сохраняя способность схемы в целом значительно снижать вирусную нагрузку (ВН) [4].
Также ключевым фактором для адекватной вирусной супрессии и снижения риска возникновения резистентности является высокая приверженность пациента лечению. При нарушении режима приема АРТ в организме возникают благоприятные условия для развития резистентности. Важность приверженности пациентов АРТ отмечает ВОЗ, которая рекомендует считать пороговым значением 95% уровень приверженности, так как он обеспечивает наилучший вирусологический ответ на проводимую терапию. Отечественные клинические рекомендации предполагают ряд шагов, направленных на улучшение качества и эффективности АРТ и повышение приверженности ВИЧ-инфицированных пациентов, в частности, использование современных комбинированных АРВ- препаратов (АРВП).
Доравирин (DOR), относящийся к классу ННИОТ, был зарегистрирован в России в 2019 г. для лечения взрослых пациентов с ВИЧ-инфекцией в двух формах: DOR (100 мг) для применения в комбиниации с другими АРВП и доравирин + ламивудин + тенофовира дезоксипроксил фумарат (100 мг + 300 мг + 300 мг) в комбинированной форме (DOR/3TC/TDF)1,2.
Отличная от других ННИОТ более гибкая химическая конформация DOR позволяет ему связываться с белком-мишенью, избегая взаимодействия с кодонами, наиболее подверженными изменениям в результате появления мутаций в гене обратной транскриптазы. Благодаря этому DOR имеет другой по сравнению с препаратами класса ННИОТ профиль резистентности. Например, положение DOR внутри места связывания находится далеко от кодона Y181, поэтому любая мутация в этом кодоне будет иметь незначительное влияние на связывание и активность DOR. Также препарат связывается с главной цепью кодона K103, а не с боковой цепью, поэтому любая мутация в положении 103 не окажет влияния на связывание DOR, и активность препарата будет сохраняться [5]. Уникальный профиль резистентности DOR был подтвержден в исследованиях in vitro, в нескольких крупных рандомизироанных клинических исследованиях среди пациентов, получавших и не получавших АРТ, в том числе с первичной резистеностью, а также в реальной клинической практике. DOR сохранял противовирусную активность в исследованиях in vitro против штаммов ВИЧ-1, резистентных к ННИОТ первого [эфавиренз (EFV) и невирапин (NVP)] и второго [этравирин (ETR) и рилпивирин (RPV)] поколения, содержащих мутации резистентности K103N, Y181C, G190A, E138K [6]. В двух крупных рандомизированных клинических исследованиях (DRIVE-FORWARD и DRIVE-AHEAD) среди 747 ВИЧ-1 инфицированных пациентов, не получавших ранее АРТ, частота развития резистентности к DOR составила 0,9% за 48 нед. исследования [7], а в исследовании DRIVE-SHIFT у 223 пациентов с неопределяемым уровнем РНК ВИЧ-1, в том числе с мутациями резистентности K103N, Y181C, G190A, переключенных на DOR/3TC/TDF, резистентность к DOR не развилась ни у одного пациента за 48 нед. исследования [8]. Комбинация DOR/3TC/TDF показала вирусологическую эффективность на протяжении 96 нед. терапии в исследовании DRIVE-BEYOND у пациентов, инфицированных ВИЧ-1, ранее не получавших лечения, при наличии у них первичных мутаций резистентности к ННИОТ K103N и G190A на момент включения в исследование [9]. Результаты ретроспективного анализа базы данных, включающей 9764 последовательности гена обратной транскриптазы от ВИЧ-1-инфицированных пациентов в Европе, ранее не получавших АРТ, показали, что первичная резистентность к DOR встречается реже (1,4%), чем к другим ННИОТ первого и второго поколения, таким как EFV (4,3%), NVP (4,3%), ETR (11,7%) и RPV (7,7%) [10].
Данные по оценке распространенности мутаций резистентности к DOR в России в настоящее время отсутствуют, а клинический опыт применения этого препарата ограничивается участием российских пациентов в клинических исследованиях фазы III DRIVE-FORWARD, DRIVE-AHEAD и DRIVE-SHIFT. В данной публикации мы хотели поделиться опытом применения DOR в комбинации с другими АРВП в рутинной клинической практике у сложных пациентов, имеющих в анамнезе длительный опыт АРТ (в среднем 8–10 лет) и 3 и более схем АРТ. Особый профиль резистентности DOR позволил предположить, что препарат будет эффективен у пациентов с мутациями резистентности к другим ННИОТ и может быть использован в схемах терапии у пациентов с отмеченной в анамнезе лекарственной устойчивостью к двум и более классам АРВП. При сохраненной чувствительности к TDF особый интерес представляет cхема из комбинированного препарата DOR/3TC/TDF в сочетании с DTG, состоящая из двух таблеток однократного приема, позволяющаяя значительно сократить количество ежедневно принимаемых таблеток и повысить комплаентность терапии. В этой схеме сохраняются 3 активных препарата, а поддерживаемая 3ТС мутация M184V, повышая чувствительность к TDF и обусловливая снижение фитнеса вируса, позволяет быстрее подавить репликацию ВИЧ до неопределяемых значений.
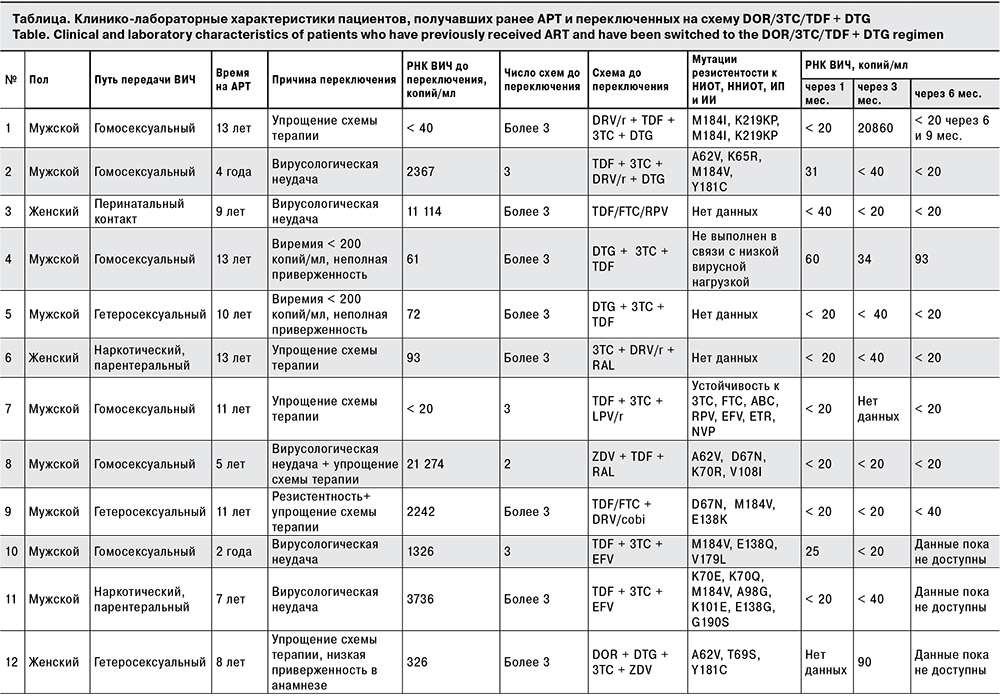
С августа 2020 г. по настоящее время в Московском областном центре по профилактике и борьбе со СПИД и инфекционными заболеваниями продолжается наблюдение за 12 ВИЧ-инфицированными пациентами, получающими режим АРТ на основе DOR – DOR/3TC/TDF + DTG. В таблице представлены клинические характеристики пациентов, переключенных на схему DOR/3TC/TDF + DTG. Среди находящихся под наблюдением пациентов преобладали молодые мужчины (n = 9; средний возраст – 38 лет) с гомосексуальным путем инфицирования ВИЧ. У 3 пациентов (1 женщины и 2 мужчин) диагностирован хронический гепатит С. В большинстве случаев причиной переключения на схему DOR/3TC/TDF + DTG были вирусологическая неудача или продолжающаяся остаточная виремия (50–200 копий/мл), или упрощение схемы АРТ, подобранной в соответствии с анализом на резистентность, для повышения комплаентности. Через 1 мес. после переключения у 8 из 12 пациентов, а через 6 мес. – у 8 из 9 пациентов, данные которых по РНК ВИЧ-1 были доступны, достигнута неопределяемая ВН. У пациента № 4 сохранялась остаточная виремия до и после смены терапии. С одной стороны, можно предположить, что пациент имеет неполную комплаентность: на протяжении лечения ВИЧ-инфекции с 2009 г. он неоднократно бросал или самостоятельно изменял схему АРТ. На фоне одного из прерываний схемы терапии в 2013 г. возникла иммунодепрессия (надир CD4+-лимфоцитов – 11 клеток/мкл; уровень РНК ВИЧ-1 – 3 млн копий/мл), присоединилась цитомегаловирусная инфекция, возник цитомегаловирусный ретинит с исходом в слепоту. Возможно, в этом случае мог бы быть полезен тест оценки уровня АРВП в сыворотке крови для прояснения ситуации. С другой стороны, учитывая давность заболевания ВИЧ-инфекцией, глубокую иммуносупрессию в анамнезе, наличие активации цитотоксического звена иммунитета в настоящее время после 4 лет непрерывного лечения (соотношение CD4/CD8 = 0,45), можно предположить ограниченную функциональную активность иммунной системы в процессе сдерживания репликации ВИЧ. У 3 пациентов данные по РНК ВИЧ-1 на 6 мес. пока не доступны. Наибольший интерес представляет пациент № 1, который прервал АРТ через 2 мес. после переключения в результате заболевания COVID-19, постковидного синдрома, последовавших когнитивных нарушений и отсутствия препаратов на руках. Схема терапии DOR/3TC/TDF + DTG была возобновлена через 2 мес. после перерыва. Для контроля эффективности новой схемы пациенту был сделан тест для определения ВН через 3 дня после назначения схемы. По результатам теста концентрация РНК ВИЧ-1 снизилась на 0,5 lg за 3 дня (с 20860 до 6665 копий/мл). Через 1 мес. после возобновления схемы у пациента достигнута неопределяемая ВН, которая сохраняется в течение 11 мес. (по настоящее время).
Требуется дальнейшее наблюдение за пациентами.
Заключение
Подбор режима терапии для ВИЧ-инфицированных пациентов с множественными переключениями схем АРТ представляется сложной задачей, особенно при невозможности проведения теста для определения резистентности ВИЧ к АРТ из-за отсутствия виремии. Наше наблюдение показало, что режим DOR/3TC/TDF + DTG может быть возможной опцией выбора как для пациентов с вирусологической неудачей и мутациями резистентности, так и для пациентов с остаточной виремией, которым требуется сократить ежедневное количество таблеток и повысить комплаентность принимаемой терапии.


