В практической медицине с каждым годом возрастает роль лабораторной диагностики как одного из основных методов верификации диагноза и инструмента мониторинга эффективности проводимой терапии. До настоящего времени «золотым стандартом» диагностики большинства паразитарных болезней является паразитоскопическое исследование: макроскопическое исследование паразитов или их фрагментов, микроскопия биологических сред с использованием специальных методов исследования материала [1]. Убедительным подтверждением диагноза ларвального гельминтоза может служить обнаружение возбудителя при микроскопии биоптатов (мышц плеча или голени при трихинеллезе; печени, легких при токсокарозе). Но этот, несомненно, самый достоверный метод мало приемлем из-за своей травматичности и потенциальной опасности при проведении. Альтернативой паразитоскопическим методикам при диагностике тканевых гельминтозов стали иммунологические методы, наиболее популярным из которых является иммуноферментный анализ (ИФА) для обнаружения специфических иммуноглобулинов разных классов к возбудителям паразитозов. По сравнению с другими методами детекции антигенов и антител он обладает рядом преимуществ, которые обусловили его широкое применение во всех областях медицины. Однако при интерпретации результатов ИФА следует принимать во внимание такие естественные ограничения данного метода, как генетическая неоднородность населения, наличие лиц с низким уровнем антителообразования на антигены паразита или же перекрестные реакции с антигенами человека и возбудителя, а также длительно циркулирующие анамнестические антитела, сформировавшиеся вследствие ранее перенесенной инвазии [2]. Неверная интерпретация результатов ИФА нередко приводит к их ошибочной трактовке и необоснованному назначению терапии.
Целью исследования явилось определение диагностической значимости существующих методов верификации гельминтозов для оптимизации их лабораторной диагностики.
Материалы и методы
За период 2013–2016 гг. в клинике инфекционных и паразитарных болезней ФБУН «Ростовский НИИ микробиологии и паразитологии» Роспотребнадзора был проведен анализ 1500 медицинских карт стационарных больных. Для верификации диагноза паразитарной инвазии всем больным параллельно назначали паразитоскопические и серологические исследования, обследование проводили многократно с применением специальных методов лабораторной диагностики. Использовали стандартные методики, рекомендованные существующими нормативно-методическими документами: метод нативного и окрашенного мазков, метод эфир-формалиновой седиментации, метод обогащения по Берману в разных модификациях, метод исследования материала из перианальных складок. Для иммунологического обследования пациентов клиники использовали диагностические тест-системы «Токсокара-IgG-ИФА-БЕСТ», «Эхинококк-IgG-ИФА-БЕСТ», «Описторхоз-IgG-ИФА-БЕСТ», «Описторхоз-IgМ-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Кольцово, Россия) Исследования сывороток крови проводили методом ИФА в соответствии с инструкциями к тест-системам и руководствуясь МУК 3.2.1173-02 «Серологические методы лабораторной диагностики паразитарных заболеваний». Статистическую обработку полученных данных производили с помощью программы SPSS Statistics 23.0. В соответствии с характером исследуемых показателей и задачами исследования использовали бинарную логистическую регрессию (ROC-анализ), коэффициент корреляции Пирсона.
Результаты
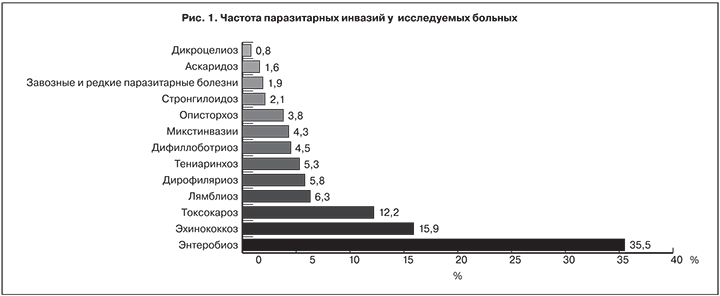
 В структуре паразитарных инвазий преобладал энтеробиоз (35,5% пациентов). Больные эхинококкозом различных локализаций, множественным, рецидивным и резидуальным составили 15,9%, пациенты с токсокарозом – 12,2%. Доля пациентов с другими паразитарными болезнями была значительно меньше (рис. 1).
В структуре паразитарных инвазий преобладал энтеробиоз (35,5% пациентов). Больные эхинококкозом различных локализаций, множественным, рецидивным и резидуальным составили 15,9%, пациенты с токсокарозом – 12,2%. Доля пациентов с другими паразитарными болезнями была значительно меньше (рис. 1).
У 27 (4,3%) больных отмечалась сочетанная инвазия: энтеробиоз и аскаридоз, энтеробиоз и дифиллоботриоз, энтеробиоз и лямблиоз, энтеробиоз и токсокароз, эхинококкоз и дикроцелиоз, дифиллоботриоз и описторхоз.
При однократном исследовании материала из перианальных складок пациентов яйца остриц выявляли у 56,1% больных, при двукратном – у 81,9%, при трехкратном – у 91,9%. У 18 (8,1%) пациентов диагноз был установлен клинически по факту обнаружения в кале остриц. Прирост относительного числа больных с инвазией увеличивался в зависимости от кратности обследования (табл. 1), что свидетельствует о высокой диагностической значимости и информативности трехкратного исследования.
У 59 больных яйца остриц были обнаружены в кале при трехкратном исследовании фекалий методом эфир-формалиновой седиментации, то есть его чувствительность для диагностики энтеробиоза составила 26,7%. Однако применение данного метода позволило выявить цисты лямблий, яйца аскарид и дифиллоботриид в кале больных с микст-инвазией. При исследовании фекалий методом Бермана острицы были обнаружены всего у 3 (1,4%) пациентов. У одного больного с высокой интенсивностью инвазии Enterobius vermicularis яйца остриц были обнаружены в перианальныом соскобе, а также в нативном мазке, при исследовании материала методами Бермана,и эфир-формалиновой седиментации и выполнении общей копрограммы, что свидетельствует о невысокой диагностической ценности указанных методов для диагностики энтеробиоза.
Согласно нашим данным, наиболее постоянным неспецифическим лабораторным показателем для диагностики энтеробиоза, как, впрочем, и других глистных инвазий, являлась эозинофилия крови. Лейкемоидную реакцию эозинофильного типа (от 6 до 24%) регистрировали у 154 (69,7%) больных с энтеробиозом.
Доля больных токсокарозом составила 12,2%, среди них был 61 ребенок (80,3%) в возрасте до 5 лет. Из 76 пациентов клиники паразитарных болезней, больных токсокарозом, только у 1 ребенка при показателе эозинофилии 45% оптическая плотность сыворотки в ИФА находилась в «серой зоне». Титр специфических иммуноглобулинов класса G (IgG) 1:400 регистрировали у 8 (10,5%) человек, количество эозинофилов в периферической крови у них колебалось от 8 до 51%. Титр антител 1:800 отмечен у 12 (15,8%) больных при озинофилии от 11 до 38%. У 24 (31,6%) пациентов титр специфических атител составлял 1:1600, эозинофилия в этой группе колебалась от 9 до 41%. У 22 (28,9%) больных регистрировали титр токсокарозных антител 1:3200 при эозинофилии от 8 до 60%. Высокие титры антител (1:6400 и 1:12800) в сыворотке крови были у 9 (11,8%) пациентов, а эозинофилия периферической крови вырьировала от 10 до 62% (рис. 2).
Таким образом, при токсокарозе положительные результаты ИФА в 98,7% случаев сочетались с эозинофилией периферической крови. Выраженность эозинофилии практически не коррелировала с уровнем специфических антител к токсокарам (r = 0,15).
Эффективность проводимой терапии оценивали по нормализации показателей периферической крови, в первую очередь по регрессу эозинофилии. Наблюдение в динамике с целью определить длительность сохранения антител при токсокарозе показало, что через месяц после проведенной этиотропной терапии у 65,7% больных титры антител увеличились в 2 и более раз при регрессе эозинофилии. В дальнейшем уровень специфических антител оставался неизменным при условии отсутствия повторных инвазий в течение как минимум двух лет.
За период с 2005 по 2015 г. в клинике паразитарных болезней получали лечебно-диагностическую помощь 75 больных эхинококкозом, из них 11 (14,7%) детей в возрасте от 3 до 15 лет.
Результаты определения диагностической значимости ИФА с эхинококкозным антигеном представлены в табл. 2.
Методом ROC-анализа было установлено, что чувствительность данного метода составила 92,23%, специфичность – 88,87%. Показатель AUC равен 0,91. Прогностическая ценность положительного результата составила 56,89%, отрицательного – 98,63%.
При анализе медицинских карт больных эхинококкозом с отрицательными результатами ИФА установлено, что у 7 из них при компьютерной томографии выявлены выраженные признаки обызиствления капсулы, что свидетельствовало о длительном течении инвазии.

Отрицательные результаты ИФА с эхинококкозным антигеном получены у 9 (42,9%) пациентов с кистами средних размеров (50–70 мм), которые были расценены как непаразитарные. Больным выполняли хирургические вмешательства без гермицидной обработки полости кисты, и через месяц после оперативного вмешательства отрицательный результат исследования получен только у 4 (19,1%) пациентов (рис. 3).
При выполнении оперативного вмешательства нередко из-за повреждения оболочек кист протосколексы гельминта оказывались в разных органах и полостях пациентов, что иногда проявлялось в виде интраоперационных аллергических реакций, вплоть до анафилактического шока. Поэтому, независимо от результатов ИФА, тактические подходы к хирургическому лечению кист паренхиматозных органов должны быть аналогичны принципам лечения потенциально паразитарных образований. Появление положительного результата или повышение коэффициента позитивности оптической плотности сыворотки в ИФА с эхинококкозным антигеном является признаком неблагополучного прогноза развития рецидива.
 Анализ результатов ИФА с эхинококкозным антигеном показывают, что он обладает высокой диагностической ценностью, но имеет ряд ограничений.
Анализ результатов ИФА с эхинококкозным антигеном показывают, что он обладает высокой диагностической ценностью, но имеет ряд ограничений.
Анализ медицинских карт 27 больных тениаринхозом, показал, что более чем у 85% больных единственной жалобой при поступлении было отхождение фрагментов гельминта. Только 7,9% пациентов отмечали умеренные диспептические явления (тошноту, схваткообразные боли в животе, послабление стула и др.). Диагноз верифицировался паразитоскопией члеников гельминта до и после антигельминтной терапии. При исследовании фекалий больных методом эфир-формалиновой седиментации яйца тениид были обнаружены в первом исследовании практически в каждой пробе (85,2%). У 62,5% больных яйца тениид были обнаружены при исследовании перианального соскоба. В гемограмме анемию регистрировали у 19,2% больных, лейкоцитоз – у 10,6%, ускоренную СОЭ – у 21,3%, эозинофилию – у 29,8%, лимфоцитоз – у 8,5%. При этом у больных со сроком инвазии более 4 лет показатели периферической крови были в пределах нормы. Наиболее информативным при диагностике тениаринхоза было исследование фекалий методом эфир-формалиновой седиментации. Метод перианального соскоба может рассматриваться лишь в качестве вспомогательного в связи с его низкой информативностью.
Метод Бермана применяли при исследовании фекалий всех больных. Исследование проводили трехкратно с интервалом в 2–3 дня. За период наблюдения стронгилоидоз был верифицирован у 13 пациентов, среди которых был 1 ребенок в возрасте 15 лет. Большинство больных стронгилоидозом (9 человек) – лица старше 60 лет, длительно наблюдавшиеся и получавшие лечение по поводу аллергических заболеваний (бронхиальная астма, крапивница, инфекционно-аллергический полиартрит и др.) или заболеваний крови (тромоцитопения, лимфолейкоз и т. д.). При однократном исследовании кала методом Бермана личинки Strongyloides stercoralis были обнаружены у 7 (53,8%) больных, при двукратном – у 12 (92,3%) и только у 1 больной диагноз стронгилоидоза был установлен после трехкратного исследования кала.
 У 2 пациентов, длительно получавших глюкокортикостероиды, регистрировали высокую интенсивность инвазии (8 личинок в поле зрения), у них же личинки визуализировались в нативном мазке, а также при исследовании кала методом эфир-формалиновой седиментации. Таким образом, единственным на сегодняшний день доступным и информативным для выявления стронгилоидоза является трехкратное исследование по методу Бермана.
У 2 пациентов, длительно получавших глюкокортикостероиды, регистрировали высокую интенсивность инвазии (8 личинок в поле зрения), у них же личинки визуализировались в нативном мазке, а также при исследовании кала методом эфир-формалиновой седиментации. Таким образом, единственным на сегодняшний день доступным и информативным для выявления стронгилоидоза является трехкратное исследование по методу Бермана.
Обсуждение
В структуре заболеваемости паразитарными болезнями в Ростовской области, по данным клиники, доминирующим является энтеробиоз – контактный гельминтоз, поражающий в первую очередь детей. Несмотря на то что динамика заболеваемости им в Российской Федерации в последние годы имеет устойчивую тенденцию к снижению (в 2013 г. – 150,2 на 100 тыс. населения, в 2015 г. – 148,72), нельзя исключить, что это обусловлено снижением объемов обследования населения на энтеробиоз [3]. Нередко обследование декретированных лиц, а также больных перед госпитализацией в стационары ограничиваются только однократным исследованием кала, эффективность которого при энтеробиозе не превышает, по нашим данным, 26,7%.
Актуальной проблемой педиатрии являются геогельминтозы, в первую очередь токсокароз, за счет интенсивной контаминации объектов окружающей среды жизнеспособными яйцами Toxocara canis [4]. Трудность диагностики токсокароза обусловлена полиморфностью клинических проявлений, отсутствием патогномоничных симптомов инвазии и методов достоверной специфической диагностики, особенно в регионах, где регистрируется значительная доля серопозитивных лиц за счет тесного контакта с объектами окружающей среды (почва, овощи, ягоды, зелень и т. д.), контаминированными яйцами токcокар [5].
Достоверной зависимости уровня титров специфических антител от выраженности клинических проявлений инвазии и эозинофилии периферической крови мы не наблюдали. Отсутствие корреляции этих показателей вполне объяснимо с клинической точки зрения, так как известно, что уровень антител класса G больше зависит от срока инвазии, и в ранний период при выраженных клинических проявлениях, сопровождающихся высоким уровнем эозинофилии, титры специфических антител могут быть ниже так называемых «диагностических». Таким образом, предлагаемый производителями в инструкциях к тест-системам вариант интерпретации результатов ИФА с токсокарозным антигеном на основе «коэффициента позитивности оптической плотности» с клинической точки зрения недостаточно обоснован.
При интерпретации результатов ИФА с токсокарозным антигеном необходимо учитывать клинические и другие лабораторные проявления инвазии. Однако следует отметить, что положительный результат ИФА с токсокарозным антигеном, как и эозинофилия периферической крови, являются наиболее постоянными лабораторными признаками инвазии человека токсокарами.
Актуальными биогельминтозами для Северного Кавказа являются тениаринхоз и эхинококкоз [6, 7].
Ведущую роль в диагностике эхинококкозов, а также в динамическом наблюдении за реконвалесцентами играют инструментальные методы (ультразвуковые, рентгенологические исследования; компьютерная и магниторезонансная томография) [8], однако объективное значение для прогноза развития рецидивов и оценки эффективности проведенного хирургического и консервативного лечения имеет ИФА с целью определения специфических IgG к эхинококкозному антигену.
Заболеваемость тениаринхозом на некоторых территориях Северного Кавказа превышает среднефедеральный уровень более чем в 10 раз1. Инвазия возбудителем бычьего цепня протекает при минимальных клинических появлениях и нередко при отсутствии изменений данных общеклинического обследования. На сегодняшний день это единственная патология, при которой важное значение имеют опрос больного на предмет отхождения члеников паразита и правильный сбор эпидемиологического анамнеза.
В клинике ежегодно регистрируются случаи аутохтонного для Ростовской области стронгилоидоза. Особенностью инвазии человека Strongyloides stercoralis является полиморфность его клинических и лабораторных проявлений. Диагностика данного гельминтоза затруднена в связи с тем, что при пассаже по кишечнику разрушается оболочка яиц гельминта, личинки отходят нерегулярно и для исключения инвазии (или для верификации диагноза) необходимо использовать ларвоскопическое исследование кала. Полученные нами сведения об эффективности метода Бермана согласуются с данным зарубежных исследователей [9] о его высокой чувствительности и специфичности для диагностики стронгилоидоза.
Заключение
Одним из важных факторов оптимизации диагностики кишечных паразитозов является выбор метода и кратности обследования [10]. При разных гельминтозах они могут принципиально отличаться.
Для диагностики энтеробиоза максимальной точностью обладает метод трехкратного обследования больного методом перианального соскоба. При тениаринхозе наиболее важное диагностическое значение имеют опрос больного на предмет отхождения члеников гельминта, перианальный соскоб и исследование кала методами обогащения. Оптимальным для диагностики стронгилоидоза является метод Бермана и его модификации.
Для диагностики ларвальных гельминтозов важное значение имеет метод ИФА в сочетании с данными общего анализа крови и результатами инструментальных исследований.
Таким образом, для оптимизации диагностики паразитарных инвазий целесообразно параллельное применение всех основных методов лабораторной и инструментальной верификации диагноза, ориентированных на конкретные нозологии, при которых встречаются имеющиеся у больного клинические проявления.


