Хронический гепатит С (ХГС) в настоящее время представляет актуальную проблему в связи с широким его распространением, преобладанием больных молодого трудоспособного возраста, возможностью развития осложнений и неблагоприятных исходов, значительным медико-социальным и экономическим ущербом [1, 2]. Накопленные данные о естественном течении хронических вирусных гепатитов (ХВГ) свидетельствуют о значительной роли генетических факторов, образа жизни пациента, сопутствующих заболеваний в прогрессировании инфекции [3]. Однако оценка клинико-вирусологических и морфологических показателей и их взаимосвязей на разных стадиях ХГС у пациентов с сопутствующими заболеваниями, данная разными исследователями, зачастую противоречива. Появившаяся в последние годы возможность идентификации гепатотропных вирусов, неинвазивная морфофункциональная диагностика стадии патологического процесса в печени позволяют прогнозировать течение острого и хронического гепатита и более целенаправленно проводить значительную часть превентивных мероприятий.
Существует группа генетически детерминированных заболеваний соединительной ткани (СТ), характеризующихся дефектами ее волокнистых структур и основного вещества. Такую аномалию соединительной ткани обозначают термином «дисплазия соединительной ткани» (ДСТ) [4, 5]. Синтез и распад коллагеновых белков многоэтапны и сложны и подчиняются общим законам синтеза гликопротеидов. Синтезируются они главным образом фибробластами, в процессе синтеза волокон принимают участие протеогликаны и гликопротеины, играющие роль интерфибриллярного цементирующего вещества. Один и тот же тип клетки в состоянии синтезировать одновременно несколько коллагенов или изменять их спектр под влиянием внешних воздействий [6]. Рост фибробластов и продукция ими коллагена регулируются факторами, секретируемыми макрофагами (моноцитами крови). В СТ обнаружены тучные клетки, секретирующие гистамин, простагландины, которые участвуют в регуляции свертываемости крови и жирового обмена, поскольку активатором липазы является также гепарин. Тучные клетки участвуют в метаболизме коллагена, оказывая влияние на активность коллагеназы других клеток путем активирования проколлагеназы. Весь этот «антагонизм» регулируется IgE, Са²+ и цАМФ основного вещества [7, 8].
В 1990 г. в Омске была принята классификация наследственных заболеваний СТ, которая выделяет 2 основные группы: дифференцированные ДСТ с очерченной клинической симптоматикой (синдромы Марфана, Элерса–Данло, несовершенный остеогенез) и недифференцированные ДСТ (НДСТ) [9]. В настоящее время под НДСТ понимают нозологически самостоятельный синдром мультифакториальной природы, проявляющийся внешними фенотипическими признаками и клинически значимой дисфункцией одного или нескольких внутренних органов. ДСТ морфологически характеризуется изменениями коллагеновых, эластических фибрилл, гликопротеидов, протеогликанов и фибробластов, в основе которых лежат наследуемые мутации генов, кодирующих синтез и пространственную организацию коллагена, структурных белков и белково-углеводных комплексов, а также мутации генов, кодирующих различные ферменты и кофакторы к ним [10]. Врожденные дефекты биосинтеза коллагена и других компонентов СТ ведут к формированию разнообразных клинико-функциональных нарушений, способствуют активации фиброгенеза, ускоряют формирование цирроза печени (ЦП) и гепатоцеллюлярной карциномы [11].
Цель исследования – оценка естественного течения ХГС у пациентов с синдромом НДСТ.
Материалы и методы
В исследование, проводившееся на протяжении 3 лет (с 2011 по 2014 г.), были включены 95 пациентов, страдающих ХГС. Средний возраст больных в 2011 г. составлял 42,82 ± 8,31 года. Среди них было 50 (52,64%) мужчин и 45 (47,36%) женщин. Все пациенты находились под диспансерным наблюдением врачей инфекционного отделения ГБУ «Республиканский клинический центр инфекционных болезней» (г. Грозный). Среднее число визитов каждого пациента в течение 3 лет составило 4,42 ± 0,52.
Больные были разделены на 2 группы: в 1-ю вошли 63 пациента с ХГС и признаками НДСТ, во 2-ю – 32 пациента с ХГС без клинических признаков ДСТ.
 Распределение больных по генотипам вируса гепатита С (HCV) было приблизительно одинаково: HCV генотипа 1 определен у 26 (27,4%) пациентов 1-й группы и у 23 (24,2%) пациентов 2-й группы, HCV генотипа 2 – соответственно у 6 (6,4%) и 5 (5,3%) пациентов, HCV генотипа 3 – у 18 (18,9%) и 16 (16,8%) пациентов.
Распределение больных по генотипам вируса гепатита С (HCV) было приблизительно одинаково: HCV генотипа 1 определен у 26 (27,4%) пациентов 1-й группы и у 23 (24,2%) пациентов 2-й группы, HCV генотипа 2 – соответственно у 6 (6,4%) и 5 (5,3%) пациентов, HCV генотипа 3 – у 18 (18,9%) и 16 (16,8%) пациентов.
Исследование проводили в соответствии с требованиями Конвенции о правах человека и биомедицине (1997) и Хельсинской декларации Всемирной медицинской ассоциации. (2000) с разрешения этического комитета. У всех пациентов было получено письменное добровольное информированное согласие на участие в проведении исследования.
В исследование включали пациентов старше 18 лет с установленным диагнозом ХГС, которые не получали ранее противовирусной терапии по поводу хронического гепатита; не употребляли парентерально психоактивные вещества; не страдали хроническим алкоголизмом; не имели сопутствующих соматических, а также аутоиммунных и онкологических заболеваний, требующих регулярного или курсового использования лекарственных препаратов. Для женщин дополнительным критерием включения в исследование было отсутствие беременности на протяжении всего периода наблюдения.
Общеклиническое, лабораторное и инструментальное обследование проводили в соответствии со стандартами по ведению пациентов с ХВГ1. При обострении заболевания пациентам по показаниям назначали гепатопротекторы, желчегонные препараты, витамины, проводили лечение геморрагического синдрома.
Критериями установления диагноза ХГС были определение антител к HСV и обнаружение РНК HСV в крови больного на протяжении 6 мес. и более. Проводили генотипирование HСV с помощью термоциклера для амплификации нуклеиновых кислот iCycler iQ5 («Bio-Rad», США). Использовали тест-системы и программу «РеалБест Диагностика» (ЗАО «Вектор-Бест», Россия).
Степень выраженности фиброза печени оценивали по шкале METAVIR на аппарате FibroScan («Echosens», Франция), результат исследования определялся в килопаскалях (кПа) [12].
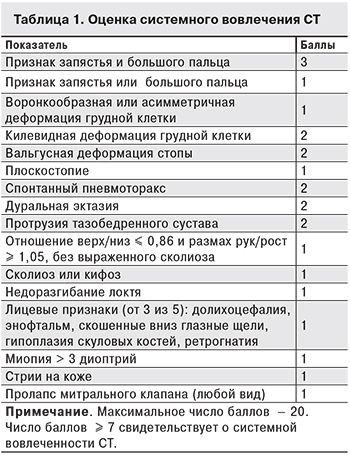
Диагностику синдрома НДСТ проводили по результатам анализа системного вовлечения СТ согласно Гентским критериям (2010) (табл. 1) [13, 14]. Системная вовлеченность СТ у больных ХГС составила 8,96 ± 0,19 баллов.
Для статистической обработки данных использовали программу StatSoft Statistica v.6.0. В случае нормального распределения признака в выборке результаты представляли в виде средней арифметической и ее стандартной ошибки (М ± m). Сравнительный анализ результатов для независимых выборок вычисляли при помощи U-теста Манна–Уитни. Для всех видов анализа статистически достоверным считали значения при р ≤ 0,05.
Результаты
Исследование показало, что у пациентов с ХГС синдром НДСТ встречается часто: мы диагностировали его у 66% больных, что соответствует показателю в общей популяции взрослого населения, проживающего в Российской Федерации [15].
Известно, что наличие синдрома НДСТ неблагоприятно влияет на течение основного заболевания. Мы проанализировали жалобы, предъявляемые пациентами с ХГС в периоде ремиссии гепатита в зависимости от наличия/отсутствия у них синдрома НДСТ (табл. 2) в 2011 г. и в 2014 г. Анализ клинических симптомов свидетельствует о выраженных нарушениях субъективного статуса пациентов, имеющих НДСТ даже в периоде ремиссии. В 2011 г. пациенты 1-й группы чаще всего предъявляли жалобы на нарушения со стороны пищеварительной, опорно-двигательной, сердечно-сосудистой систем; были признаки вегетативной дисфункции. Больные жаловались также на суставные и головные боли, боли в позвоночнике, снижение работоспособности, «перебои» в работе сердца, появление немотивированной одышки, снижение аппетита, запоры, частые позывы к мочеиспусканию. Это связано с «вездесущностью» СТ, составляющей основу строения любого органа, и вовлечением в патологический процесс многих органов и систем у пациентов с диспластическими проявленими.
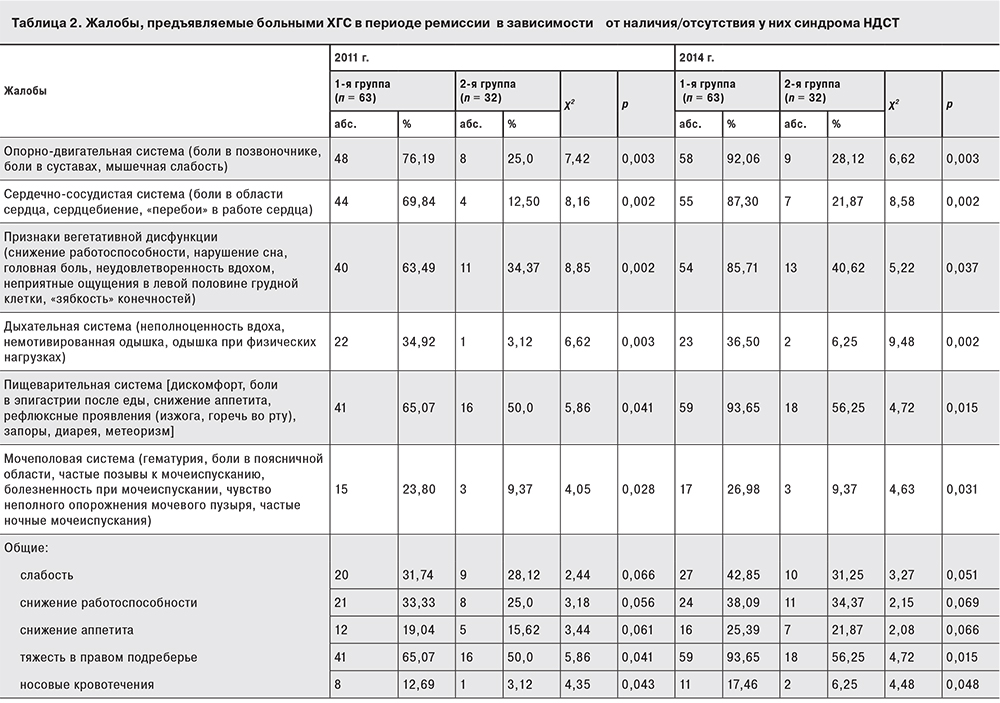
Больные 2-й группы, обследованные в 2011 г. в периоде ремиссии ХГС, также достаточно часто жаловались на нарушения со стороны пищеварительной системы, у них наблюдались признаки вегетативной дисфункции, что мы объясняем наличием основного заболевания и психологической напряженностью пациентов, которым в большинстве случаев приходится скрывать свой диагноз от окружающих.
В 2014 г. количество жалоб на состояние здоровья закономерно увеличилось у больных обеих групп. У большинства пациентов сохранялись жалобы на нарушения со стороны опорно-двигательной, сердечно-сосудистой и пищеварительной систем; определялась вегетативная дисфункция. Но у пациентов 1-й группы спустя 3 года число жалоб на нарушения со стороны пищеварительной системы увеличилось на 28,5%, а у больных 2-й группы – всего на 6,25% (p < 0,04). Аналогичная тенденция проявилась и в отношении жалоб на нарушения со стороны сердечно-сосудистой (рост соответственно на 17,5 и 9,4%; p < 0,05), опорно-двигательной (15 и 3%; p < 0,04) систем, вегетативной дисфункции (22 и 6%; p < 0,04). Количество жалоб на нарушения со стороны дыхательной и мочеполовой систем за 3 года не увеличилось. Значительное ухудшение здоровья у пациентов 1-й группы нельзя объяснить только прогрессированием патологического процесса в печени при ХГС. Оно в большей степени определяется диспластическими процессами, затрагивающими многие системы организма.
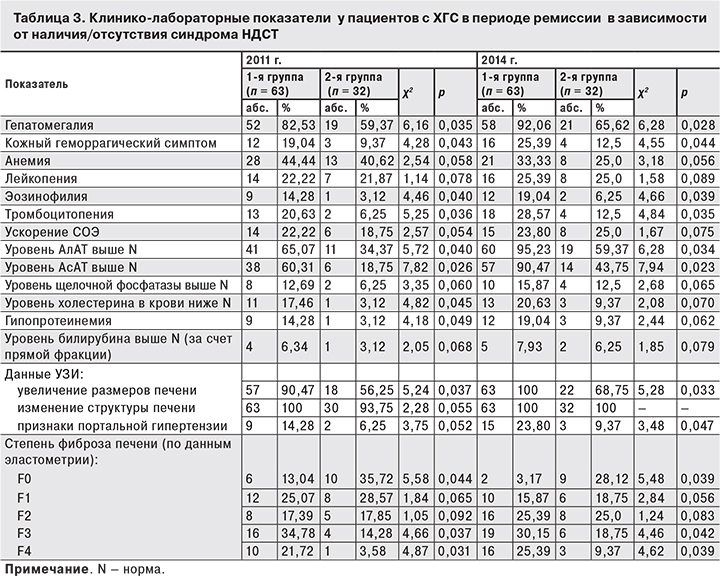
Мы рассмотрели влияние диспластических процессов на основные клинические проявления болезни и лабораторные показатели при ХГС, которые регистрировали в периоде ремиссии в 2011 и 2014 гг. (табл. 3).
В 2011 г. у пациентов 1-й группы по сравнению с пациентами 2-й группы достоверно чаще отмечали тяжесть в правом подреберье, носовые кровотечения, гепатомегалию, кожный геморрагический синдром, эозинофилию и тромбоцитопению крови, что характеризует тяжесть происходящих в печени нарушений.
У большинства пациентов 1-й группы мы наблюдали более высокое содержание АлАТ в крови по сравнению с больными 2-й группы, в которой повышенный уровнь АлАТ определяли лишь у каждого 3-го пациента. Отмечено, что у пациентов 1-й группы наряду с повышением уровня АлАТ наблюдается и значительный рост уровня АсАТ, являющейся маркером нарушенного коллагенообразования. Во 2-й группе повышение уровня АсАТ регистрировали лишь у каждого 5-го больного, что закономерно отражает суть патологического процесса.
При первичном обследовании по результатам УЗИ печени у большинства пациентов 1-й группы было выявлено ее увеличение и у всех пациентов – изменение структуры печени. Признаки портальной гипертензии зафиксированы у 9 (14,28%) больных. Во 2-й группе размеры печени были увеличены у половины пациентов, практически у всех была нарушена структура печени. Портальная гипертензия диагностирована только у 2 (6,25%) больных.
Согласно результатам эластометрии, у пациентов 1-й группы наиболее часто регистрировали фибротические изменения печени, соответствующие степени фиброза F3 по METAVIR, у каждого 5-го больного был установлен ЦП. В то же время во 2-й группе у каждого 3-го больного отсутствовали фибротические изменения в печени, а выявленные изменения преимущественно соответствовали степени фиброза F1 по METAVIR. ЦП диагностирован у 1 больного.
Спустя 3 года было проведено повторное обследование больных, которое установило изменение всех основных показателей, характеризующих активность патологического процесса в печени, более значимое у больных 1-й группы. В 2014 г. тяжесть в правом подреберье, гепатомегалию имели практически все пациенты 1-й группы, а во 2-й группе – только половина. В 1-й группе на 6% увеличилось число больных с кожным геморрагическим синдромом, на 5% – с эозинофилией, на 8% – с тромбоцитопенией. Среди пациентов 2-й группы на 6% увеличилось только число больных с тромбоцитопенией.
Лабораторные показатели также изменились у пациентов обеих групп, но более выраженные нарушения мы отмечали в 1-й группе: у 95% больных был повышен уровень АлАТ, у 90% – уровень АсАТ. У каждого 5-го больного были снижены уровни холестерина и общего белка в плазме крови. Признаки портальной гипертензии, по данным УЗИ, имел каждый 4-й.
У пациентов 2-й группы изменения лабораторных показателей были выражены значительно меньше, что отражает «благоприятное» течение патологического процесса при ХГС. Фибротические изменения в печени также происходили медленнее, чем у больных 1-й группы.
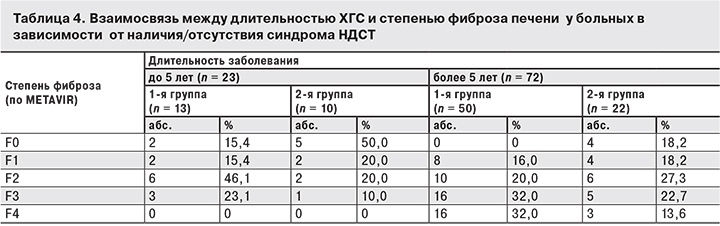
Изучение связи между длительностью ХГС и степенью фиброза печени у больных в зависимости от наличия/отсутствия синдрома НДСТ (табл. 4) выявило закономерность: у пациентов с признаками НДСТ выраженные фибротические изменения в печени происходят независимо от длительности заболевания. Во 2-й группе изменения в печени, соответствующие степени фиброза F2 и F3 по METAVIR, наблюдались исключительно у пациентов с большим «стажем» заболевания, но их было значительно меньше, чем в 1-й группе.
Обсуждение
Естественное течение ХГС зависит от множества факторов, которые активно обсуждались четверть века назад. В настоящее время интерес к этой проблеме несколько уменьшился, что связано с активным внедрением противовирусной терапии ХГС, существенно изменившей течение инфекции.
Темпы прогрессирования ХГС различны. Данные исследований свидетельствуют, что продолжительность естественного течения ХГС в среднем составляет около 30 лет с колебаниями от 13 (у мужчин, инфицированных в возрасте после 40 лет) до 42 лет (у женщин, инфицированных в возрасте до 40 лет). При этом почти треть больных имеет риск формирования ЦП в первые 20 лет, но в то же время у трети больных риска развития ЦП при жизни вообще нет [16].
В проведенном нами исследовании установлено, что в первые годы течения ХГС формирования ЦП у больных не происходит: у пациентов со «стажем» инфицирования HCV менее 5 лет случаев ЦП мы не зарегистрировали. По мере увеличения длительности заболевания достоверно нарастает количество жалоб на нарушения со стороны основных систем организма и ухудшаются клинико-лабораторные показатели состояния здоровья пациентов, выраженность которых определяется наличием или отсутствием синдрома НДСТ.
Существенные различия в естественном течении ХГС большинство ученых объясняют множеством факторов: механизмом инфицирования, дозой инфицировавшего патогена, генотипом вируса, преморбидным фоном и наличием кофакторов повреждения печени [3, 17, 18].
Мы полагаем, что именно преморбидный фон, определяющий развитие диспластических процессов в организме больных ХГС с НДСТ, играет наиболее важную роль в развитии патологического процесса, затрагивает множество органов и систем, вовлекает их в патологический процесс и усугубляет течение основного заболевания. Именно у больных с НДСТ и длительностью HCV-инфекции более 5 лет происходят выраженные изменения в печени, соответствующие степени фиброза F2 и F3 по METAVIR. Повышение уровня АсАт у пациентов с ХГС также подтверждает участие СТ в развитии патологического процесса.
Роль патологических изменений системы крови в патогенезе ХГС давно интересует многих исследователей [18]. Так, Е.А. Лукина и соавт. [19] установили, что у 45–62% больных ХГС в общем анализе крови на разных стадиях заболевания выявляются нормо- и гипохромная анемия, лейкопения, лимфоцитоз, абсолютная гранулоцитопения и тромбоцитопения, которые авторы объясняют персистенцией HCV в клетках кроветворной системы и избыточным апоптозом гемопоэтических клеток костного мозга, гиперпродукцией ФНО-α, компенсаторным повышением активности моноцитов и макрофагов. В нашем исследовании в 2011 г. анемия была диагностирована у 42% больных, лейкопения – у 22%, тромбоцитопения – у 15,8%, а эозинофилия – у каждого 10-го пациента. На протяжении 3 лет пациентам проводили лечение анемии, они получали патогенетическую терапию. Спустя 3 года изменения показателей общего анализа крови носили разнонаправленный характер. Анемию определяли реже (у 30% больных), но возросла частота регистрации лейкопении, эозинофилии и тромбоцитопении. Так, количество лейкоцитов и тромбоцитов было снижено уже у каждого 4-го больного ХГС, а эозинофилию выявляли у каждого 6-го.
В то же время изменения показателей эозинофилии и тромбоцитопении существенно отличалась. В 1-й группе они были достоверно ниже (p < 0,05), чем во 2-й, что нельзя объяснить только репликацией HCV в клетках крови. На наш взгяд, это связано с активацией тучных клеток, секретирующих гистамин и простагландины, участвующих в метаболизме коллагена путем активирования проколлагеназы и способствующих повышенному образованию эозинофилов.
Работ, посвященных изучению роли синдрома НДСТ у пациентов с ХВГ, в доступной литературе практически нет. В то же время влияние диспластических процессов на течение соматических заболеваний активно изучается, но преимущественно в педиатрии и акушерстве. Имеются единичные исследования роли НДСТ у пациентов с инфекционными заболеваниями, которые указывают на существенное изменение течения инфекции у лиц с диспластическими проявлениями, которые характеризуются тяжестью процесса, обширностью поражения, рецидивирующим течением [20].
Проведенное исследование показало значительное влияние синдрома НДСТ на естественное течение ХГС. Синдром НДСТ, легко диагностируемый клинически, может являться одним из маркеров нарушенной толерантности и генетической предрасположенности к ускоренному замещению гепатоцитов СТ, указывающим на неблагоприятное течение патологического процесса и высокую вероятность формирования ЦП.
В заключение добавим, что в 2014–2016 гг. 71 больному ХГС, участвовавшему в исследовании, был назначен курс противовирусной терапии (пегилированные интерфероны и рибавирин) в рамках республиканской программы по лечению ХВГ.
Выводы
- Естественное течение ХГС характеризуется прогредиентным течением, выраженными изменениями функционирования печени в виде диспептических нарушений, изменением биохимических и гемореологических показателей крови.
- Наличие синдрома НДСТ у больных ХГС является фактором, определяющим прогредиентность течения и высокую активность воспалительного процесса. Изменения свертывающей системы крови характеризуются анемией и тромбоцитопенией, что проявляется носовыми кровотечениями, кожным геморрагическим синдромом с быстрым формированием выраженных фибротических процессов в печени.


