В соответствии с российскими «Протоколами диспансерного наблюдения и лечения больных ВИЧ-инфекцией», утвержденными Национальным научным обществом инфекционистов в 2014 г. [1], в состав рекомендуемой схемы антиретровирусной терапии (АРТ) первой линии рекомендуется включать 2 препарата из группы нуклеозидных ингибиторов обратной транскриптазы ВИЧ (НИОТ) и 1 ненуклеозидный ингибитор обратной транскриптазы (ННИОТ) препарат эфавиренз (EFV). Широко применяемые в настоящее время препараты первого поколения из группы ННИОТ (EFV и невирапин – NVP) обладают достаточно высокой эффективностью, однако при их использовании нередко регистрируют развитие таких нежелательных явлений (НЯ), как нарушения со стороны ЦНС, гепатотоксичность, кожно-аллергические реакции, вследствие которых пациенты пропускают прием этих препаратов, что приводит к возникновению мутаций резистентности ВИЧ и изменению схемы лечения [2, 3]. Наиболее часто регистрируют возникновение мутаций K103N, Y181C, Y188L и G190A/S, обусловливающих резистентность ВИЧ к ННИОТ первого поколения. Поскольку профиль мутаций резистентности у EFV и NVP практически одинаков, то при неудаче лечения схемой АРТ, включавшей один из этих препаратов, назначать другой ННИОТ первого поколения нецелесообразно [4].
Разработка и внедрение в клиническую практику ННИОТ второго поколения позволило, с одной стороны, добиться эффективного подавления репликации ВИЧ, даже при наличии мутаций резистентности вируса к ННИОТ первого поколения, а с другой стороны – существенно уменьшить частоту развития НЯ, связанных с лечением. К препаратам второго поколения из группы ННИОТ относят этравирин (ETR; интеленс®) и рилпивирин (эдюрант®).
Молекула ETR обладает определенной подвижностью, что обеспечивает уникальный профиль мутаций резистентности к препарату и, соответственно, высокий генетический барьер к развитию резистентности ВИЧ. Поскольку молекула ETR плотно прикрепляется к активному центру фермента обратной транскриптазы ВИЧ, препарат высокоэффективен даже в отношении вируса с наличием мутаций устойчивости к ННИОТ первого поколения. Кроме того, при производстве ETR применяют высокие технологии (очистку спреем, использование гидрополимеров), что позволяет существенно уменьшить частоту развития НЯ и обеспечивает благоприятный профиль безопасности препарата [4].
В настоящее время препарат ETR рекомендуют назначать в составе схем АРТ у больных с неэффективностью предшествующей схемы лечения, содержащей ННИОТ первого поколения, а также пациентам при изменении схемы АРТ в связи с НЯ, обусловленными терапией (нарушения со стороны ЦНС, гепатобилиарной системы, изменение показателей обмена липидов крови) [1].
Применение ETR у больных с неэффективностью предшествующей схемы лечения
Рекомендации по применению ETR были даны на основании результатов исследований DUET 1 и 2 – многоцентровых, рандомизированных исследований с двойным слепым контролем, проведенных в рамках III фазы клинических испытаний для оценки эффективности, безопасности и переносимости ETR в составе схемы АРТ [5]. Поскольку исследования DUET 1 и 2 имели одинаковый дизайн и критерии включения и исключения, а различались только по географическому распределению стран-участниц, то эти исследования составили дуэт, а их результаты в дальнейшем были объединены. В исследования DUET было включено 1203 взрослых больных ВИЧ-инфекцией, ранее получавших лечение, без вирусологического эффекта (РНК ВИЧ > 5000 копий/мл) на фоне АРТ (не менее 8 недель), при наличии подтвержденной генотипической резистентности вируса к ННИОТ (1 и более мутаций резистентности) и ингибиторам протеазы (ИП) ВИЧ (3 и более первичных мутаций резистентности).
90% пациентов составляли мужчины, 70% – лица европейской расы. Средняя продолжительность ВИЧ-инфекции – 14 лет. На момент включения в исследование уровень РНК ВИЧ в среднем был равен 4,8 lg копий/мл. Медиана количества CD4+-лимфоцитов составила 99–109 клеток/мкл. Исходно у 70% пациентов выявляли 2 и более мутаций к ННИОТ и у 97% – 3 и более первичных мутаций к ИП [5].
Пациенты были рандомизированы в соотношении 1:1 в группы, получавшие ETR 200 мг или плацебо 2 раза в день. На основании исследования резистентности ВИЧ методом генотипирования у всех пациентов была оптимизирована базовая часть схемы АРТ (ОБТ). Больные также получали дарунавир, усиленный ритонавиром (DRV/r), и 2 препарата из группы НИОТ. Некоторым пациентам дополнительно к схеме АРТ назначали энфувиртид (ENF). Длительность исследования составила 96 недель.
Через 48 недель лечения доля больных с уровнем РНК ВИЧ < 50 копий/мл была статистически значимо больше в группе пациентов, получавших ETR, в сравнении с пациентами, получавшими плацебо (60 и 39% соответственно; p < 0,0001). Высокая эффективность ETR сохранялась и спустя 96 недель терапии (57 и 36% соответственно; p < 0,0001). Более того, при использовании в схеме АРТ ETR уже через 15,7 недели у 50% больных вирусная нагрузка достигла неопределяемого уровня, тогда как в группе плацебо – существенно позже (через 32,7 недели; p < 0,0001) [5].
Помимо вирусологической эффективности исследование продемонстрировало значимо более высокую иммунологическую эффективность схемы, содержавшей ETR. Так, прирост среднего количества CD4+-лимфоцитов у больных, получавших ETR, через 48 и 96 недель лечения был равен 98 и 128 клеток/мкл, в то время как у пациентов из группы плацебо – 73 и 86 клеток/мкл соответственно (p < 0,0001).
Эффективность ETR не зависела от того, какой из ННИОТ (EFV или NVP) пациенты получали ранее. Через 24 недели терапии доля больных с РНК ВИЧ < 50 копий/мл среди пациентов, леченных ETR, составила 58% (EFV) и 59% (NVP), а среди больных из группы плацебо – 37 и 42% соответственно. При наличии мутации K103N, обеспечивающей устойчивость вируса к EFV и NVP, через 24 недели лечения ETR у 69,5% больных был достигнут неопределяемый уровень вирусной нагрузки (при отсутствии этой мутации – у 58,7%). Y181C является одной из наиболее частых мутаций резистентности к EFV и NVP. При отсутствии других мутаций резистентности (кроме Y181C) или наличии не более 1 дополнительной мутации полного подавления репликации РНК ВИЧ (< 50 копий/мл) удавалось достичь у 53–64% больных. Только у 13% больных имело место сочетание мутации Y181C с двумя и более мутациями резистентности ВИЧ к препаратам из группы ННИОТ, что приводило к существенному снижению эффективности лечения [5].
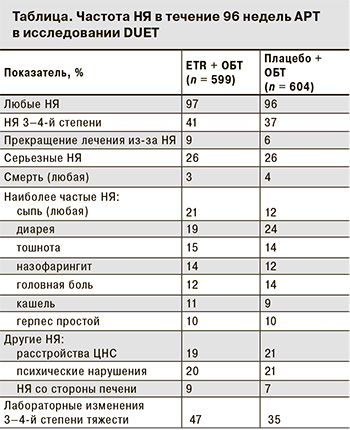
Результаты исследования DUET показали высокую безопасность лечения у больных, получавших ETR в составе схемы АРТ, сопоставимую с группой плацебо (см. таблицу). Применение ETR не было связано с развитием НЯ со стороны ЦНС и гепатобилиарной системы. Исходно у 12–13% больных был установлен диагноз хронического вирусного гепатита (ХВГ). В процессе терапии любые НЯ со стороны гепатобилиарной системы наблюдали у 18% пациентов группы ETR и у 15% пациентов группы плацебо, страдавших ХВГ [6]. У больных без ХВГ частота подобных НЯ составляла 6–7%. Повышение уровней АлАТ до 3–4-й степени токсичности (более чем в 5 раз выше верхней границы нормы) регистрировали у 14–9% больных с ХВГ и у 3–2% больных без ХВГ группы ETR и группы плацебо соответственно. Не обнаружено влияния препарата на показатели обмена липидов. Несколько чаще, чем у больных группы плацебо, у больных, леченных ETR, в течение первых 8 недель терапии регистрировали появление сыпи (21 и 12% случаев). При этом частота возникновения сыпи при использовании ETR не отличалась от частоты ее развития при терапии EFV или NVP. Ни у одного из пациентов не наблюдали развития синдрома Стивенcа–Джонсона [6].
Таким образом, результаты исследования DUET продемонстрировали лучший вирусологический и иммунологический ответ схемы, включавшей ETR, у пациентов, ранее получавших АРТ. При этом безопасность и переносимость ETR была сопоставима с плацебо за исключением сыпи, появление которой наблюдали в ранние сроки после начала терапии. При применении ETR нехарактерны НЯ со стороны ЦНС и гепатобилиарной системы.
Применение ETR у больных с множественной резистентностью ВИЧ
В исследовании ANRS 139 TRIO была проведена оценка эффективности и безопасности схемы АРТ (схема «спасения» или «резерва»), включавшей ННИОТ (ETR), ингибитор интегразы (ИИ) ралтегравир (RAL) и бустированный ритонавиром ИП дарунавир (DRV/r), у больных с множественной резистентностью ВИЧ [7]. В исследование было включено 103 пациента, у которых выявляли 3 и более мутаций к НИОТ, 3 и более главных мутаций к ИП (при этом сохранялась чувствительность к DRV). Пациенты с предшествующей вирусологической неудачей лечения ННИОТ могли принимать участие в исследовании, если у них сохранялась чувствительность вируса к ETR. У всех пациентов уровень РНК ВИЧ превышал 1000 копий/мл (медиана – 4,2 lg копий/мл). Медиана количества CD4+-лимфоцитов составляла 255 клеток/мкл. Помимо ETR, RAL и DRV/r часть пациентов дополнительно получали НИОТ и/или ENF.
Через 24 недели из 10 пациентов с определяемым уровнем РНК ВИЧ только в 3 случаях содержание РНК ВИЧ превышало 400 копий/мл. Через 48 и 96 недель АРТ у 86 и 88% больных уровень РНК ВИЧ был < 50 копий/мл. Медиана прироста количества CD4+-лимфоцитов составила через 48 недель 110 клеток/мкл, а через 96 недель – 150 клеток/мкл [7].
В течение первых 48 недель лечения у 15% больных регистрировали клинические проявления НЯ 3–4-й степени токсичности, возможно, связанные с применяемыми препаратами. Лишь в 1 случае лечение было прервано вследствие развития сыпи, сопровождавшейся лихорадочной реакцией, причиной которой, по мнению исследователей, был RAL. У 19% больных регистрировали умеренной степени или выраженные изменения лабораторных показателей. Наиболее часто отмечали повышение уровней креатинфосфокиназы (11 больных) и гамма-глютамилтранспептидазы (ГГТ; 4 больных), что не потребовало прекращения терапии. Ни один из пациентов не прервал лечения в период с 48-й по 96-ю неделю АРТ [7].
Таким образом, режим АРТ, включавший ETR, RAL и DRV/r, показал высокую эффективность, сопоставимую с эффективностью АРТ первой линии, а также хорошую переносимость.
В Италии было проведено подобное исследование, в котором приняло участие 28 больных ВИЧ-инфекцией, имевших множественную резистентность ВИЧ к трем классам АРВП (НИОТ, ННИОТ, ИП) [8]. До смены терапии медиана РНК ВИЧ составляла 4,16 lg копий/мл, а медиана количества CD4+-лимфоцитов – 247 клеток/мкл. и АРТ. У всех пациентов был выявлен ВИЧ, тропный к CCR5-рецепторам, и больным была назначена схема АРТ, включавшая RAL, ETR и ингибитор рецепторов CCR5 маравирок (MVC).
Через 4 года терапии у 25 из 26 больных (96%) уровень РНК ВИЧ был < 50 копий/мл (p < 0,0001), а медиана количества CD4+-лимфоцитов составила 505 клеток/мкл (p < 0,0001). Спустя 72 недели АРТ выбыли 2 пациента: один умер, у второго имело место существенное повышение уровней АлАТ и АсАТ, связанное с употреблением алкоголя. У обоих пациентов на момент прекращения лечения уровень РНК ВИЧ был < 50 копий/мл. В течение первых 96 недель лечения у 4 пациентов отмечали развитие серьезных НЯ, связанных с сопутствующей терапией (3 пациента получали цитостатики в связи с раком прямой кишки и лимфогранулематозом, 1 – рифампицин). После купирования НЯ всем пациентам был возобновлен текущий режим АРТ с вирусологическим эффектом. В процессе лечения у пациентов регистрировали увеличение медианы содержания гемоглобина (p = 0,0006), количества тромбоцитов (p < 0,0001) и лейкоцитов крови (p = 0,013). В то же время авторы исследования не выявили влияния схемы данной АРТ на уровни АлАТ, АсАТ, ГГТ и показатели обмена липидов [8].
Таким образом, при наличии множественной резистентности ВИЧ к лекарственным препаратам оптимальной комбинацией является сочетание АРВП ранее применявшихся классов (DRV/r, ETR), но имеющих другой спектр мутаций резистентности, и препаратов новых классов, к которым еще нет резистентности вируса (ENF, MCV, RAL).
Переключение на ETR в связи с развитием НЯ
 Еще одним показанием к применению ETR в схемах АРТ является переключение с ННИОТ первого поколения или ИП в связи с развитием побочных эффектов. Неврологические симптомы и нарушения психоэмоциональной сферы чаще всего обусловлены приемом EFV. Примерно 50% больных в начале лечения отмечают головокружение, головную боль, бессонницу, кошмарные или яркие сновидения, возможны также изменения настроения, раздражительность, нарушение концентрации внимания, депрессия, деперсонализация, параноидный бред, спутанность сознания и суицидальные мысли [9]. Как правило, эти побочные эффекты возникают в первые дни или недели лечения, имеют легкую или умеренную степень выраженности и уменьшаются при продолжении терапии [10]. Однако у ряда больных симптомы сохраняются длительное время и приводят к прекращению терапии в 4–10% случаев [9]. При употреблении алкоголя или других психоактивных веществ на фоне приема EFV возможен дополнительный психотропный эффект.
Еще одним показанием к применению ETR в схемах АРТ является переключение с ННИОТ первого поколения или ИП в связи с развитием побочных эффектов. Неврологические симптомы и нарушения психоэмоциональной сферы чаще всего обусловлены приемом EFV. Примерно 50% больных в начале лечения отмечают головокружение, головную боль, бессонницу, кошмарные или яркие сновидения, возможны также изменения настроения, раздражительность, нарушение концентрации внимания, депрессия, деперсонализация, параноидный бред, спутанность сознания и суицидальные мысли [9]. Как правило, эти побочные эффекты возникают в первые дни или недели лечения, имеют легкую или умеренную степень выраженности и уменьшаются при продолжении терапии [10]. Однако у ряда больных симптомы сохраняются длительное время и приводят к прекращению терапии в 4–10% случаев [9]. При употреблении алкоголя или других психоактивных веществ на фоне приема EFV возможен дополнительный психотропный эффект.
Использование ETR в схемах АРТ не приводит к такому выраженному влиянию на ЦНС. В двойном слепом плацебо-контролируемом исследовании SENSE по сравнению EFV и ETR любые нейропсихиатрические НЯ 1–4-й степени, связанные с приемом препарата, были зарегистрированы через 12 недель у 16,5 и 46,2% больных, принимавших соответственно ETR и EFV (p < 0,001), а НЯ 2–4-й степени, связанные с терапией, – у 5,1 и 16,7% больных (p = 0,019) [11]. Другое исследование, проведенное в Великобритании, показало, что замена EFV на ETR при развитии нарушений со стороны ЦНС уже через 12 недель приводит к снижению частоты 2–4-й степени этого побочного эффекта на 33% [12].
Для иллюстрации возможности переключения на ETR из-за побочных эффектов предшествующей терапии приводим клиническое наблюдение.
Пациент Б., 30 лет, официант. Антитела к ВИЧ выявлены в 2007 г., в центр СПИД обратился в 2010 г. Жалоб не предъявлял. При обследовании: CD4+-лимфоциты – 312 клеток/мкл (11%), РНК ВИЧ – 210 570 копий/мл, АлАТ – 28 МЕ/мл, АсАТ – 12 МЕ/л, общий билирубин – 26 ммоль/л, антитела к гепатитам В и С отсутствуют. Поставлен диагноз: ВИЧ-инфекция, стадия 3 (латентная). Сопутствующие заболевания: хронический дисбактериоз (частые расстройства стула), дискинезия желчевыводящих путей. Учитывая сопутствующие заболевания, была назначена схема EFV + комбивир (зидовудин + ламивудин).
Через 1 месяц лечения пациент стал жаловаться на сильное головокружение, «туман в голове», нарушение координации движений, плохой сон, частые головные боли. При обследовании: CD4+-лимфоциты – 364 клетки/мкл (12%), эритроциты – 4,5 х 1012/л, гемоглобин – 144 г/л, лейкоциты – 5,2 тыс/мкл, нейтрофилы – 1,7 тыс/мкл, тромбоциты – 200 тыс/мкл. Текущая схема была продолжена, даны рекомендации принимать EFV на ночь.
Через 2 месяца АРТ пациент продолжал жаловаться на сохраняющееся головокружение, чаще в вечернее время, нарушение координации, периодические кошмарные сновидения, но головная боль не беспокоила. Учитывая хорошую иммунологическую и вирусологическую эффективность [CD4+-лимфоциты – 395 клеток/мкл (14%), РНК ВИЧ – 2831 копия/мл], было решено оставить текущую схему, поскольку симптомы беспокоили пациента в основном в нерабочее время.
Через 5 месяцев АРТ пациент сообщил, что перешел на вечерний график работы, и побочные эффекты, особенно головокружение, затрудняют выполнение профессиональных обязанностей. CD4+-лимфоциты – 410 клеток/мкл (15%), РНК ВИЧ неопределяемая. Принято решение о замене EFV на ETR. Через 3 месяца терапии по новой схеме: НЯ нет, CD4+-лимфоциты – 453 клетки/мкл (18%), РНК ВИЧ неопределяемая, АлАТ – 30 МЕ/л, АсАТ – 18 МЕ/л, общий билирубин – 23 ммоль/л.
Нарушения обмена липидов часто требуют замены текущей схемы АРТ, особенно если изменения образа жизни не приводят к улучшениям липидных показателей или имеются симптомы липодистрофии. При переключении на препараты с лучшим метаболическим профилем, например, ETR, можно достичь значительного улучшения обмена веществ. Многочисленные клинические исследования показали положительный эффект при переходе с ИП на ННИОТ [13, 14].
Больная К., 40 лет, находилась на амбулаторном учете в Федеральном научно-методическом центре по профилактике и борьбе со СПИДом с 2003 г. с диагнозом: ВИЧ-инфекция, стадия 3 (бессимптомная). С 2009 г. получала АРТ по схеме: лопинавир/ритонавир, зидовудин, ламивудин.
Перед началом лечения: состояние удовлетворительное, жалоб не предъявляет. Телосложение гиперстеническое. Индекс массы тела (ИМТ) –32, объем талии – 102 см, курит более 20 лет по 20 сигарет в день, АД – 120/80 мм. рт. ст. Органы и системы без особенностей. Биохимический анализ крови: общий холестерин (ОХ) – 5,49 ммоль/л, триглицериды (ТГ) – 0,95 ммоль/л, липаза – 17,4 ЕД/л. CD4+-лимфоциты – 243 клетки/мкл (17%), РНК ВИЧ – 101 235 копий/ мл, a-HCV – отр., HBsAg – отр. ЭКГ – без патологии.
АРТ хорошо переносилась, была достигнута вирусологическая и иммунологическая эффективность: уже через 6 месяцев количество CD4+-лимфоцитов – 566 клеток/мкл (25%), РНК ВИЧ < 40 копий/мл. В процессе лечения плавно нарастал уровень ОХ и ТГ. Пациентке было рекомендовано изменить рацион питания и бросить курить. Была получена небольшая стабилизация по показателям липдиного обмена, но существенного их снижения не произошло. Больной было предложено изменение схемы лечения, но она категорически отказалась.
Через 3 года АРТ у пациентки появился «горб буйвола» в области задних отделов шеи (рисунок, см. на вклейке). Образование несимметричное, больше справа. ИМТ – 34, объем талии – 106 см, продолжает курить. АД – 120/70 мм. рт. ст. Биохимический анализ крови: ОХ – 7,23 ммоль/л, ТГ – 3,52 ммоль/л, ЛПНП – 4,45 ммоль/л, ЛПВП – 1,72 ммоль/л, липаза – 18,2 ЕД/л. CD4+-лимфоциты – 700 клеток/мкл (37%), РНК ВИЧ неопределяемая. ЭКГ – без патологии. Проконсультирована у кардиолога. Диагноз: гиперлипидемия типа 2а, сердечно-сосудистый риск по шкале Framingham – низкий (1,2%).
В связи с изменениями композиции тела и сохраняющейся гиперлипидемией лопинавир/ритонавир заменен на ETR. Через 2 года после замены состояние удовлетворительное, жалоб нет. Образование в области шеи существенно уменьшилось в размерах, но окончательно не исчезло. Биохимический анализ крови: ОХ – 5,59 ммоль/л, ТГ – 1,33 ммоль/л, ЛПНП –3,1 ммоль/л, ЛПОНП – 0,61 ммоль/л, ЛПВП – 1,64 ммоль/л, липаза – 17,2 ЕД/л. CD4+-лимфоциты – 805 клеток/мкл (48%), РНК ВИЧ неопределяемая. В настоящее время пациентка продолжает принимать измененную схему АРТ.
У описываемой больной было 2 фактора риска возникновения гиподистрофии: повышенный ИМТ и курение. Поэтому с целью профилактики указанных нарушений необходимо больше обращать внимание на существующие традиционные факторы риска перед началом лечения и при их наличии избегать назначения бустированных ИП. При формировании видимых изменений композиции тела даже замена схемы АРТ на более благоприятную и нормализация при этом лабораторных показателей липидного обмена не привели к полному восстановлению формы тела. Возможно, у данной больной решением проблемы является только хирургическое вмешательство.
Применение ETR у больных с коинфекцией ВИЧ/ХВГ
Под наблюдением специалистов Испании находились 211 больных ВИЧ-инфекцией, получавших в составе схемы АРТ препарат ETR [15]. 145 (69%) пациентов, помимо ВИЧ-инфекции, страдали хроническим гепатитом С (ХГС). У этих больных в крови регистрировали репликацию РНК вируса гепатита С (ВГС) и, по данным эластографии, у 37% был выявлен фиброз печени F1, а у 24% – F4. 66 (31%) больных, страдавших только ВИЧ-инфекцией, составили группу сравнения. Среди лиц с сочетанной инфекцией ВИЧ/ХГС 90% имели опыт внутривенного введения психоактивных веществ. В группе сравнения таких пациентов было только 5%. На момент назначения ETR медиана количества CD4+-лимфоцитов составляла 446 клеток/мкл (группа сочетанной инфекции) и 552 клетки/мкл (группа сравнения; p = 0,02). Доля больных с уровнем РНК ВИЧ < 50 копий/мл была равна 59 и 79% соответственно (p = 0,03).
Среди причин назначения схемы АРТ, включавшей ETR, преобладали токсические реакции, связанные с предшествующим режимом (64 и 73% соответственно). У 36 и 27% больных причиной назначения ETR была вирусологическая неудача. У 62% пациентов ETR назначали совместно с 2 НИОТ, у 17% – вместе с DRV/r, у 10% – с RAL и у 10% – DRV/r + RAL + MVC.
Медиана периода наблюдения составила 611 дней. Вирусологическая неудача схемы АРТ, включавшей ETR, составила 9–11%. Прерывание терапии ETR отметили у 26 и 21% больных соответственно (р = 0,27). Появление кожно-аллергической сыпи вследствие терапии ETR зафиксировали у 5–8% больных. Лишь у 1 (0,5%) больного с выраженным фиброзом печени (F4), получавшего режим «спасения» (ETR + DRV/r + MVC + 2 НИОТ), наблюдали повышение уровней АлАТ и АсАТ 3–4-й степени токсичности. Еще у 15 (7%) пациентов регистрировали повышение уровней печеночных ферментов до 1–2-й степени токсичности, которое у 12 больных было связано с течением ХГС. Наличие у пациентов выраженного фиброза печени не ассоциировалось с повышенным риском прерывания терапии ETR или неэффективностью лечения. В течение первых 6 месяцев лечения ETR медиана прироста количества CD4+-лимфоцитов у больных с сочетанной инфекцией была несколько меньше (23 и 86 клеток/мкл соответственно; p = 0,02) [15].
Определенные сложности возникают при выборе схемы АРТ у больных с сочетанной инфекцией в случае необходимости проведения терапии ХГС. Помимо наличия лекарственных взаимодействий между АРВП и препаратами для терапии ХГС имеет место суммация НЯ, связанных с лечением, в особенности при использовании препаратов из группы НИОТ [16].
В связи с этим целью проведенного нами исследования была оценка эффективности и безопасности схемы АРТ, включавшей ETR, у больных с сочетанной инфекцией ВИЧ/ХГС, получавших лечение ХГС.
Под наблюдением находились 23 больных ВИЧ/ХГС (18 мужчин и 5 женщин, медиана возраста – 33 года), которым была назначена терапия ХГС препаратами пегилированного интерферона (ПегИФН) и рибавирина (РБВ). Все пациенты получали АРТ, включавшую ETR: 18 больных в сочетании с ИП ВИЧ, 3 пациента – с 2 НИОТ и 2 пациента – в комбинации с RAL.
До начала терапии ХГС у всех пациентов регистрировали РНК ВГС (медиана – 6,2 lg). Генотип 1 ВГС имел место у 9 пациентов, генотипы 2 или 3 – у 14. Медиана уровня АлАТ до лечения составляла 49,2 МЕ/л. Исходно повышенный уровень АлАТ 1–2-й степени токсичности зарегистрировали у 34,8% больных, 3-й степени – у 4,3% больных. РНК ВИЧ была < 400 копий/мл у 78,3% больных, медиана количества CD4+-лимфоцитов составляла 454 клетки/мкл (у 4,3% пациентов – < 200 клеток/мкл).
Через 12 недель терапии ХГС у 89,5% больных РНК ВИЧ была < 400 копий/мл, медиана количества CD4+-лимфоцитов снизилась до 272 клеток/мкл, а у 20% больных – до уровня < 200 клеток/мкл, что было связано с терапией ПегИФН. У 85,7% больных спустя 12 недель лечения не регистрировали репликации РНК ВГС. Медиана уровня активности АлАТ уменьшилась до 25,3 МЕ/л. Только у 1 (5,6%) пациента отмечали повышение уровня АлАТ, соответствующее 1-й степени токсичности.
Через 24–48 недель лечения у 94,4–100% больных сохранялся неопределяемый уровень РНК ВИЧ, медиана количества CD4+-лимфоцитов составляла 266–238 клеток/мкл. У 25–28% больных количество CD4+-лимфоцитов было < 200 клеток/мкл, при этом не регистрировали развития вторичных заболеваний. К концу лечения ХГС у всех пациентов отсутствовала репликация РНК ВГС. Медиана уровня АлАТ колебалась от 15,7 до 24,6 МЕ/л, а доля пациентов с уровнем АлАТ, повышенным до 1–2-й степени токсичности, составляла 7,1–10,5%.
Спустя 24 недели после завершения терапии ХГС у 83,3% больных сохранялся неопределяемый уровень РНК ВИЧ. Отмеченo восстановление медианы количества CD4+-лимфоцитов до 403 клеток/мкл, а доля больных с числом CD4+-лимфоцитов < 200 клеток/мкл уменьшилась до 15,4%. Устойчивый вирусологический ответ (УВО – неопределяемый уровень РНК ВГС) на терапию ХГС имел место у 62,5% больных. Медиана уровня АлАТ составляла 21 МЕ/л. У 15,4% пациентов наблюдали повышение уровня АлАТ до значений 1–2-й степени токсичности, что было обусловлено течением ХГС. У всех этих больных был выявлен ВГС генотипа 1, и не был достигнут УВО при терапии ХГС.
Ни в одном случае схема АРТ не была изменена или временно отменена из-за развития НЯ.
Таким образом, применение препарата ETR в схемах АРТ у больных с сочетанной инфекцией ВИЧ/ХГС, в том числе получавших лечение ХГС ПегИФН и РБВ, было эффективным и безопасным. Не выявлено существенного влияния степени фиброза печени на эффективность и безопасность терапии ETR. В процессе сочетанного лечения (АРТ и терапия ХГС) у 90–100% больных сохранялся неопределяемый уровень РНК ВИЧ, а снижение количества CD4+-лимфоцитов, связанное с применением ПегИФН, было транзиторным и не привело к развитию вторичных заболеваний. Об эффективности и безопасности сочетанной терапии свидетельствовало и уменьшение медианы уровня АлАТ. Ни у одного из пациентов в процессе лечения не наблюдали повышения уровня АлАТ выше 2-й степени токсичности, а обнаружение повышенных уровней АлАТ через 24 недели после завершения терапии ХГС свидетельствовало о недостаточной эффективности лечения ПегИФН и РБВ, а не о гепатотоксичности схемы АРТ.
Результаты проведенных исследований убедительно обосновывают применение препарата ETR в составе схем АРТ как при наличии предшествующей неудачи терапии (схемы АРТ второй и последующих линий лечения), так и при развитии НЯ, связанных с проводимым лечением, в том числе и у пациентов с сочетанной инфекцией ВИЧ/ХГС.


