Вирус иммунодефицита человека (ВИЧ) отличается значительной генетической вариабельностью, что связано с высокой скоростью размножения, большим размером вирусной популяции в организме инфицированного человека, особенностями работы ферментов, отвечающих за репликацию генома ВИЧ, и рекомбинациями. В связи с этим ВИЧ представляет собой гетерогенную группу, в которой выделяют 2 типа вируса (эпидемически значимый ВИЧ-1 и относительно редкий ВИЧ-2), каждый из которых в свою очередь делится на группы и целый ряд субтипов, циркулирующих (CRF) и уникальных (URF) рекомбинантных форм [1, 2].
Распределение различных субтипов и вариантов в мире неоднородно. В Российской Федерации наибольшее (до 85%) распространение получил тип ВИЧ-1, генетический вариант IDU-А субтипа А1, в меньшей степени – субтип В, рекомбинант CRF03_АВ и некоторые другие [3].
Вопрос генетической вариабельности ВИЧ в последнее время приобретает все большее значение для практической медицины. С внедрением в арсенал диагностических средств новых молекулярно-генетических методов появилась возможность решения ряда прикладных задач. Клиницисты получили инструмент для научно обоснованного назначения и замены схем терапии ВИЧ-инфекции путем выявления мутаций лекарственной устойчивости в геноме вируса [3–5]. Дополнительные горизонты открылись перед эпидемиологами: данные филогенетического анализа первичной структуры геномов применяются при эпидемиологических расследованиях случаев передачи ВИЧ [6, 7]. Анализ циркуляции на определенной территории разных генетических вариантов ВИЧ позволяет устанавливать пути передачи вируса и идентифицировать группы риска, а также прогнозировать динамику эпидемии [8].

На сегодняшний день на территории Иркутской области зарегистрировано более 44 000 человек, инфицированных ВИЧ. Тем временем данные о генетическом разнообразии ВИЧ остаются довольно скудными. В литературных источниках имеются сведения о доминирующем положении в нашем регионе варианта IDU-А субтипа А1 ВИЧ-1, другие субтипы выявлены не были [9]. С 2006 г. началось применение высокоактивной антиретровирусной терапии (ВААРТ), которая, как мощный эволюционный фактор, должна была привести к появлению в популяции штаммов ВИЧ с мутациями лекарственной устойчивости. Однако долгое время данный вопрос оставался без должного внимания.
Цель исследования – оценка генетического разнообразия ВИЧ на территории Иркутской области и анализ спектра мутаций лекарственной устойчивости.
 Материалы и методы
Материалы и методы
В работе использовали плазму крови от 65 ВИЧ-инфицированных, проживающих на территории Иркутской области, находящихся на диспансерном наблюдении в Иркутском областном центре по профилактике и борьбе со СПИД и инфекционными заболеваниями, на момент исследования получавших лечение антиретровирусными препаратами (АРВП). Применявшиеся схемы ВААРТ приведены в табл. 1. Причинами направления пациентов на определение молекулярно-генетического профиля вируса были признаки вирусологической неэффективности ВААРТ (отсутствие недетектируемой вирусной нагрузки после 6 мес. терапии, «всплески» вирусной нагрузки ВИЧ в процессе терапии после первичного подавления репликации вируса). Полученный клинический материал использовали с информированного согласия пациентов. Вирусная нагрузка в образцах составляла от 1000 до 150 000 копий/мл, по данным определения с применением коммерческих тест-систем Real Time HIV-1 («Abbott», США), Cobas AmpliPrep/TaqMan HIV-1Test («Хоффманн-Ла Рош», Швейцария), РеалБест РНК ВИЧ («Вектор-Бест», Россия) и набора реагентов АмплиСенс® ВИЧ-Монитор-FRT («ИнтерЛабСервис», Россия).
Молекулярно-генетический профиль ВИЧ определяли с помощью коммерческих тест-систем АмплиСенс®HIV-Resist-Seq («ИнтерЛабСервис», Россия) и ViroSeq HIV-1 («Abbott», США), предназначенных для анализа гена pol, кодирующего протеазу, обратную транскриптазу и интегразу. На первом этапе выполняли лизис вируса и очистку препарата с целью получения РНК ВИЧ. Далее проводили реакцию обратной транскрипции для получения комплементарной ДНК, затем полимеразную цепную реакцию (ПЦР) для накопления изучаемого фрагмента гена pol ВИЧ. С очищенным ПЦР-продуктом проводили реакцию циклического секвенирования с использованием меченых флюоресцентными красителями дидезоксинуклеотидов (ddNTP). После очистки продуктов секвенирования и денатурации их в формамиде проводили процедуру капиллярного электрофореза в полимере POP-7 для детекции нуклеотидной последовательности с помощью автоматического анализатора молекул ДНК ABI PRISM 3500.
 Полученные последовательности генома ВИЧ-1 выравнивали в программе Sequencher (version 4.1.4) в соответствии с вариантом ВИЧ-1 HXB2 (регистрационный номер GeneBank K03455). Множественное выравнивание проводили с применением программы BioEdit (version 7.2.5). Для филогенетического анализа использовали метод максимального правдоподобия на основе модели Тамуры–Нэя в программе MEGA 6 [10, 11].
Полученные последовательности генома ВИЧ-1 выравнивали в программе Sequencher (version 4.1.4) в соответствии с вариантом ВИЧ-1 HXB2 (регистрационный номер GeneBank K03455). Множественное выравнивание проводили с применением программы BioEdit (version 7.2.5). Для филогенетического анализа использовали метод максимального правдоподобия на основе модели Тамуры–Нэя в программе MEGA 6 [10, 11].
Для анализа мутаций и определения профиля резистентности использовали программу интерпретации мутаций лекарственной устойчивости HIVdb Program: Sequence Analysis (version 7.0, 27.02.2014), представленную на сайте Стэндфордского университета (http://www.hivdb.stanford.edu). Для определения субтипов ВИЧ-1 была выбрана референс-программа COMET HIV-1/2 (version 1.0, 26.03.2014) (http://comet.retrovirology.lu) [12, 13].
Результаты и обсуждение
Анализ фармакорезистентности проводили у пациентов, принимавших АРВП. Мутации лекарственной устойчивости были выявлены в образцах от 41 (63%) пациента. Из них в 58,46% случаев обнаружены мутации лекарственной устойчивости к нуклеозидным ингибиторам обратной транскриптазы (НИОТ), в 35,38% — к ненуклеозидным ингибиторам обратной транскриптазы (ННИОТ), в 10,77% — к ингибиторам протеазы (ИП) и в 3,08% случаев — к ингибиторам интегразы (ИИ).
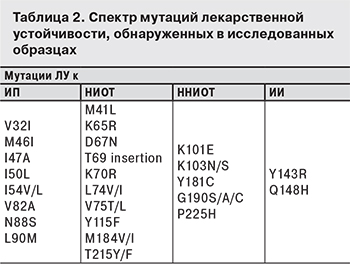
Спектр мутаций лекарственной устойчивости, обнаруженных в исследованных образцах, представлен в табл. 2. Ведущую позицию (58,46%) занимает мутация устойчивости к НИОТ M184V/I в гене обратной транскриптазы ВИЧ-1, значительно снижающая чувствительность к ламивудину и эмтрицитабину. Затем следуют 3 мутации резистентности к ННИОТ (эфавирензу и невирапину) – G190S/A/C (24,14%), K103N/S (15,52%), K101E (15,52%), и одна мутация к НИОТ – L74V/I (18,97%), снижающая чувствительность к нетимидиновым аналогам нуклеозидов (диданозину и, в меньшей степени, абакавиру). В двух образцах выявлены инсерции в позициях: E35 в гене протеазы (не является мутацией резистентности) и T69 в гене обратной транскриптазы (редкая мутация, обусловливающая высокий уровень устойчивости вируса к зидовудину, ставудину, диданозину, абакавиру и тенофовиру).
Такое распределение частот встречаемости мутаций лекарственной устойчивости, по всей видимости, связано с основными схемами терапии, применяемыми в Иркутской области. Относительная редкость встречаемости мутаций устойчивости к ИП связана с высоким генетическим барьером данных препаратов, а к ИИ — с крайней редкостью применения данной группы препаратов в схемах терапии. Высокая распространенность мутаций устойчивости к НИОТ и частое сочетание фармакорезистентности одновременно к НИОТ и ННИОТ связаны с тем, что наиболее активно применялась схема терапии, содержащая 2 НИОТ и 1 ННИОТ, как правило, включающая ламивудин, азидотимидин и эфавиренз (см. табл. 1). Из этих 3 препаратов 2 обладают низким генетическим барьером к формированию лекарственной устойчивости (ламивудин и эфавиренз) [14–16].
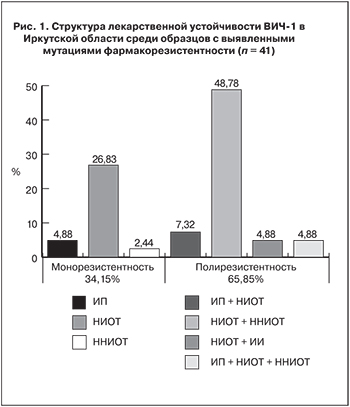
В исследованных образцах выявлено 7 различных профилей фармакорезистентности ВИЧ-1 (рис. 1). Мутации лекарственной устойчивости лишь к одной группе препаратов встречались достаточно редко (34,15%). Среди полирезистентных штаммов доминирует комбинация НИОТ + ННИОТ (48,78%), фармакорезистентность сразу к 3 группам препаратов (ИП + НИОТ + ННИОТ) выявлена в 4,88% случаев.
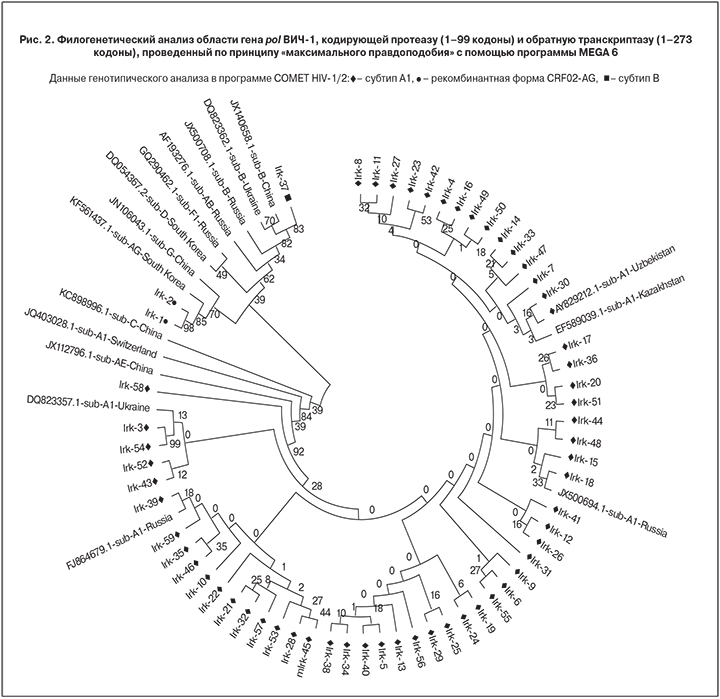
По данным филогенетического анализа участка гена pol (1116 п. н.), кодирующего ферменты протеазу (1–99 кодоны) и обратную транскриптазу (1–273 кодоны), 2 образца (Irk-1 и Irk-2) кластеризовались в 85 построениях из 100 на одной ветви филогенетического древа с ВИЧ-1 рекомбинантной формы CRF02-AG, выделенным на территории Южной Кореи. Образец Irk-37 в 82 построениях из 100 кластеризовался совместно с изолятами вируса субтипа В, выделенными на территории европейской части Российской Федерации, Украины и Китая. Все остальные образцы занимают общую ветвь с изолятами ВИЧ-1 варианта IDU-A субтипа А1, выделенными на территории РФ, Украины, Узбекистана и Казахстана (рис. 2).
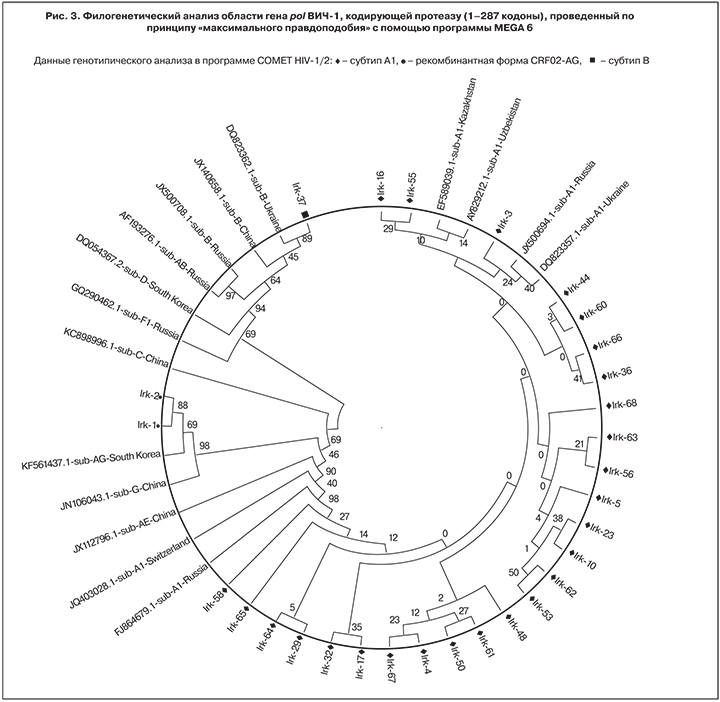
Филогенетический анализ фрагмента гена pol (861 п. н.), кодирующего фермент интегразу (1–287 кодоны), показал аналогичные результаты: образцы Irk-1 и Irk-2 отнесены к рекомбинантной форме CRF02-AG, образец Irk-37 — к субтипу В, остальные образцы кластеризуются с ВИЧ-1 варианта IDU-A субтипа А1 (рис. 3).
Изученные последовательности были также проанализированы с применением on-line программы для генотипирования ВИЧ COMET HIV-1/2. Полученные данные полностью соответствовали результатам филогенетического анализа. Этот факт говорит о достаточности длины полученных последовательностей для генотипирования ВИЧ в данной программе.
Анализ распространенности разных субтипов ВИЧ-1 показал, что на территории Иркутской области доминирует субтип А1 – 95,38%. Выявленные образцы субтипа B и рекомбинантной формы CRF02-AG (1,54 и 3,08% соответственно) ранее не были отмечены в нашем регионе [9]. По-видимому, они представляют собой заносы из других регионов РФ и мира, так как субтип В регулярно выявляется в западных регионах нашей страны, а CRF02-AG преимущественно распространен в странах Западной Африки, Центральной и Юго-Восточной Азии [3, 4].
Таким образом, на территории Иркутской области по-прежнему доминирует вариант IDU-A субтипа А1 ВИЧ-1. В то же время в единичных случаях стали выявляться новые субтипы и циркулирующие рекомбинантные формы – субтипы В и CRF02-AG, ранее не отмечавшиеся в нашем регионе, что скорее всего связано с повышением миграционной активности населения.
Среди пациентов, принимающих АРВП, мутации лекарственной устойчивости выявлены в 63% случаев, причем преобладают мутации к наиболее часто назначавшимся препаратам из групп НИОТ и ННИОТ. Устойчивость к ИП и ИИ отмечается достаточно редко, что связано с высоким генетическим барьером препаратов из группы ИП и ограниченным применением препаратов из группы ИИ. Среди исследованных образцов преобладают полирезистентные штаммы с мутациями лекарственной устойчивости как минимум к двум группам препаратов.


