Предупреждение и лечение послеоперационных бактериальных и грибковых инфекций в хирургии высоких технологий, в частности в трансплантологии, с каждым годом осложняется появлением все новых популяций мульти- и панрезистентных штаммов госпитальной микрофлоры. Отсутствие ожидаемого эффекта, токсичность и осложнения, которые ассоциируются с терапией традиционными антибиотиками, приводят к активации исследовательских направлений, связанных с разработкой новых препаратов, путей и способов лечения, главные достоинства которых заключаются в возможности преодоления антибиотикорезистентности патогенов.
Опубликованные к настоящему времени работы свидетельствуют о положительных результатах применения пробиотиков для химиотерапии инфекционных заболеваний разного генеза. Пробиотики – жизнеспособные микроорганизмы или препараты, содержащие такие микроорганизмы. К достаточно широко используемым пробиотикам относятся представители видов, составляющих нормальную микрофлору человека, например, бифидобактерии и лактобактерии. Среди изолятов из кишечной микрофлоры в качестве пробиотических широко применяют штаммы Streptococcus faecium, Streptococcus lactis, Streptococcus cremoris и Streptococcus diacetilactis. Особый интерес, по нашему мнению, представляет возможность использования в медицинской практике пробиотиков, являющихся микроорганизмами-транзитерами, например, бациллами. Попадая в желудочно-кишечный тракт, эти виды пробиотиков за время своего присутствия способствуют нормализации микробиоты пациента. Известно, что результатом сложных взаимоотношений бациллярных пробиотиков с микрофлорой пациента является биосинтез антибиотиков, что рассматривается в качестве существенных факторов воздействия одного вида микроорганизмов на другой (или другие).
Первым описанным бациллярным пробиотиком был штамм B. subtilis, выделенный в 1945 г. из раны [1]. Результатом обширных исследовательских работ явилось выделение антибиотика бацитрацина, активного в отношении как грамположительных, так и грамотрицательных микроорганизмов. Существенная особенность бацитрацина – низкая токсичность и эффективность в отношении ряда антибиотикорезистентных штаммов [2]. Сочетание бацитрацина с неомицином эффективно в отношении большинства клинических изолятов устойчивого стафилококка (MRSA), что весьма важно для современной антимикробной терапии. С 2010 г. бацитрацин разрешен в США для лечения стафилококковых инфекций у новорожденных [3]. В медицинской практике разных стран используют биопрепараты на основе бактерий рода Bacillus. Так, в странах Западной Европы применяют пробиотик бактисубтил («Marion Merrell», Франция) и его аналог флонивин БС («Galenika», Словения). В основе этих препаратов – штамм B. cereus IP 5832 из коллекции Института Пастера (Париж). Известен также биопрепарат цереобиоген («Xing Jian», Китай), действующее начало которого – штамм B. cereus DM-423. Вьетнамский препарат биосубтил в качестве активного компонента содержит штамм B. subtilis. В России зарегистрировано 3 препарата на основе бацилл: биоспорин, споробактерин и бактиспорин. В основе споробактерина и бактиспорина – штаммы B. subtilis 534 и B. subtilis 3Н соответственно. Биоспорин является единственным комплексным препаратом, в его основе – 2 штамма: B. subtilis 2335 и B. licheniformis 2336. К отечественным лекарственным препаратам, созданным на основе Bacillus subtilis, относится споробактерин [4].
 Целью данной работы явилось изучение свойств, уточнение филогенетического положения, а также антимикробного спектра и природы антибиотической активности штамма B. subtilis 534.
Целью данной работы явилось изучение свойств, уточнение филогенетического положения, а также антимикробного спектра и природы антибиотической активности штамма B. subtilis 534.
Материалы и методы
Объектом исследования служил штамм Bacillus subtilis 534, высеянный из препарата споробактерин жидкий. После проведения соответствующих исследований штамм Bacillus subtilis 534 был депонирован в Коллекции культур микроорганизмов Научно-исследовательского института по изысканию новых антибиотиков им. Г.Ф. Гаузе под номером ИНА 01122.
Условия культивирования. Для поверхностного культивирования штамма 534 и тест-штаммов использовали модифицированную агаровую среду № 2 Гаузе следующего состава: глюкоза – 1%, пептон – 0,5%, триптон – 0,3%, NaCl – 0,5%, агар – 2%, вода водопроводная; рН 7,2–7,4. Для глубинного культивирования использовали ту же среду без агара. Глубинное культивирование штамма 534 осуществляли в колбах Эрленмейера объемом 750 мл, содержащих 100 мл среды, на роторной качалке (220 об/мин) при 28 С. Грибные тест-культуры и L. mesenteroides выращивали при температуре 28 С, все другие штаммы – при 37 С.
Идентификация штамма B. subtilis 534 по последовательности ДНК гена16S рРНК. Для анализа нуклеотидных последовательностей гена 16S рРНК штамма 534 методом полимеразной цепной реакции (ПЦР) использовали универсальные праймеры 27f (aga gtt tga tcc tgg ctc ag), 1492r (tac ggy tac ctt gtt acg act t). Был выбран режим проведения ПЦР: 95 С – 3 мин; 25 циклов с чередованием температурных интервалов 95 С – 30 с, 51 С – 30 с, 72 С – 90 с; 72 С – 7 мин. Анализ продуктов ПЦР проводили методом электрофореза в 1% агарозном геле при напряженности электрического поля 5 В/см. Очистку продуктов ПЦР осуществляли методом прямого переосаждения ДНК в мягких условиях (0,125 М ацетата аммония в 70% этиловом спирте). Секвенирование очищенных фрагментов ДНК проводили на автоматическом секвенаторе Genetic Analyzer 3500 («Applied Biosystems», США). Для определения последовательностей использовали базы данных GenBank (http://www.ncbi.nlm.nih.gov) и Ribosomal Database Project (http://www.cme.msu.edu). С помощью программы Mega 5.6 на основе типовых штаммов было построено дерево филогенетического родства.
 Определение антимикробной активности. Антимикробную активность определяли методом диффузии в агар.
Определение антимикробной активности. Антимикробную активность определяли методом диффузии в агар.
В условиях поверхностного культивирования к штамму B. subtilis 534 подсевали штрихами тест-штаммы и после инкубирования определяли расстояние задержки роста тест-штаммов под действием веществ, выделяемых штаммом 534.
Об антимикробной активности штамма Bacillus subtilis 534 при глубинном культивировании судили по диаметрам зон задержки роста тест-штаммов вокруг лунок в агаровой среде, в которые закапывали культуральную жидкость. При выделении и очистке антимикробных веществ образцы наносили на бумажные диски, которые размещали на поверхности агаровой среды, зараженной тест-штаммом, и после инкубирования определяли диаметры зон задержки роста тест-штаммов.
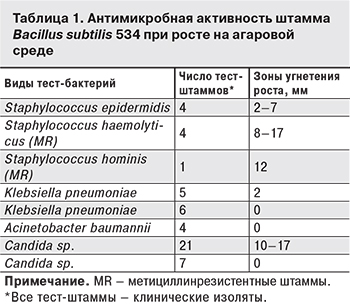
В качестве тест-штаммов для определения антимикробной активности использовали следующие 17 коллекционных тест-штаммов: грамположительные бактерии Bacillus subtilis АТСС 6633, Bacillus mycoides 537, Bacillus pumilis NCTC 8241, Leuconostoc mesenteroides ВКПМ B-4177, Micrococcus luteus NCTC 8340, Staphylococcus aureus FDA 209P (MSSA), S. aureus ИНА 00761 (MRSA), S. haemolyticus ИНА 01119, S. epidermidis ИНА 01120, S. epidermidis ИНА 01121; грамотрицательные бактерии Acinetobacter lwoffii ИНА 01115, Escherichia coli ATCC 25922, Klebsiella pneumoniae ИНА 01117, Klebsiella pneumoniae ИНА 01118, Pseudomonas aeruginosa ATCC 27853; грибы Aspergillus niger ИНА 00760, Saccharomyces cerevisiae RIA. Для определения антимикробной активности также использовали клинические изоляты, представленные в табл. 1.
Выделение, очистка и предварительная характеристика антибиотика. Через колонку, заполненную 80 мл сорбента Amberlite XAD-2, пропускали 0,8 л культуральной жидкости штамма Bacillus subtilis 534. Антибиотик десорбировали смесью н-бутанол–ацетон–вода (1:1:1) при нейтральном значении рН. Полученные элюаты упаривали в вакууме досуха при 37 °С и сухой остаток растворяли в 60% водном этаноле. Дальнейшую очистку антибиотика проводили в колонке, заполненной силикагелем Kieselgel 60 («Merck», Германия), используя ступенчатую элюцию растворителями хлороформ–метанол (9:1, 8:2, 7:3, 6:4 и 5:5). Фракции с колонки проверяли на биологическую активность в отношении тест-штамма Staphylococcus aureus ИНА 00761 (MRSA). Активную фракцию упаривали досуха, растворяли в метаноле и анализировали методом тонкослойной хроматографии (ТСХ) на пластинах с силикагелем в системе растворителей этилацетат–метанол (1:4) с последующей биоавтографией на газоне тест-штамма B. subtilis ИНА 00761. Спектр УФ-поглощения определяли на спектрофотометре UV-1601 PC («Shimadzu», Япония).
Результаты и обсуждение
Лекарственный препарат споробактерин жидкий представляет собой взвесь спор штамма Bacillus subtilis 534 в 7% растворе натрия хлорида. Для определения антимикробной активности этого препарата методом диффузии в агар препарат был разведен в 10 раз для снижения гипертоничности раствора, которая могла повлиять на рост тест-культур. С помощью 17 тест-штаммов, перечисленных выше, нами было показано, что сам препарат не обладает антибиотическим действием, однако при поверхностном культивировании штамм 534 проявляет активность в отношении многих грамположительных и грамотрицательных клинических бактериальных изолятов, а также грибков рода Candida (см. табл. 1). В общей сложности проявлена антибиотическая активность в отношении 35 из 52 штаммов: всех штаммов трех видов стафилококков (9 штаммов), 21 штамма из 28 представителей рода Candida и 5 из 11 штаммов Klebsiella pneumoniae. Антибиотического действия в отношении 4 штаммов Acinetobacter baumannii обнаружено не было.
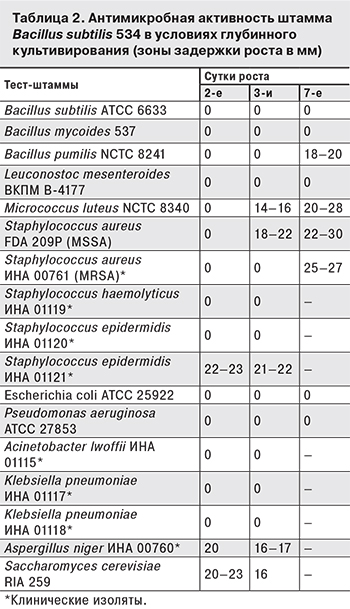
Из литературы известно, что в результате применения споробактерина отмечено значительное снижение частоты выделения условно-патогенной микрофлоры: золотистого стафилококка, протея, клебсиелл, дрожжевых грибков [4–8]. Возможно, при пероральном введении за время пребывания в кишечнике штамм 534 как трензитерный пробиотик изменяет состав микрофлоры за счет образования антибиотика (антибиотиков). Для выявления образования антибиотиков в глубинных условиях проводились эксперименты с оценкой антимикробных свойств культуральной жидкости штамма 534 на 2-е, 3-и и 7-е сутки роста (табл. 2). Можно предположить, что в культуральной жидкости штамма 534 образуется не менее трех антибиотиков: один эффективен в отношении грамположительных бактерий, образуется на 3-и сутки (тест-штаммы NCTC 8241 и ИНА 00761), и его концентрация к 7-м суткам возрастает (тест-штаммы NCTC 8340, FDA 209P); второй эффективен в отношении Staphylococcus epidermidis ИНА 01121, образуется на 2-е сутки роста, и его концентрация в среде остается неизменной на 3-и сутки; третий – противогрибковый антибиотик, образуется на 2-е сутки роста, его концентрация снижается на 3-и сутки.
Для изучения противогрибкового антибиотика использовали двухсуточную культуральную жидкость штамма 534. Биологическими тестами при выделении и очистке антибиотика были штаммы грибов Aspergillus niger ИНА 00760 и Saccharomyces cerevisiae RIA 259. Дополнительным тестом был штамм S. epidermidis ИНА 01121, в отношении которого также наблюдали активность на 2-е сутки роста. Зона, обладающая антибиотической активностью, на ТСХ имеет Rf = 0,5. Антибиотик, элюированный из активной зоны, поглощает свет при длине волны 222, 267, 275 и 287 нм, что позволяет отнести его к антибиотикам полиенам, а именно к триенам. Триены – наименьшая по численности группа среди полиенов [9]. Из продуцентов триеновых антибиотиков рода Bacillus известны B. aurantinus, образующий антибиотик аурантинин [10], и B. licheniformis, образующий антибиотик протицин [11]. По спектрам поглощения антибиотик штамма B. subtilis 534 наиболее близок к антибиотику аурантинину, но отличается от него по антимикробному спектру, подавляя рост не только бактерий, но и тест-грибков (см. табл. 2).
Антибиотики относятся к вторичным метаболитам, в связи с этим штаммы-продуценты антибиотиков одного вида могут различаться по этому признаку. Известно большое количество антибиотиков, образуемых видами рода Bacillus. Например, у B. subtilis известно более 100 антимикробных веществ различной химической природы [3, 12–15]. По механизму действия среди них есть антибиотики с узким спектром действия, например, бактериоцины, действующие на определенные варианты клеток в популяции собственного вида-продуцента, то есть выступающие в качестве фактора внутривидовой борьбы и регулирующие состав популяции [4, 15–17]. Другие антибиотики, напротив, обладают широким антимикробным спектром действия, например, лантибиотики и липопептиды [13]. Один и тот же штамм может быть продуцентом нескольких антибиотиков, образуемых в разных условиях или в разные сроки культивирования [17]. Нами было проведено сравнение штамма 534 с другими бациллами по структуре гена 16S рРНК. Было прочитано 1413 п. н. в последовательности гена 16S рРНК, депонированной в международной базе GenBank под номером KU051696. Филогенетическое положение штамма 534 отражено относительно типовых штаммов рода Bacillus из базы GenBank (см. рисунок). Первичный скрининг по базе данных GenBank подтвердил, что штамм 534 (= ИНА 01122) относится к виду Bacillus subtilis, и наиболее близкой к последовательности KU051696 штамма 534 является последовательность типового штамма Bacillus subtilis DSM10 (совпадение на 99,4%).
Анализ результатов проведенных экспериментальных исследований позволил выявить новое, не описанное ранее свойство изучаемого пробиотического штамма Bacillus subtilis 534. Показано, что в условиях глубинного культивирования штамм ИНА 01122 образует противогрибковые и антибактериальные вещества. Это, на наш взгляд, дает убедительное обоснование правомерности гипотезы, согласно которой эффективность споробактерина связана прежде всего со способностью Bacillus subtilis 534 образовывать антибиотики в условиях культивирования in vivo. Именно свойство выделять противогрибковые и антибактериальные вещества может явиться основным объяснением эффективности споробактерина в предотвращении развития и лечении бактериальных и грибковых инфекций.

Выводы
1. По анализу 1413 п.н. в последовательности ДНК гена 16S рРНК подтверждена принадлежность штамма 534 к виду Bacillus subtilis. Последовательность депонирована в международной базе GenBank под номером KU051696.
2. Лекарственный препарат споробактерин при анализе в десятикратном разведении непосредственно не обладает антибиотическим действием.
3. В условиях культивирования in vitro штамм Bacillus subtilis 534, представляющий основу лекарственного препарата споробактерина, подавляет рост ряда грамположительных и грамотрицательных бактериальных, а также грибных тест-штаммов.
4. В условиях искусственного культивирования антибиотики, выделяемые штаммом Bacillus subtilis 534, подавляют рост ряда штаммов: представителей видов Staphylococcus aureus (в том числе штамма MRSA), S. epidermidis, S. haemolyticus (MR) S. hominis (MR), Bacillus pumilis, Micrococcus luteus, K. рneumoniae, Candida sp., Aspergillus niger, Saccharomyces cerevisiae.
5. В условиях глубинного культивирования штамм B. subtilis 534 образует не менее трех антибиотиков, один из которых относится к группе полиенов, а именно триенов.


