В последние годы возрастает интерес к изучению роли условно-патогенных микроорганизмов (УПМ) в инициации различных заболеваний [1, 2]. Это связано со значительным увеличением удельного веса инфекций и расширением спектра клинических проявлений заболеваний, вызываемых УПМ, на фоне нарушений механизмов защиты организма [3]. Рост заболеваемости, обусловленной УПМ, происходит не только среди иммунокомпрометированных лиц с выраженными иммунными нарушениями, но и среди иных групп населения (беременные, родильницы, дети грудного и раннего возраста) [4, 5]. На сегодняшний день основными бактериальными возбудителями болезней у детей раннего возраста продолжают оставаться пневмотропные УПМ – Streptococcus pneumoniae и Haemophilus influenzae типа b, занимающие лидирующие позиции среди причин детской смертности [6]. По данным ВОЗ, более 1,6 млн человек ежегодно умирает от пневмококковой и гемофильной инфекции, причем 1 млн из них – дети в возрасте до 5 лет. Наиболее высокие показатели заболеваемости регистрируются среди детей младшего возраста, поэтому они являются основной целевой группой для проведения вакцинации.
До настоящего времени не до конца изучены патогенетически значимые механизмы развития данных заболеваний, продолжается поиск ранних прогностических критериев, позволяющих формировать группы риска развития и хронизации бактериальной инфекции, вызванной условно-патогенными микроорганизмами у новорожденных детей [2].
Одним из перспективных направлений является изучение системы врожденного иммунитета, в частности, группы Toll-подобных рецепторов (TLR) [7–9], которые осуществляют распознавание молекулярных паттернов, ассоциированных с различными микроорганизмами, запуская эффекторные механизмы врожденного иммунитета [10–12]. Активация TLR приводит к индукции широкого спектра биологических реакций, в том числе синтеза провоспалительных цитокинов и Т-клеточной активации, определяющей развитие адаптивного иммунного ответа [12].
 Цель исследования – оценка роли факторов естественного (уровень экспрессии TLR2, TLR4, провоспалительных цитокинов) и адаптивного (содержание антител IgG) иммунитета к возбудителям S. рneumoniae и H. influenzae типа b у новорожденных детей в зависимости от отягощенности инфекционного анамнеза их матерей.
Цель исследования – оценка роли факторов естественного (уровень экспрессии TLR2, TLR4, провоспалительных цитокинов) и адаптивного (содержание антител IgG) иммунитета к возбудителям S. рneumoniae и H. influenzae типа b у новорожденных детей в зависимости от отягощенности инфекционного анамнеза их матерей.
Материалы и методы
Обследованы 180 новорожденных, родившихся от женщин активного репродуктивного периода в возрасте от 18 до 44 лет (средний возраст – 27,2 ± 0,7 года) в МБУЗ «Родильный дом № 2» г. Ростова-на-Дону.
На основании инфекционного анамнеза были выделены 2 клинические группы новорожденных. В 1-ю группу были включены 140 новорожденных, у матерей которых во время беременности были верифицированы различные инфекционно-воспалительные заболевания. Так, у 30 (16,7%) женщин наблюдали один или несколько эпизодов ОРЗ с развитием острых или обострением хронических очагов инфекции ЛОР-органов, у 75 (41,7%) – острые или обострения хронических инфекционно-воспалительных заболеваний органов мочеполовой системы. У 35 (19,4%) женщин одновременно были зарегистрированы изменения ЛОР-органов, дыхательной и мочеполовой системы. Во 2-ю группу вошли 40 новорожденных с благоприятным инфекционным анамнезом, у матерей которых во время беременности не развивались патологии инфекционно-воспалительного генеза. Обследование проводили с информированного согласия родителей. Материалом для исследования явилась пуповинная кровь.
У новорожденных 1-й и 2-й групп исследовали экспрессию TLR на мононуклеарных клетках (МНК) пуповинной крови и продукцию провоспалительных цитокинов в супернатантах культур клеток. В пуповинной крови новорожденных влияние вакцинных препаратов – 23-валентной полисахаридной пневмококковой вакцины (ППВ23) Пневмо 23 и полисахаридной конъюгированной вакцины для профилактики инфекции, вызываемой H. influenzae типа b, Акт-Хиб («Санофи Пастер», Франция) – определяли по уровню экспрессии TLR2, TLR4 и продукции цитокинов (ИЛ-1β, ИЛ-6 и ФНО-α). Для этого из гепаринизированной пуповинной крови (25 ЕД на 1 мл крови) выделяли МНК в градиенте плотности фиколла-урографина. МНК культивировали в полной культуральной среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 25 мМ НЕPES (НПП «ПанЭко», Россия), 2 мМ L-глутамина (НПП «ПанЭко», Россия), 100 мкг/мл гентамицина (НПП «ПанЭко», Россия) при температуре 37 °С в атмосфере с 5% СО2. Рабочая концентрация МНК составила 1 х 106 клеток/мл.
Для определения экспрессии TLR2 и TLR4 на моноцитах периферической крови МНК инкубировали с FITC-мечеными антителами к TLR2 и TLR4 («Hycult Вiotech», Нидерланды) и с соответствующими изотипическими контролями в течение 30 мин. при температуре 4 °С. Анализ экспрессии проводили на многофункциональном ридере Synergy ТМ2. Оценивали среднюю интенсивность флюоресценции, величину выражали в условных единицах флюоресценции (у. е.). В качестве лигандов TLR использовали вышеуказанные вакцинные препараты. Оптимальные дозы препаратов были выбраны на основании результатов предварительного исследования. Спонтанную выработку цитокинов (ИЛ-1β, ИЛ-6, ФНО- α) определяли, культивируя МНК в полной культуральной среде RPMI-1640 без добавления стимуляторов. По окончании культивирования лимфоциты осаждали центрифугированием при 400 g в течение 15 мин.
 Продукцию цитокинов (ИЛ-1β, ИЛ-6, ФНО-α) определяли в супернатантах культур клеток методом ИФА (иммуноферментные тест-системы фирмы «Вектор-Бест», Новосибирск).
Продукцию цитокинов (ИЛ-1β, ИЛ-6, ФНО-α) определяли в супернатантах культур клеток методом ИФА (иммуноферментные тест-системы фирмы «Вектор-Бест», Новосибирск).
Исследование факторов адаптивного иммунитета проводили у новорожденных 1-й и 2-й групп. В сыворотке пуповинной крови методом ИФА определяли содержание IgG к белкам наружной мембраны S. pneumoniae и H. influenzae типа b. Для проведения ИФА использовали иммуноферментную систему производства НИИ вакцин и сывороток им. И.И. Мечникова [13].
Статистическую обработку результатов проводили с использованием статистических пакетов Microsoft Exel 2000 и Statistica для Windows XP с использованием параметрических и непараметрических методов статистики. При анализе полученных результатов определяли средние величины и стандартную ошибку (M ± m). Достоверность полученных данных оценивали при уровне значимости р < 0,05.
Результаты и обсуждение
При стимуляции клеточной культуры МНК вакцинными препаратами через 24 ч антигенного воздействия наблюдали повышение уровня экспрессии ТLR2 и ТLR4 в обеих клинических группах.
При проведении дальнейшего анализа влияния вакцин на уровень экспрессии TLR2, TLR4 и продукции цитокинов (ИЛ-1β, ИЛ-6, ФНО-α) рассчитывали коэффициенты стимуляции (КС). За единицу принимали уровень спонтанной экспрессии TLR и продукции цитокинов. КС рассчитывали как отношение показателей стимулированной экспрессии TLR2, TLR4 и концентрации цитокинов к показателям спонтанной экспрессии, что позволило определить их прирост и повысить стандартизацию метода.
При определении средних значений КС было установлено, что ППВ23 оказывала незначительный стимулирующий эффект на уровень экспрессии TLR в обеих исследуемых группах (табл. 1).
Необходимо отметить, что не было выявлено различий между значениями КС у детей 1-й (КС TLR2 – 1,21 ± 0,1, TLR4 – 1,22 ± 0,1) и 2-й группы (КС TLR2 – 1,17 ± 0,05, TLR4 – 1,22 ± 0,1). Кроме того, не было установлено различий при рассмотрении КС между TLR2 и TLR4.
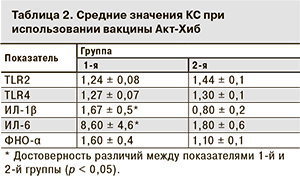
Аналогичные данные были получены и при использовании вакцины Акт-Хиб (табл. 2). В 1-й группе КС TLR2 составил 1,24 ± 0,08, TLR4 –1,27 ± 0,07, во 2-й – 1,44 ± 0,1 и 1,30 ± 0,1 соответственно.
 Достоверных отличий в уровне экспрессии TLR2 и TLR4, стимулированных изучаемыми вакцинами, установить не удалось.
Достоверных отличий в уровне экспрессии TLR2 и TLR4, стимулированных изучаемыми вакцинами, установить не удалось.
Определение функциональной активности TLR по величине КС продукции цитокинов в стимулированной культуре МНК оказалось более информативным.
Так, при использовании вакцины ППВ23 (см. табл. 1) показатели КС продукции ИЛ-1β были выше в 1-й группе по сравнению со 2-й: 1,80 ± 0,5 и 0,57 ± 0,1 соответственно (р < 0,05). Аналогичные изменения были установлены и в отношении ИЛ-6: КС у новорожденных 1-й группы был выше, чем у детей 2-й группы: 8,12 ± 3,6 и 2,50 ± 1,5 соответственно (р < 0,05). Достоверных различий в синтезе ФНО-α, индуцированном ППВ23, выявлено но не было.
При применении вакцины Акт-Хиб были получены аналогичные результаты изменений синтеза цитокинов в обеих группах (см. табл. 2). В 1-й группе значения КС синтеза ИЛ-1β (1,7 ± 0,5) и ИЛ-6 (8,6 ± 4,6) были выше (р < 0,05) по сравнению со значениями во 2-й группе (0,80 ± 0,2 и 1,80 ± 0,6 соответственно). Несмотря на тенденцию к увеличению продукции ФНО-α у детей 1-й группы (1,6 ± 0,4) по сравнению с детьми 2-й группы (1,1 ± 0,1), достоверных различий установить не удалось.
В ходе исследования при оценке факторов адаптивного иммунитета также выявлены различия. Было установлено, что содержание антител IgG к S. рneumoniae в пуповинной крови новорожденных 1-й группы было ниже, чем у детей 2-й группы. Аналогичные результаты были получены и в отношении H. influenzae типа b (табл. 3).
Полученные данные позволили установить, что стимуляция исследованными вакцинами МНК пуповинной крови детей обеих групп оказывала незначительный стимулирующий эффект на уровень экспрессии TLR2 и TLR4 вне зависимости от инфекционного анамнеза. При этом их функциональная активность, оцениваемая по уровню синтеза цитокинов (ИЛ-1β и ИЛ-6), была выше у детей 1-й группы. Это согласуется с данными Ю.Н. Александровой [14], свидетельствующими о повышении уровня провоспалительных цитокинов (ИЛ-1α, ИЛ-2, ИЛ-6) у новорожденных с отягощенным инфекционным анамнезом.
Увеличение циркулирующих пулов данных цитокинов, возможно, связано с развитием системной воспалительной реакции в ответ на микробную инвазию [14], что подтверждает их роль в запуске адаптивного иммунного ответа, а также регуляции количества и функциональной активности клеток-эффекторов (нейтрофилов, макрофагов, лимфоцитов). Повышение концентрации ФНО-α в пуповинной крови может служить ранним диагностическим признаком гипоксических изменений в организме новорожденного, что свидетельствует о его участии в патогенезе транзиторных нарушений в раннем периоде адаптации [15].
Выявленные различия показателей врождённого иммунитета в виде дисбаланса в системе провоспалительных цитокинов у детей, рожденных с высоким инфекционным риском, вероятно, имеет важное патогенетическое значение при развитии различных инфекционных заболеваний и определяет особенности развития адаптивного иммунитета. Изменения в гуморальном звене характеризовались достоверно низким уровнем антител IgG к S. рneumoniae и H. influenzae типа b у детей 1-й группы по сравнению с детьми 2-й группы. По-видимому, высокие показатели провоспалительных цитокинов при низком содержании противопневмококковых и противогемофильных антител позволяют сделать предположение о готовности детского организма к развитию воспалительных реакций при антигеном воздействии. Данный признак можно рассматривать как ранний маркер риска развития пневмококковой и гемофильной инфекции у детей с высоким инфекционным риском, что еще раз подтверждает необходимость проведения их ранней вакцинации против этих инфекций.
Выводы
- Под воздействием вакцин ППВ23 и Акт-Хиб на МНК пуповинной крови различий по уровню экспрессии TLR2 и TLR4 не выявлено. Функциональная активность МНК, оцениваемая по синтезу провоспалительных цитокинов, была выше у детей 1-й группы.
- Низкий уровень противопневмококковых и противогемофильных антител в сочетании с высокой активностью провоспалительных цитокинов может рассматриваться как фактор риска развития пневмококковой и гемофильной инфекций у детей, рожденных с высоким инфекционным риском, что обосновывает необходимость проведения их ранней вакцинации.


