Энтеровирусы являются основной этиологической причиной серозного менингита (СМ) у детей и взрослых. В свою очередь, СМ – наиболее частая среди требующих госпитализации клиническая форма энтеровирусной инфекции (ЭВИ).
В настоящее время различают более 100 типов энтеровирусов человека (ЭВ) 4 видов – ЭВ А–D (http://www.picornaviridae.com). Большинство типов ЭВ обладает потенциальной способностью вызывать СМ. Однако наибольшее число случаев спорадической и групповой заболеваемости энтеровирусным менингитом, зарегистрированной в мире, связано с отдельными представителями ЭВ В: вирусы ЕСНО 30, ЕСНО 6, ЕСНО 9, Коксаки В5, Коксаки А9, ЕСНО 13, ЕСНО 11, ЕСНО 7 [1–8].
Наблюдение за СМ в Нижнем Новгороде проводится с 1960-х гг. Первоначально лабораторная диагностика ЭВИ у больных и идентификация ЭВ осуществлялись при помощи классических вирусологических и серологических методов с использованием клеточных культур. Начиная с 2007 г. наряду с традиционными методами для идентификации типа ЭВ используется частичное секвенирование генома, которое, помимо типирования труднокультивируемых вирусов, дает возможность определить генотип вируса и исследовать его филогению, повышая таким образом информативность мониторинга ЭВИ.
В материалах данной статьи представлены результаты пятилетнего мониторинга возбудителей энтеровирусного менингита с использованием молекулярно-генетических методов.
Материалы и методы
В нашем исследовании проводилось типирование ЭВ-положительных образцов биоматериала от больных СМ, госпитализированных в инфекционные стационары Нижнего Новгорода и Нижегородской области в 2007–2011 гг., и больных ОРВИ и ОКИ, госпитализированных в 2010–2011 гг.
Для выявления ЭВ использовали тест-системы «АмплиСенс® Enterovirus» с различным способом детекции продукта амплификации (Центральный НИИ эпидедмиологии Роспотребнадзора, Москва).
Определение типа ЭВ проводили методами частичного секвенирования области VP1 генома [9] и реакции нейтрализации в культурах ткани Hep-2 и RD.
Для филогенетического анализа использовали нуклеотидные последовательности ЭВ, представленные в базе данных GenBank под номерами: ЕСНО 6: AF 081322, AY302558, AY896761, EF397649, EF397658, EF397654, FN691461, FJ525901, GU142881, HM897661, HQ674737, HQ897661, JN203712; ECHO 9: AF524866, AM711020, AM711104, AY903640, EU590815, GU393577, JN203737; ECHO 30: AF081340, AF128081, AF128087, AM946183, AJ276815, EF397645, EF397655, EU280292, EU280300, EU280312, GU142905, HQ897647; Коксаки А9: D00627, DQ869798, DQ869837, DQ869846, и полученные в результате молекулярного мониторинга неполиомиелитных ЭВ на территории России в 2008–2011 гг. [2, 10, 11]. Выравнивание нуклеотидных последовательностей и филогенетический анализ осуществляли с использованием программного обеспечения MEGA 5.0 [12]. Филогенетические деревья были построены по алгоритму neighbor-joining с опциями maximum composite likelihood; проанализировано по 100 псевдорепликатов.
Данные заболеваемости энтеровирусным менингитом были предоставлены Управлением Роспотребнадзора в Нижегородской области. За период исследования в Нижегородской области был зарегистрирован 841 больной энтеровирусным менингитом.
Результаты и обсуждение
С использованием частичного секвенирования области VP1 генома были исследованы образцы от 226 больных СМ с положительным результатом ПЦР-исследования на ЭВ. Генотип ЭВ был установлен в 154 (68,14%) случаях.
С использованием молекулярного и вирусологического методов одновременно типировались ЭВ, выявленные у 178 больных СМ. С помощью реакции нейтрализации тип ЭВ был установлен в 40 (22,47%) случаях, генотипирование позволило идентифицировать тип ЭВ у 109 (61,24%) больных. С использованием обоих методов в данной выборке было типировано 130 (73,03%) ЭВ.
С целью сравнения спектра ЭВ, обнаруженных у больных с различными клиническими проявлениями энтеровирусной инфекции в 2010–2011 гг. был исследован материал от 346 больных с СМ (112 человек), ОРВИ (35 человек) и ОКИ (312 человек). Тип ЭВ установлен в 185 случаях. Идентифицированы ЭВ 28 типов видов А, В, С, D и риновирус В (рис. 1).
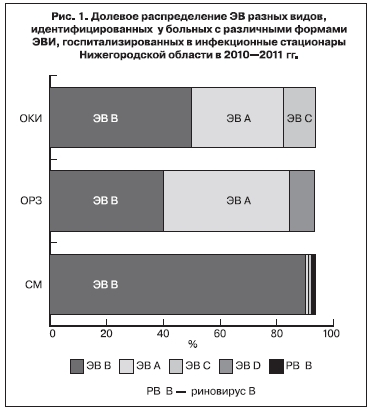
У 23 больных ОРВИ идентифицированы ЭВ 11 типов 3 видов: А (52,2 %), В ( 43,5%) и риновирус В (4,3%). ЭВ А: вирусы Коксаки А 2, 4, 5, 10; ЭВ В: вирусы Коксаки А9, ЕСНО 6, 8, 9, 17, 18; риновирус В: риновирус человека 35.
У 80 больных ОКИ идентифицированы ЭВ 23 типов 3 видов: А (32,5%), В (55,0%), С (12,50%). ЭВ А: вирусы Коксаки А 2, 4–6, 10, 16, ЭВ 76; ЭВ В: вирусы Коксаки А9, Коксаки В 1–5, ЕСНО 3, 6, 9, 18, 25, 30; ЭВ С: вирусы Коксаки А 1, 20, 22, ЭВ 116.
У 84 больных СМ в 2010–2011 гг. были идентифицированы ЭВ 15 типов 4 видов: А (1,2%), В (96,4%), С (1,2%), D (1,2%). ЭВ А: ЭВ 71; ЭВ В: вирусы Коксаки А9, Коксаки В 1, 3, 5, ЕСНО 2, 5, 6, 9, 11, 15, 18, 30; ЭВ С: ЭВ 116; ЭВ D: ЭВ 70.
Всего за период исследования у больных СМ было идентифицировано 316 ЭВ, принадлежащих 21 типу 4 видов: А (0,3%), В (98,4%), С(1%), D (0,3%). ЭВ А: ЭВ 71; ЭВ В: вирусы Коксаки А9, Коксаки В 1–3, 5, ЕСНО 2, 5, 6, 7, 9, 11, 13, 14, 15, 18, 19, 30; ЭВ С: вирус Коксаки А19, ЭВ 116; ЭВ D: ЭВ 70.
Относительная заболеваемость энтеровирусным менингитом на 100 тыс. населения в Нижегородской области в 2007 г. составляла 12,25, в 2008 г. – 3,55, в 2009 г. – 5,27, в 2010 г. – 1,9, в 2011 г. – 2,35. Ежегодно у больных СМ определялись ЭВ 3–10 типов, при этом наибольшую значимость в исследуемый период имели вирусы ЕСНО 30, ЕСНО 9, Коксаки А9 и ЕСНО 6 (рис. 2, см. на вклейке). В 2007 г. сезонный подъем заболеваемости СМ был обусловлен вирусами ЕСНО 7 и ЕСНО 30 при доминировании ЕСНО 30 [2]. Вирус ЕСНО 30 продолжал доминировать в 2008 г., в 2009 г. к нему присоединился вирус ЕСНО 9. В 2010 и 2011 гг. у больных энтеровирусным менингитом наиболее часто выявлялись вирусы Коксаки А9 и ЕСНО 6 соответственно.
Изучена генетическая гетерогенность и филогенетические взаимосвязи вирусов, определивших в исследуемый период заболеваемость СМ в Нижегородской области (рис. 3).
У исследованных нами вирусов ЕСНО 30 было идентифицировано 3 генотипа: А, Fc3, Fc4 по классификации J. Bailly [13] (рис. 3, А). Вирус ЕСНО 30, относящийся к генотипу Fc4, не только обусловил сезонный подъем заболеваемости СМ в Нижнем Новгороде в 2007 г., но и продолжал циркулировать в 2008–2009 гг. Этот вариант ЕСНО 30 имел близкое родство со штаммами, идентифицированными в те же годы в Европе и Австралии.
Нуклеотидные последовательности штаммов вируса ЕСНО 9 распределились по 3 филогенетическим группам (рис. 3, Б). Геновариант вируса ЕСНО 9, который вместе с вирусом ЕСНО 30 Fc4 обусловил подъем заболеваемости СМ в 2009 г. В Нижнем Новгороде, выявлялся в том же году в ряде других территорий России и значительно отличался от зарубежных штаммов ЕСНО 9 [10]. Этот вариант идентифицировался в Нижегородской области и в 2010 г. Другие варианты ЕСНО 9, выявленные в 2007 и 2010 гг., сформировали монофилетические группы с вирусами, циркулировавшими в последнее десятилетие в Европе и Индии соответственно.
Вирус Коксаки А9 был представлен двумя генотипами (рис. 3, В). Циркуляция вирусов одного генотипа, сформировавшими кластер с французским штаммом, наблюдалась только в 2007 г. Подавляющее большинство идентифицированных в Нижегородской области вирусов Коксаки А9 сформировали монофилетическую группу со штаммами, циркулировавшими в это же время в других регионах России [11], и значительно отличались (не менее 10% дивергенции) от наиболее близких зарубежных штаммов.
У вируса ЕСНО 6 дифференцировано 4 генетических варианта (рис. 3, Г), которые значительно отличались друг от друга – дивергенция нуклеотидных последовательностей составила не менее 10%.
Молекулярное типирование в последнее десятилетие находит широкое применение в лабораторных исследованиях при мониторинге ЭВИ. Эта методология применяется как для исследования нативных проб, так и для молекулярно-генетической характеристики ЭВ, пассированных в культуре ткани. Эффективность генотипирования ЭВ при тестировании нативного материала, достигнутая в нашей работе, согласуется с аналогичными показателями, полученными другими исследователями [9, 14, 15]. Как правило, положительный результат генотипирования определяется достаточной концентрацией вируса в исследуемой пробе и его сохранностью, которая в свою очередь может зависеть от условий хранения и транспортировки исследуемого образца. Как было показано за рубежом [14, 15] и в нашей работе, при параллельном исследовании молекулярный метод позволяет типировать бoльшую долю ЭВ, чем классическая реакция нейтрализации. Однако применение обоих методов может дать наиболее полную характеристику изучаемой выборки образцов.
Установлено, что пейзаж ЭВ, идентифицированных у больных СМ, отличался от пейзажа ЭВ, выявленных у больных с диагнозами ОРВИ и ОКИ. Подавляющую долю ЭВ, обнаруженных у больных СМ, составили вирусы вида ЭВ В, что характерно для европейских стран и США [4, 6–8]. В странах Юго-Восточной Азии у больных СМ при доминировании ЭВ В чаще, чем в других странах идентифицируют вирусы Коксаки А16 и энтеровирус 71, относящиеся к виду ЭВ А [5]. Спектр ЭВ В, выявленных у больных с различными диагнозами, несколько отличался. Отмечено, что вирусы, доминировавшие во время сезонного подъема заболеваемости СМ (Коксаки А9 и ЕСНО 9 – в 2010 г., ЕСНО 6 – в 2011 г.), выявлялись в соответствующие годы при всех формах ЭВИ.
Применение генотипирования позволило изучить генетическую гетерогенность ЭВ, определивших в исследуемый период заболеваемость СМ. Установлено, что в годы с относительно высокой заболеваемостью СМ в Нижегородской области доминировал вариант вируса ЕСНО 30 Fc4, который в те же годы циркулировал в мире. В отличие от этого вируса вариант вируса ЕСНО 9, обусловивший подъем заболеваемости СМ в 2009 г., имеет, по-видимому, российское происхождение, поскольку до сегодняшнего дня в международных базах данных отсутствуют последовательности близкородственных зарубежных штаммов. Следует отметить, что в прежние годы (2007–2008 гг.) этот вариант вируса ЕСНО 9 не идентифицировался. В отличие от него циркуляция геноварианта вируса Коксаки А9, доминировавшего в 2010 г., когда заболеваемость СМ была относительно низка, была отмечена на протяжении всех предыдущих лет. У всех представленных в данном исследовании вирусов было идентифицировано не менее двух генотипов. Вирус ЕСНО 6 характеризовался наибольшим генетическим разнообразием, и одновременной циркуляцией без явного доминирования вирусов разных генотипов, что было отмечено для этого ЭВ прежде [1, 16].
Таким образом, проведенные исследования подтверждают данные, указывающие на то, что молекулярная эпидемиология ЭВ, в том числе и наиболее значимых возбудителей СМ, различна [1].
В заключение следует отметить, что использование генотипирования при мониторинге ЭВИ в целом и энтеровирусного менингита в частности позволяет идентифицировать широкий вирусный спектр, определить не только тип выявленного вируса, но и его филогенетические связи, что в свою очередь может быть использовано при изучении особенностей молекулярной эпидемиологии вирусов и анализе эпидемических ситуаций.


