Хронические вирусные гепатиты – серьезная проблема здравоохранения вообще и педиатрии в частности. У детей доля гепатита С составляет 40,8%, еще у 5% хронический гепатит С (ХГС) протекает в сочетании с хроническим гепатитом В (ХГВ), у 1% – в сочетании с гепатитом G и около 1% больных ХГС имеют маркеры вирусов гепатита В и D [1].
Наибольшая частота обнаружения маркеров гепатитов В и С отмечена в ряде регионов России, одним из которых является Республика Саха (Якутия). По официальным данным, в Якутии 11,6% популяции и 4,5% коренного населения являлись позитивными по HBsAg и anti-HCV соответственно. При этом частота носительства HBsAg у беременных женщин почти в 2 раза превышала федеральный показатель (2 и 1,1% соответственно). В арктических улусах Республики Саха (Якутия) частота обнаружения HBsAg у детей от 0 до 14 лет составляет 4,2% (в центральной зоне РФ – 2,7%) [2–4].
На сегодняшний день основой противовирусной терапии хронических вирусных гепатитов являются препараты интерферона [5].
В Республике Саха (Якутия) в последние 3 года в рамках национального проекта «Здоровье» проводились закупки препаратов интерферона для лечения детей с хроническими вирусными гепатитами. Для педиатров главная проблема – это невозможность использования пролонгированных интерферонов, которые являются «золотым стандартом» в лечении хронических вирусных гепатитов у взрослых [5]. Поэтому мы применяли разные схемы лечения интерферонами короткого действия.
Целью данной работы являлась оценка эффективности применения различных схем лечения хронических вирусных гепатитов у детей.
Материалы и методы
Нами обследовано 29 детей, страдающих хроническими вирусными гепатитами, в возрасте от 3 до 16 лет. ХГВ был диагностирован у 10 детей, ХГС – у 13, хронический микстгепатит В+D (ХГВ+D) – у 5, хронический микстгепатит В+С – у 1 ребенка. Во всех группах преобладали мальчики, в группе больных ХГВ мальчики составили 60% (6 детей), в группе больных ХГС – 53,8% (7 детей), в группе больных ХГВ+D – 60% (3 детей). В возрастной группе от 3 до 6 лет было только 2 детей (7,5%), в группе от 7 до 10 лет – 9 детей (31%), от 11 до 14 лет – 11 детей (37,9%), старше 14 лет – 7 детей (24,1%). Все пациенты получали терапию ИНФ-α-2b (интрон А). Пациенты с ХГВ также получали препарат ламивудин (зефикс).
Диагноз всем больным был поставлен на основании результатов иммуноферментного анализа и полимеразной цепной реакции (ПЦР) (качественный и количественный анализ). Всем пациентам проводили исследования перед началом терапии и после ее окончания – определение антител к щитовидной железе, электроэнцефалограмма; гемограмма, общий анализ мочи, биохимическое исследование крови ежемесячно во время терапии; ПЦР (качественный и количественный анализ) через 1, 3, 6, 9 и 12 мес от начала терапии. После окончания лечения ежеквартально проводился ПЦР-контроль.
Эффективность противовирусной терапии оценивали на основании рекомендаций Американской ассоциации по изучению заболеваний печени. Терапию считали эффективной, если у пациента наблюдался стойкий вирусологический ответ, т.е. отсутствие генома вируса в крови в течение 6 или 12 мес после окончания лечения. Ранний вирусологический ответ оценивали через 3 мес лечения и использовали для предсказания стойкого вирусологического ответа. Предранний вирусологический ответ оценивали через 1 мес от начала терапии и также использовали для предсказания стойкого вирусологического ответа [6, 7].
Результаты и обсуждение
Всем больным ХГВ проводили комбинированную терапию по схеме: интрон А 3 млн 3 раза в неделю + зефикс 100 мг 1 раз в день. В дальнейшем в зависимости от полученных результатов изменяли дозу препарата, кратность введения.
В данной группе у 2 детей отмечался предранний и ранний вирусологический ответ, еще у 2 больных – ранний вирусологический ответ. Этим больным выбранная схема была оставлена без изменений.
Все эти больные изначально имели низкую вирусную нагрузку (< 600 000 МЕ/мл) и нормальные уровни АЛТ и АСТ. У 1 больного при проведении пункционной биопсии печени до начала лечения были выявлены умеренная степень активности процесса и умеренный фиброз. На фоне терапии у всех 4 пациентов отмечались побочные явления в виде лихорадочной реакции на инъекцию, мышечные боли, снижение аппетита и настроения. Снижение лейкоцитов и тромбоцитов относительно уровня до лечения отмечено у всех пациентов. Однако лейкопения и тромбоцитопения не достигали критического уровня.
В дальнейшем, после окончания противовирусной терапии, у 2 больных был отмечен стойкий вирусологический ответ до 12 мес. У 1 больного зафиксирован стойкий вирусологический ответ до 6 мес, но на 9-м месяце отмечен рецидив. У 1 больного рецидив был зафиксирован на 3-м месяце после окончания терапии.
В группе больных ХГВ (6 детей), не давших предранний или ранний вирусологический ответ, 5 (50%) имели низкую вирусную нагрузку (< 600000 МЕ/мл), у 1 больного вирусная нагрузка была высокой (> 600 000 МЕ/мл). У 5 пациентов зафиксированы нормальные уровни АЛТ и АСТ, только у одного ребенка отмечалось увеличение АЛТ в 1,7 раза, АСТ в 2,1 раза. У 3 больных перед началом противовирусной терапии была произведена пункционная биопсия печени. У 1 больного была выявлена низкая степень активности процесса со слабовыраженным фиброзом. У 2 детей были определены умеренная степень активности процесса и умеренный фиброз.
На стартовой терапии у этих детей выраженные побочные эффекты отсутствовали. В ответ на первую инъекцию лихорадочная реакция не превышала 38°С. В последующем повышения температуры тела не отмечалось у 4 из 6 пациентов. У 2 больных не было никаких жалоб.
Учитывая отсутствие эффекта от первоначальной терапии, в этой группе была изменена кратность введения препарата: интрон А 3 млн ежедневно + зефикс 100 мг 1 раз в день. Через 1 мес ДНК HBV не определялась у 2 больных (оба они имели изначально низкую вирусную нагрузку). Ранний вирусологический ответ был еще у 1 пациента. При увеличении кратности введения препарата у всех детей этой группы появились выраженные побочные эффекты, такие как высокая лихорадка, боли в мышцах, суставах, тошнота. Все дети жаловались на плохое самочувствие, выпадение волос. Лейкопения и тромбоцитопения у этих больных были умеренными.
Больные, давшие предранний или ранний вирусологический ответ, закончили полный курс терапии. В дальнейшем у 2 больных был отмечен стойкий вирусологический ответ до 12 мес. У 1 больного зафиксирован стойкий вирусологический ответ до 6 мес.
Среди 3 пациентов, не давших раннего вирусологического ответа, закончили терапию только двое. У обоих через 3 мес после окончания терапии наступил рецидив.
У 1 больного на 6-м месяце противовирусной терапии не отмечено снижения вирусной нагрузки на 2 log и более, поэтому лечение было прекращено.
В группе больных с ХГС (13 детей) все дети перед назначением противовирусной терапии имели низкую вирусную нагрузку (< 600 000 МЕ/мл) и нормальные уровни АЛТ и АСТ. На стартовой терапии – интрон А 3 млн 3 раза в неделю – у 4 (30,7%) детей отмечался предранний и ранний вирусологический ответ, у 5 (38,4%) детей – ранний вирусологический ответ. На фоне терапии у 5 (38,4%) пациентов отмечались побочные явления в виде лихорадочной реакции на инъекцию, мышечные боли, снижение аппетита и настроения. Снижение лейкоцитов и тромбоцитов относительно уровня до лечения отмечено у всех пациентов. Однако значимая лейкопения и тромбоцитопения была зафиксирована только у одной девочки. После консультации с гематологом и назначения курса метилурацила лечение было продолжено. У одного больного на фоне проводимой терапии были зафиксированы кратковременные судороги. После консультации невролога и назначения депокина было решено курс противовирусной терапии не прерывать, в дальнейшем эпизодов судорог не было.
Все эти больные закончили 48-недельный курс терапии, в катамнезе у 4 пациентов стойкая ремиссия до 6 мес, у 3 – до 12 мес, у 1 пациентки РНК HCV не определяется в течение 7 лет. У 1 пациентки через 3 мес после лечения был рецидив.
Четверо пациентов, у которых не было раннего вирусологического ответа, были переведены на ежедневное введение препарата интрон А в дозе 3 млн. У 3 пациентов на данной схеме лечения через 3 мес или не определялась РНК HCV, или было отмечено снижение вирусной нагрузки более чем на 2 log. У этих детей зафиксирован стойкий вирусологический ответ в течение 12 мес.
У 1 больного не получено ответа на индуцированную схему терапии и в течение всего времени наблюдения (3 года) постоянно определяется активная репликация вируса на фоне нормальных уровней АЛТ и АСТ. При проведении пункционной биопсии печени до начала лечения были выявлены умеренная степень активности процесса и умеренный фиброз.
Частота раннего или предраннего вирусологического ответа в зависимости от кратности введения препарата интрон А представлена на рис. 1.
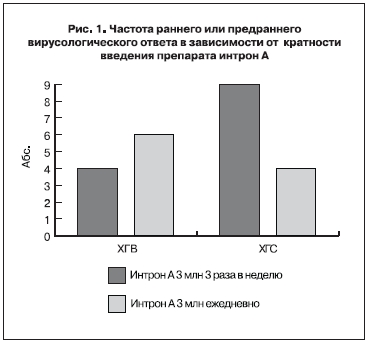
Частота стойкого вирусологического ответа в зависимости от кратности введения препарата интрон А представлена на рис. 2.
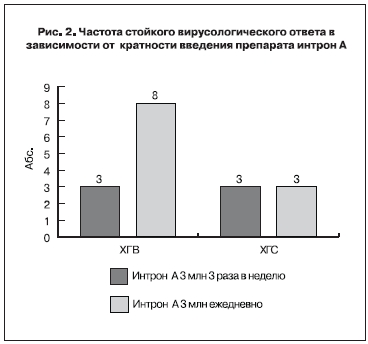
В группе микстгепатиов у всех детей во время наблюдения периодически отмечалось повышение уровней АЛТ (до 1,5 N) и АСТ (до 2,5 N). Пациентам с ХГВ+D (5 больных) изначально была назначена следующая схема терапии: интрон А 5 млн 3 раза в неделю + зефикс 100 мг 1 раз в день. На фоне терапии у всех пациентов отмечались умеренные побочные явления в виде лихорадочной реакции на инъекцию, снижение аппетита и настроения, лейкопения и тромбоцитопения. Раннего или предраннего вирусологического ответа ни у одного пациента не выявлено. На 6-м месяце терапии у 2 детей отмечалось снижение вирусной нагрузки на 2 log. У одного мальчика вирусная нагрузка осталась на прежнем уровне. Его перевели на ежедневное введение препарата интрон в дозе 5 млн. У 2 пациентов не отмечалось снижение вирусной нагрузки при лечении по индуцированной схеме и оно было прекращено.
После окончания полного курса терапии у 2 больных, получавших интрон 3 раза в неделю, развился рецидив на 3-м месяце после окончания лечения. У больного, получавшего лечение по индуцированной схеме, получен стойкий вирусологический ответ до 6-го месяца после окончания терапии.
Больной с ХГВ+С находился на диспансерном наблюдении в течение 9 лет, за это время он не предъявлял практически никаких жалоб, у него отсутствовали значимые изменения при биохимическом исследовании крови, но стабильно определялась активная репликация, причем чаще выявлялась ДНК HBV. У этого пациента были попытки противовирусной терапии препаратами реаферон и виферон, однако без эффекта. После назначения схемы лечения: интрон А 5 млн 3 раза в неделю + зефикс 100 мг 1 раз в день у него зафиксирован ранний вирусологический ответ и после окончания курса терапии – стойкий полный вирусологический ответ (отсутствие ДНК HBV и HBsAg) в течение 4 лет.
Выводы
1. Эффективность интерферонов короткого действия у детей при ХГС выше, чем при ХГВ.
2. Обнаружена прямая зависимость частоты предраннего и раннего вирусологического ответа при ХГВ от кратности введения препарата интерферона. Четкой зависимости стойкого вирусологического ответа от кратности введения препарата интерферона не выявлено.
3. Частота предраннего и раннего вирусологического ответа и стойкого вирусологического ответа при ХГС напрямую зависит от кратности введения препарата интерферона.
4. Эффективность интерферонов короткого действия у детей при микстгепатитах очень низкая.


