По данным ВОЗ, инфекции нижних дыхательных путей остаются самой смертоносной инфекционной болезнью [1]. В период эпидемиологического подъема гриппом заболевает до 15% населения планеты, смертность от гриппа составляет до 500 000 человек в год [2]. Заболеваемость ОРВИ и гриппом в Российской Федерации на февраль 2017 г. составила 4130,3 и 18,1 на 100 тыс. населения соответственно. В эпидемическом сезоне 2016–2017 гг. доминировал вирус H3N2, вторыми по распространенности оказались вирусы группы В. Пандемический вирус, который активно проявлялся в 2015–2016 гг., в нынешнем сезоне показал крайне низкую активность. Смертность от ОРЗ и гриппа за первое полугодие 2017 г. составила 299 случаев, от пневмоний – 13 515 случаев1, 2. По прогнозам ВОЗ, в сезон 2017–2018 гг. на территории России будут циркулировать 3 штамма: вирус гриппа группы В (Брисбен), вирус группы А Н2N3 (гонконгский) и подпип А/Н1N1 (Мичиган, или свиной)3.
Одной из главных особенностей течения вирусной пневмонии при гриппе А(H1N1) является быстрое развитие тяжелой дыхательной недостаточности и острого респираторного дистресс-синдрома (ОРДС), обусловливающих высокую летальность, в том числе у пациентов без выраженной сопутствующей патологии [3, 4]. В основе ОРДС лежит универсальный (неспецифический) ответ организма на патоген в виде перехода от повреждения альвеолярного эпителия к диффузному эндотелиальному повреждению посредством активной выработки хемокинов и цитокинов и активации клеток врожденного и адаптивного иммунитета [5, 6]. Возникающее на этом фоне повреждение эндотелия с увеличением проницаемости альвеокапиллярной мембраны влечет за собой развитие интерстициального отека легких, синдрома системного воспалительного ответа и полиорганной недостаточности [6]. В пользу неспецифичности ОРДС свидетельствует тот факт, что при тяжелом остром респираторном синдроме, вызванном коронавирусом, патоморфологическую картину аутопсийного материала сложно отличить от патоморфологичской картины других типов повреждений легких и ОРДС [7]. Таким образом, не вполне ясно, является ли деструктивное действие вируса постоянным, или вирус – всего лишь триггер, а основное повреждение наносится непосредственно иммунной системой хозяина [5]. Это значит, что при развитии ОРДС ключевую роль будет играть не столько элиминация вируса, сколько устранение «излишнего» воспалительного ответа.
Согласно рекомендациям Национального научного общества инфекционистов и Российского респираторного общества (2014–2017), при лечении тяжелых и осложненных форм гриппа целесообразно применять ингибиторы вирусной нейроминидазы – препарата из группы азолоазинов; комбинации противовирусных препаратов; нестероидные противовоспалительные средства; дезинтоксикационные, антигистаминные, отхаркивающие, противокашлевые и местные сосудосуживающие препараты, а в случае подозрения на вирусно-бактериальную пневмонию – антибактериальные препараты [8]. Стрессовые (или малые/средние) дозы системных глюкокортикостероидов (СК) могут быть эффективны у больных с рефрактерным септическим шоком и ранней фазой ОРДС (класс доказательности В). Положительная роль СК при тяжелых формах вирусной инфекции А/H1N1 без рефрактерного сепсиса/раннего ОРДС не подтверждена клиничесим опытом [9]. Стандарты Минздрава России разрешают применение системных кортикостероидов при гриппе тяжелой степени вне зависимости от осложнений, при тяжелом течении пневмонии (без указания на этиологический фактор) с явлениями дыхательной недостаточности4,5.
На сегодняшний день в мире не существует единого мнения об эффективности и безопасности СК при вирусных пневмониях и ОРДС. По данным литературы [3, 10], назначение СК больным с высокой лихорадкой в первые дни разгара заболевания не несет никакой пользы, а, напротив, снижает противовирусный эффект высокой лихорадки и ведет к развитию септических осложнений.
Результаты исследований по применению СК при гриппе показали, что такой вид патогенетической терапии ассоциируется с повышенной смертностью [10, 11]. При этом на сегодняшний день нет ни одного завершенного рандомизированного контролируемого исследования по данной проблеме.
В настоящее время топические кортикостероиды (ТК) с успехом применяются в пульмонологической практике для контроля над симптомами бронхиальной астмы и хронической обструктивной болезни лёгких, а также в ЛОР-практике в качестве как монотерапии (при легких формах острого риносинусита), так и адъювантного средства при системном лечении антибиотиками [12]. Преимуществом ТК является высокая концентрация непосредственно в легких, отсутствие биотрансформации (связывания с белками крови, модификации в печени и др.) до начала действия препаратов, снижение выраженности системного действия, побочных эффектов, уменьшение их общей дозы. Одним из главных преимуществ ТК, позволяющих использовать эти препараты при неотложных состояниях, является их быстрое действие (в течение 3–6 ч) [13].

Среди исследователей нет единого мнения о целесообразности применения глюкокортикостериодов при вирусных инфекциях. Их применяют в качестве «иммуномодуляторов» для коррекции «излишнего» воспалительного ответа, приводящего к усилению альтерации. С другой стороны, любой практикующий врач прекрасно понимает, что, назначая иммуносупрессивный препарат, рискует сместить шаткое равновесие воспалительного ответа в сторону активации инфекционного агента. В клинической практике мы иногда сталкиваемся с подобными назначениями, но не все они патофизиологически обоснованы. Зачастую врач руководствуется интуицией или внутренними установками лечебного учреждения, так как для пациентов с тяжелым течением вирусных инфекций и ОРДС с полиорганной недостаточностью актуальна своевременная усиленная противовоспалительная терапия.
Мы провели ретроспективный анализ клинических историй болезни для оценки эффективности применения СК и ТК, а также их комбинации в терапии ОРВИ (включая грипп) в период пандемии 2009 гг.
Были изучены истории болезни пациентов, госпитализированных в 11-е и 12-е инфекционные отделения Городской клинической больницы № 4 г. Москвы в период пандемии гриппа H1N1 в ноябре–декабре 2009 г. с направительным диагнозом ОРВИ/грипп. Никто из больных не был вакцинирован от гриппа, ПЦР-исследование также не проводили. Для оценки эффективности разных схем терапии из 225 историй болезни были отобраны 82 истории больных с клиническим диагнозом ОРВИ/грипп средней степени тяжести (с подробным описанием схем терапии и наблюдения динамики состояния в стационаре не менее 7 дней).
Среди больных было 38 женщин и 44 мужчины; средний возраст составил 44,4 ± 2 года; срок болезни на момент госпитализации – 5,63 ± 1,23 дня. В качестве фоновой и сопутствующей патологии встречались заболевания сердечно-сосудистой (у 17,1% больных), бронхо-легочной (у 13,4%), эндокринной (у 12,2%) системы, патология желудочно-кишечного тракта (у 6,1%) и мочевыводящей системы (у 3,7%), гинекологические заболевания (у 1,2%) и патология ЦНС (у 9,8%).
Среди осложнений гриппа пневмонии были выявлены у 56,1% больных (из них подтвержденные рентгенологически – в 82,6% случаев, с явлениями дыхательной недостаточности – в 27%), острые бронхиты – у 31,7%, бронхообструктивный синдром – у 6,1%, обострение хронической инфекции – у 2,4%, носовое кровотечение – у 1,2%, острый отит – у 3,7%, острый синусит – у 1,2%, острый ларингит – у 2,4%. Все больные получали противовирусную (арбидол, тамифлю) и патогенетическую (муколитики, отхаркивающие, антигистаминные препараты) терапию и ингаляции увлажненным кислородом. Больные с явлениями пневмонии и трахеобронхита получали также антибактериальные препараты (цефалоспорины III поколения, аминогликозиды, защищенные пенициллины, макролиды, фторхинолоны) и ингаляционно – β-адреномиметики (сальбутамол).
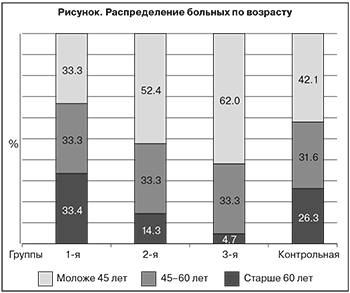 Для оценки эффективности проводимой терапии больные были разделены на 4 группы в зависимости от применения СК и/или ТК.
Для оценки эффективности проводимой терапии больные были разделены на 4 группы в зависимости от применения СК и/или ТК.
В 1-ю группа (n = 21) были включены больные, которые получали в качестве патогенетической терапии ингаляционные стероиды «off-label» (беклометазон 100 мкг х 2 раза в день). Средний возраст больных – 52,5 ± 3,9 года; мужчины составляли 23,8%, женщины – и 76,2%. Длительность заболевания на момент госпитализации составила 6,05 ± 0,7 дня. Среди осложнений гриппа встречались пневмонии (57,1%, из них подтвержденные рентгенологически – 83,3%, с явлениями дыхательной недостаточности – 33,3%), острые бронхиты (33,3%), бронхообструктивный синдром (9,5%).
Во 2-ю группу (n = 21) вошли больные, которым были назначены СК короткими курсами (преднизолон в курсовой дозе 90–280 мг). Средний возраст больных – 40,6 ± 4,0 года; мужчины составляли 71,4%, %, женщины – 28,6%. Длительность заболевания на момент госпитализации составила 5,71 ± 0,7 дня. Среди осложнений гриппа встречались: пневмонии (57,1%, из них подтвержденные рентгенологически – 66,5%, с явлениями дыхательной недостаточности – 66,77%), острые бронхиты (33,5%), бронхообструктивный синдром (14,3%), обострение хронической герпесвирусной инфекции (4,8%), острый отит (3,7%).
В 3-ю группу (n = 21) были включены больные, получавшие комбинированную терапию и ТК (беклометазон 100 мкг х 2 раза в день) и СК (преднизолон в курсовой дозе 90–280 мг). Средний возраст больных – 39,7 ± 3,5 года; мужчины составляли 47,6%, женщины – 52,4%. Длительность заболевания на момент госпитализации составила 6,1 ± 0,6 дня. Среди осложнений гриппа встречались: пневмонии (61,7%, из них подтвержденные рентгенологически – 91,6%, с явлениями дыхательной недостаточности – 33,3%), острые бронхиты (28,6%), острый синусит (4,8%), острый отит (4,8%), острый ларингит (9,5%).
Четвертую (контрольную) группу (n = 19) составили больные со среднетяжелым течением гриппа/ОРВИ, получавшие стандартную терапию без кортикостероидов в любом виде. Среди них было 73,4% мужчин и 26,3% женщин. Средний возраст больных – 45,0 ± 4,7 года. Длительность заболевания на момент госпитализации составила 4,6 ± 0,6 дня. Среди осложнений гриппа встречались: пневмонии (47,4%, из них подтвержденные рентгенологически –100%, с явлениями дыхательной недостаточности – 33,3%), острые бронхиты (31,6%), бронхообструктивный синдром (5,3%), обострение хронической инфекции мочевыводящих путей (5,3%).
Распределение больных по возрасту представлено на рисунке.
Во всех группах у пациентов в общем анализе крови наблюдалась выраженная лимфопения (р < 0,05) и незначительное повышение количества сегментоядерных нейтрофильных гранулоцитов. Такая тенденция сохранялись и на момент выписки.
Сравнительная характеристика временных параметров в группах наблюдения представлена в таблице.
В группах пациентов, принимавших СК, длительность антибактериальной терапии была меньше. Противовирусная терапия была более продолжительной во всех группах по сравнению с контрольной. Лихорадочный период был короче в группах, где пациенты принимали СК. Сроки госпитализации в этих группах также были короче, особенно в 3-й группе (меньше на 3,76 сут). В 1-й группе были несколько длиннее сроки госпитализации. В контрольной группе число больных, нуждающихся в амбулаторном долечивании, было наименьшим и составило 26,3%, в то время как в 1-й, 2-й, и 3-й – соответственно 66,7, 76,2 и 71,5%.
Одной из главных особенностей данного анализа является тот факт, что распределение по группам происходило «по показаниям» на усмотрение клинициста в связи с чем в группы с применением топических и системных гормонов заведомо попали больные с более тяжелым течением ОРВИ и гриппа и более неблагоприятным преморбидным фоном. Вероятно, именно по этой причине число больных, нуждающихся в амбулаторном долечивании, в группах пациентов, получавших гормональную терапию, было значительно выше. Дискутабельными являются и точные показания для назначения кортикостериодной терапии. Вероятно, в данном случае одним из основных показаний к назначению СК явились признаки дыхательной недостаточности, а комбинации СК и ТК – наличие сопутствующих заболеваний как факторов неблагополучного течения гриппа. Тем не менее, несмотря на сложности при анализе данных, можно говорить о потенциальной возможности применения стероидов обоих классов в качестве патогенетической терапии вирусных пневмоний. Наше предположение подтверждают результаты ретроспективного исследованиея P. Myles и соавт. [14], которые оценили тяжесть течения вирусной инфекции H1N1 у больных бронхиальной астмой и без нее в период пандемии 2009–2010 гг. В исследование были включены 1520 больных с подтвержденным диагнозом гриппа H1N1. Оказалось, что среди больных бронхиальной астмой количество тяжелых осложнений было ниже (11,2% против 19,8%). В качестве возможных причин лучших исходов у астматиков автор отмечает применение в качестве базисной терапии для контроля над бронхиальной астмой ингаляционных кортикостероидов, хотя и не исключает таких факторов, как более ранние сроки госпитализации, бóльший охват вакцинацией пациентов этой группы, а также госпитализацию больных в стационар по сути в связи с вирус-индуцированным обострением бронхиальной астмы, а не в связи с тяжелым течением гриппа.
В основе противовоспалительного действия кортикостероидов лежит ряд геномных [15, 16] и негеномных механизмов [17, 18]. К «быстрым» (негеномным) эффектам стероидов относят вазоконтрикторный эффект и снижение бронхиального кровотока; стабилизацию лизосомальных мембран; ингибирование активации эндотелия, лейкоцитарно-эндотелиального взаимодействия, дегрануляции нейрофилов, фагоцитоза и продукцию супероксид анионов в макрофагах [19, 20]. В результате дальнейшего «подключения» геномных эффектов происходят подавление высвобождения таких вазодилататоров, как простациклин и оксид азота [21, 22], снижение экстравазации белка и плазмы [23. 24], снижение рекрутирования воспалительных клеток и их миграции из посткапиллярных венул в экстраваскулярный матрикс посредством снижения экспрессии молекул межклеточного взаимодействия [25], а также дальнейшее ингибирование синтеза провоспалительных цитокинов и индукция синтеза противовоспалительных цитокинов.
Заключение
Таким образом, кортикостероиды способны воздействовать на все клетки-участницы воспалительного процесса: ингибируют апоптоз эпителиальных клеток [24, 26], подавляют продукцию провоспалительных цитокинов эпителиальными клетками и нейтрофилами [27, 28], блокируют высвобождение реактивных форм кислорода из нейтрофилов и мононуклеаров, подавляют основные пути активации Т-клеток [29]. Дозирование кортикостероидов – актуальная и малоизученная проблема. На сегодняшний день проводится клиническое исследование возможности использования комбинации будесонид/формотерол для профилактики ОРДС LIPS-B (Lung Injury Prevention Study With Budesonide and Beta; доза будесонида – 1000 мкг в сутки). По результатам второй фазы этого исследования применение комбинации СК и ТК у больных пневмониями приводило к повышению сатурации кислорода, снижало вероятность развития ОРДС, длительность пребывания в отделениях реанимации и интенсивной терапии и сроки госпитализации [30]. Полученные результаты согласуются с данными экспериментальных исследований [31–33], согласно которым ингаляции будесонида ослабляли воспаление, улучшали показатели оксигенации и вентиляции легких в разных моделях индукции.
Безусловно, эффективность применения кортикостероидов напрямую зависит от режима их дозирования. В приведенной выборке использовали низкие дозировки беклометазона, а дозировки преднизолона подбирали индивидуально для каждого больного. Тем не менее, можно предположить, что снижение продолжительности госпитализации в 3-й группе обусловлено синергичным взаимодействием СК и ТК и более длительным курсом противовирусной терапии. Вероятно, в данном случае топические стероиды дополнили действие системных, действуя непосредственно на основные мишени вирусной атаки – клетки эпителия, иммунокомпетентные клетки, эндотелий. Таким образом, имеющиеся на сегодняшний день данные указывают на то, что рациональное лечение (с включением различных форм кортикостероидов) больных с осложнениями ОРВИ и гриппа требует дальнейшего глубокого изучения для разработки четких показаний к использованию кортикостероидов и режимов их дозирования.


