Распространение хронического гепатита С (ХГС) в России возлагает на общество существенное бремя, обусловленное не только расходами на предоставление медицинской помощи больным, но и значительными производственными потерями, связанными с повышенной заболеваемостью и смертностью инфицированных этим вирусом.
В Российской Федерации уровень охвата противовирусной терапией (ПВТ) больных ХГС по сравнению с другими развитыми странами достаточно низок [1]. При этом сложившаяся практика медикаментозного лечения больных ХГС недостаточно эффективна, а применение препаратов нового поколения, обладающих значительно более высокой клинической результативностью, ограничено.
В этой связи разработка подходов, позволяющих объективно и комплексно оценить преимущества включения инновационных лекарственных препаратов в терапию ХГС, представляется крайне актуальной задачей. Полученные данные могут помочь аргументированно выбирать оптимальную тактику лекарственного обеспечения пациентов с этим тяжелым заболеванием.
Целью настоящей работы явилось изучение с помощью математической модели роли ПВТ ХГС, включающей инновационные препараты прямого противовирусного действия, в борьбе с продолжающимся распространением этого заболевания в России. Для достижения этой цели решались следующие задачи:
- проведение прогностической оценки эпидемиологического бремени ХГС на период 2016–2030 гг. при разных сценариях проведения ПВТ;
- прогноз возможного социально-экономического эффекта, выражаемого в монетарных терминах, при реализации различных сценариев проведения ПВТ.
Материалы и методы
Эпидемиологическое бремя оценивали с помощью показателей заболеваемости и смертности. Для прогнозирования бремени была разработана математическая имитационная модель, позволяющая оценивать заболеваемость и смертность при разных вариантах проведения ПВТ. Заболеваемость определялась как кумулятивное число больных ХГС с разными стадиями фиброза печени. Смертность определялась как число смертей в когорте инфицированных, отражающих смерти не только от ГС и его исходов, но и от повышенной в этой категории больных (по сравнению с общим населением) заболеваемости сердечно-сосудистыми заболеваниями, сахарным диабетом, болезнью почек и др. Временной период оценки включал интервал с 2016 по 2030 г.
В модели рассматривалась складывающаяся в каждый год когорта больных ХГС по стадиям фиброза печени (стадиям болезни) и генотипам вируса ГС (НСV). Величина когорты, равная кумулятивному числу больных в конкретном году, изменялась, увеличиваясь на число вновь заболевших в рассматриваемом году и снижаясь на число умерших и вылечившихся в предыдущем году. Также предусмотрено ежегодно происходящее изменение числа пациентов по стадиям болезни, которое рассчитывали, исходя из опубликованных в зарубежных исследованиях коэффициентов годовой вероятности перехода больных из одной стадии заболевания в другую [2–4].
Моделью было предусмотрено, что в самом общем виде изменение каждой из рассматриваемых групп (по стадиям и по генотипам) когорты больных ХГС происходило по следующей формуле:

В целях упрощения модели ХГС рассматривали только для двух групп генотипов: отдельно для генотипа 1 (в силу сложности его лечения, а также большой распространенности) и для остальных генотипов в совокупности (с учетом того факта, что генотипы 4–6 практически не встречаются в Российской Федерации [5]). Распределение больных ХГС по группам осуществляли, исходя из предположения об одинаковом распределении по этим критериям новых случаев заболевания и когорты больных в базовом году.
Расчеты распределения больных по генотипам и стадиям болезни осуществляли, исходя из следующих данных:
- доля больных с НСV генотипа 1 составляет 53% [6];
- распределение по стадиям развития фиброза при ХГС соответствовало следующим показателям: F0 – 39%, F1 – 25%, F2 – 16%, F3 – 9%, F4 – 11% [7]. В связи с отсутствием данных о структуре больных в разрезе последующих стадий в модели удельный вес больных со стадией F4 (11%) распределялся по экспертной оценке следующим образом: на долю компенсированного цирроза приходилось 6%, декомпенсированного цирроза – 3,5%, гепатокарциномы – 1,5%.
Число новых случаев определяли, исходя из сложившейся за предыдущие годы тенденции роста заболеваемости ХГС [8] и прогноза численности населения.
В данном исследовании эпидемиологическое бремя распространения ХГС в России определяли в соответствии с несколькими сценариями проведения ПВТ. В рамках разработанной имитационной математической модели использовали следующие сценарии, предусматривающие изменение двух основных параметров прогнозирования – уровня клинической результативности медикаментозного лечения и уровня охвата терапией больных ХГС.
Сценарий 1 – базовый – сохранение сложившейся практики проведения ПВТ (поддержание на протяжении всего периода уровня результативности лечения и уровня охвата).
Сценарий 2 – введение новой схемы лечения, включающей инновационные препараты с повышенным уровнем результативности, при сохранении уровня охвата ПВТ.
Сценарий 3 – введение новой схемы лечения, включающей инновационные препараты с повышенным уровнем результативности, при повышении уровня охвата ПВТ до показателя, рекомендуемого ВОЗ для стран с ограниченными возможностями лечения – 3,8% [9].
Сценарий 4 – введение новой схемы лечения, включающей инновационные препараты с повышенным уровнем результативности, при повышении уровня охвата ПВТ до уровня, рекомендуемого Европейской ассоциацией по изучению печени (European Association for the Study of the Liver – EASL) – 48,6% [9].
Сценарий 1 рассчитывали, исходя из следующих данных и предположений:
- уровень охвата ПВТ больных ХГС – 2,4% [7];
- распределение лиц, получивших ПВТ, по генотипам HCV осуществляли, исходя из предположения, что на долю генотипа 1 приходилось 53% зарегистрированных больных [6].
- клиническая результативность применяемых схем ПВТ была принята в соответствии с имеющимися данными и составляла 69% при лечении ХГС, вызванного HCV генотипа 1, и 81% – при остальных генотипах [10].
Сценарий 2 предусматривал на протяжении всего прогнозируемого периода сохранение уровня охвата ПВТ на сложившемся в РФ уровне (2,4%) и применение инновационных препаратов, позволяющих повысить результативность лечения больных ХГС, вызванного HCV генотипа 1, с 69 [10] до 97%. При этом результативность лечения больных с остальными генотипами HCV предполагалась неизменной
на уровне, принятом в соответствии с имеющимися данными (81%) [10].
Сценарии 3 и 4 предусматривали применение новой схемы лечения больных ХГС, вызванного HCV генотипа 1 (с уровнем клинической результативности 97%) и повышение уровня охвата ПВТ когорты больных ХГС до 3,8 и 48,6% соответственно. При этом результативность лечения больных с остальными генотипами HCV, как и в предыдущем сценарии, предполагалась неизменной на уровне, принятом в соответствии с имеющимися данными (81%).
Для оценки экономических преимуществ анализировали следующие данные:
- уровень потенциального сокращения эпидемиологического бремени в результате реализации разных сценариев проведения ПВТ;
- экономическое бремя ХГС [11];
- стоимость проведения ПВТ при разных схемах ее реализации.
Снижение эпидемиологического бремени в результате реализации разных сценариев проведения ПВТ, выражаемое в монетарных терминах, отражает экономические выгоды государства от терапии ХГС, осуществляемой с помощью инновационных препаратов. Экономическое бремя ХГС в России определялось для условий 2013 г. Для последующих лет экономическое бремя, исчисляемое на одного больного ХГС, определялось, исходя из индексов-дефляторов ВВП, предусмотренных в долгосрочном прогнозе Министерства экономического развития Российской Федерации [12]. Величина сокращения экономического бремени рассчитывалась, исходя из числа предотвращаемых случаев заболевания (сравнения рассматриваемых сценариев с базовым сценарием сложившейся практики проведения ПВТ) и величины экономического бремени на одного больного за соответствующие годы.
Результаты и обсуждение
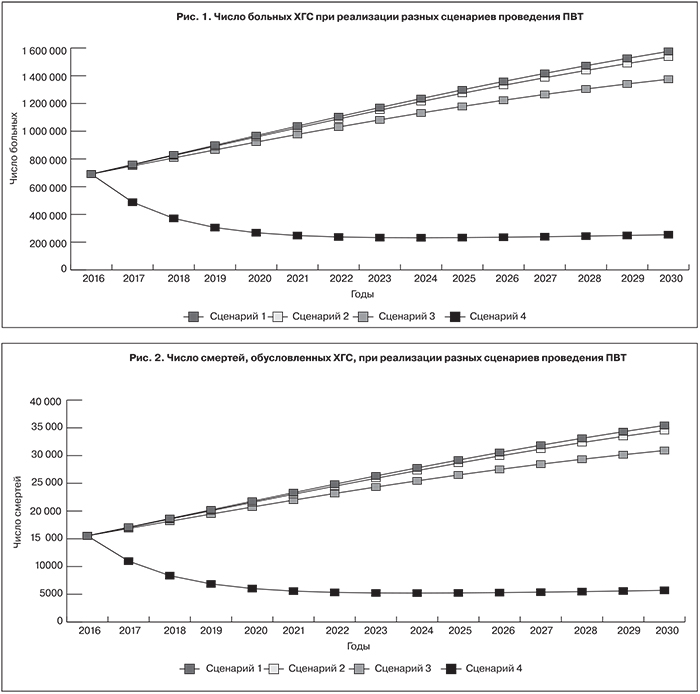
Как показали расчеты, сравнение сценария 1 (базового) и сценария 2 свидетельствует о том, что количество больных ХГС может сократиться к 2030 г. лишь на 3%. Аналогичные, хотя и несколько более позитивные результаты могут быть получены при переходе к сценарию 3 (рис. 1). Таким образом, только увеличение клинической результативности лекарственных препаратов, применяемых для лечения, при сохранении низкого уровня охвата лечением больных не сможет существенно повлиять на сдерживание эпидемии.
В то же время значительное расширение уровня охвата больных ХГС в совокупности с повышением клинической результативности применяемых медикаментов позволит существенно снизить эпидемиологическое бремя ХГС в России. Так, по данным наших расчетов, повышение до рекомендуемого EASL уровня охвата лечением с помощью инновационных препаратов (сценарий 4) позволит сократить к 2030 г. число больных почти в 6 раз по сравнению с сохранением сложившейся практики ПВТ (сценарий 1) (см. рис. 1).
Сходные результаты были получены при оценке показателя смертности. Лишь значительное увеличение уровня охвата ПВТ больных ХГС совместно с повышением клинической результативности применяемых лекарственных препаратов позволит существенно сократить смертность, обусловленную развитием заболевания. По сравнению со сценарием 1, предусматривающим сохранение на протяжении всего прогнозируемого периода сложившейся практики лечения, кумулятивное число смертей за весь период может быть сокращено на 2 и 9% соответственно при сценариях 2 и 3, в то время как при реализации сценария 4 показатель смертности может сократиться почти в 4 раза (рис. 2).
Расчеты, проведенные в рамках разработанной модели, свидетельствуют, что внедрение новой схемы лечения с применением инновационных препаратов, обладающих повышенной клинической результативностью, при невысоком (не выше 2,4%) уровне охвата больных ПВТ позволит предотвратить немногим более 360 000 случаев заболевания и 8000 смертей, обусловленных развитием ХГС в период с 2016 по 2030 г. (рис. 3, 4). Повышение уровня охвата ПВТ больных ХГС до рекомендуемого ВОЗ уровня (для стран с ограниченными ресурсами) за рассматриваемый период позволит сократить совокупную распространенность на 1,4 млн случаев заболевания и смертность – на 31 000 случаев. Многократное повышение уровня охвата (до рекомендуемого EASL уровня) позволит за тот же период сократить кумулятивное число больных ХГС на 12 млн человек и смертность – на 270 000 случаев.
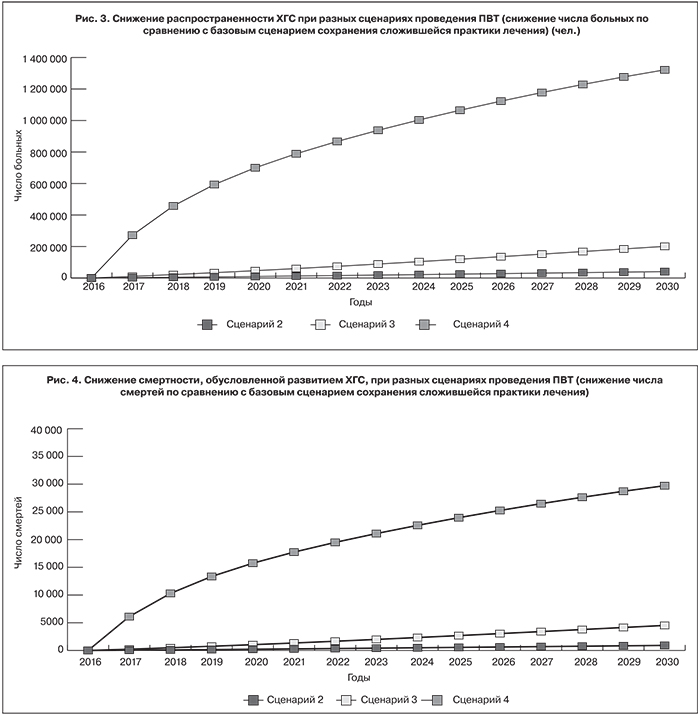
Как отмечалось выше, величина сокращения экономического бремени рассчитывалась, исходя из числа предотвращаемых случаев заболевания (сравнение рассматриваемых сценариев с базовым сценарием сохранения сложившейся практики проведения ПВТ) и величины экономического бремени на одного больного за соответствующие годы. Расчет кумулятивного за период 2016–2030 гг. сокращения экономического бремени в текущих ценах 2016 г. приведен в таблице.
Как показывают расчеты, величина сокращения экономического бремени, полученная только за счет повышения клинической результативности применяемых новых противовирусных препаратов, составит 38,1 млрд руб. (сопоставление сценариев 1 и 2). Повышение же уровня охвата до рекомендуемого EASL в сочетании с применением инновационных препаратов для лечения больных ХГС за период 2016–2030 гг. позволит сократить общие экономические потери общества от этого заболевания на 1,2 трлн руб. (сравнение сценариев 1 и 4).
Для оценки объема вложений в ПВТ использовали данные о зарегистрированных в настоящее время предельных ценах на некоторые современные препараты для лечения больных ХГС с учетом суммарной стоимости всего курса ПВТ для больных ХГС, вызванного НСV генотипа 1, и стоимость курса лечения больных, имеющих НСV других генотипов. Оценивались расходы на лечение в соответствии со сложившейся практикой и при применении некоторых новых инновационных препаратов для лечения больных ХГС, вызванного НСV генотипа 1. В качестве расчетной была использована усредненная цена курса лечения инновационными препаратами, составляющая 810 000 руб. (в ценах 2015 г.). Такая усредненная стоимость лечения была ниже сложившегося уровня цен при существующей практике ПВТ. При этом в модели было сделано предположение, что в течение всего прогнозного периода до 2030 г. резкого изменения (повышения или снижения) цены на препарат не будет, что, как представляется, сделало оценку несколько консервативной, однако позволило использовать только индекс-дефлятор ВВП [12] для определения прогнозных цен на курсы лечения на последующий период. Объем вложений в ПВТ при разных сценариях проведения этой терапии рассчитывался как произведение средней стоимости курса лечения больных ХГС, вызванным НСV разных генотипов, на количество пациентов, ее получающих.
В целях корректного вывода об экономической целесообразности внедрения новых схем ПВТ в рамках проводимого исследования осуществлялось попарное сравнение сценариев. В каждой из пар предусматривался определенный установленный целевой показатель уровня охвата ПВТ (3,8 и 48,6%) и разная применяемая медикаментозная схема лечения (сложившаяся практика и применение инновационных препаратов).
Результаты такого сравнения позволили сделать следующие выводы.
В случае установления государством целевого показателя охвата ПВТ больных ХГС на уровне, рекомендованном ВОЗ для стран с ограниченными возможностями для лечения этого заболевания (3,8%), применение инновационных препаратов позволит предоставлять лечение дополнительно 7600 больным за счет получаемого в результате введения новой схемы лечения социально-экономического эффекта. Этот эффект выражается в сокращении экономического бремени и меньшем объеме средств, необходимых на закупку препаратов для прежнего числа больных. Социально-экономический эффект от введения схемы лечения, включающей инновационные препараты, выражаемый в монетарных терминах, сокращает кумулятивный экономический ущерб общества на 8,2%.
В случае доведения целевого показателя до уровня, рекомендованного для европейского региона (48,6%), применение инновационной ПВТ позволит в обозримой перспективе довести число пациентов, дополнительно получающих лечение за счет реализации социально-экономического эффекта, как минимум до 31 000. При таком повышении степени охвата кумулятивный социально-экономический эффект превысил бы кумулятивный ущерб от этого заболевания на 10%.
Другими словами, эффект от снижения экономического бремени и возникающей экономии средств при закупке инновационных препаратов для проведения ПВТ по новой схеме настолько значим, что позволяет не только пролечить дополнительно значительное число пациентов, но даже при расширении охвата терапией будет компенсировать те потери, которые будет нести государство при сохранении прежней схемы лечения ХГС.
Таким образом, целесообразность внедрения новой схемы лечения инновационными препаратами представляется очевидной как с точки зрения затрат бюджетов разного уровня, так и с точки зрения общественных и гуманитарных задач.
Проведенные по разработанной математической имитационной модели расчеты оценки эпидемиологического бремени ХГС свидетельствуют о том, что для существенного снижения размаха эпидемии, связанной с HCV-инфекцией, недостаточно только включения новых инновационных препаратов в ПВТ этого заболевания и, соответственно, повышения уровня клинической результативности лечения.
Чтобы значительно сократить распространение ХГС, в России необходимо, помимо повышения клинической результативности лечения, значительно увеличить уровень охвата ПВТ больных ХГС. Конечно, существенное повышение уровня охвата противовирусным лечением инфицированных лиц потребует значительных первоначальных вложений в закупку инновационных лекарственных препаратов. Однако даже в этих условиях такое решение будет экономически обоснованным в случае закупки препаратов, обладающих высокой клинической результативностью, при условии, что цены закупки не будут превышать цен на используемые в настоящее время препараты. Значительное увеличение охвата терапией в этом случае позволит повысить социально-экономический эффект, отражающий сокращение экономических потерь общества от распространения этого заболевания и относительное снижение затрат на закупку препаратов для ПВТ. По мере снижения цен на инновационные препараты этот социально-экономический эффект будет возрастать. В связи с этим представляется, что создание условий, позволяющих снизить цену на инновационные препараты, может рассматриваться как важнейшая задача органов власти разного уровня, которая имеет не только экономическую, но и гуманитарную составляющую. Такой подход будет не только соответствовать объявленному Правительством РФ курсу на инновационное развитие и повышение эффективности бюджетных затрат, но и позволит в короткий срок улучшить состояние здоровья многих больных ХГС в России.


