Повышение уровня трансаминаз – одно из наиболее распространенных нежелательных явлений при лечении ВИЧ-инфицированных пациентов. Эти нарушения могут быть вызваны, с одной стороны, антиретровирусными препаратами (АРВ-препаратами), с другой – влиянием вирусов гепатитов В (ВГВ) и С (ВГС), воздействием токсических субстанций (алкоголя, психоактивных веществ и т. д.), использованием лекарственных препаратов для лечения вторичных и сопутствующих заболеваний, развитием стеатогепатита, связанного с метаболическим синдромом (гиперлипидемией, диабетом, ожирением) [1]. Диагностика гепатотоксичности АРВ-препаратов представляет некоторые сложности. Во-первых, нет четких критериев для постановки диагноза. Во-вторых, пациенты часто принимают несколько препаратов, обладающих гепатотоксическим потенциалом. Наконец, гистологические проявления гепатотоксичности чрезвычайно разнообразны, поэтому биопсия печени имеет ограниченное применение в диагностике. Тем не менее иногда она бывает полезна для исключения других причин повышения уровня ферментов печени [2]. У большинства (70–85%) больных ВИЧ-инфекцией гепатотоксичность не сопровождается клинически выраженными симптомами, а уровень трансаминаз часто возвращается к норме на фоне продолжения приема препарата, вызвавшего это повышение [3]. Однако присоединение таких симптомов, как слабость, тошнота, рвота, желтуха может говорить о более выраженном поражении печени, которое в некоторых случаях может привести к летальному исходу.
Множество рандомизированных контролируемых исследований посвящено изучению связи между развитием гепатотоксичности и АРВ-препаратами [4–7]. Сложность в интерпретации результатов этих исследований заключается в том, что пациенты из групп сравнения неоднородны по своим параметрам (возрасту, полу, алкогольному профилю, исходному количеству CD4+-лимфоцитов, вирусной нагрузке, начальному уровню трансаминаз). Кроме того, в одних исследованиях под гепатотоксичностью понимают повышение уровня ферментов печени, в то время как в других учитываются только клинические проявления (такие как клинически выраженный гепатит) [8]. В настоящее время опираются на критерии, принятые международной клинической исследовательской группой по СПИДу (AIDS Clinical Trials Group), которые основаны на степени повышения уровня трансаминаз [9], а также на клинические симптомы острого гепатита, реакций гиперчувствительности и лактоацидоза.
Существует целый ряд факторов, повышающих риск возникновения гепатотоксичности. К общим факторам риска относят возраст старше 60 лет, повышенный индекс массы тела, наличие тромбоцитопении или инфекции, сочетанной с гепатитами В или С, исходно повышенный уровень АЛТ, а также употребление алкоголя и/или других гепатотоксичных субстанций [4, 7, 10–12].
Разные классы АРВ-препаратов вызывают гепатотоксические реакции с разной частотой и в разные сроки, что зависит от механизма повреждений. Результаты исследований, оценивавшие риск токсичности для печени при использовании конкретных АРВ-препаратов или их классов, противоречивы. Несбалансированные и часто недостаточные выборки в этих исследованиях не позволяют точно определить роль каждого конкретного препарата в развитии печеночной токсичности. Кроме того, использование сочетаний нескольких АРВ-препаратов затрудняет сравнительный анализ. Однако большинство исследователей склоняется к мнению о меньшей (6–10%) гепатотоксичности ингибиторов протеазы ВИЧ (ИП) [13]. Препараты новых классов и следующая генерация препаратов уже существующих классов антиретровирусной терапии (АРТ) – ралтегравир, этравирин, рилпивирин – обладают меньшим токсическим эффектом.
Материалы и методы
Был проведен анализ частоты развития гепатотоксичности в первые 48 недель АРТ у 720 взрослых пациентов с ВИЧ-инфекцией. В составе схемы АРТ 371 больной получал ИП (123 человека – LPV/r, 124 человека – ATV/r или ATV, 38 человек – DRV/r, 25 человек – SQV/r, 61 человек – NFV), а 349 пациентов – ненуклеозидные ингибиторы обратной транскриптазы ВИЧ (ННИОТ): 269 человек – EFV, 80 человек – NVP. В качестве нуклеозидной основы у всех пациентов в состав схемы АРТ включали 2 нуклеозидных ингибитора обратной транскриптазы ВИЧ (НИОТ). Лечение больным было назначено в соответствии с российскими рекомендациями по началу АРТ. Пациентов наблюдали в Федеральном научно-методическом центре по профилактике и борьбе со СПИДом и 17 территориальных центрах по профилактике и борьбе со СПИДом и инфекционными заболеваниями (Республики Башкортостан, Алтайского, Красноярского, Краснодарского и Пермского краев, Волгоградской, Иркутской, Калининградской, Кемеровской, Ленинградской, Нижегородской, Ростовской, Саратовской, Свердловской, Ульяновской и Челябинской областей, г. Тольятти).
До начала лечения всех больных тестировали на наличие ВГВ/ВГС, а также определяли уровень РНК ВИЧ и количество CD4+-лимфоцитов. Применяли общеклинические методы исследования (осмотр пациента, сбор анамнеза, анализ периферической крови и биохимический анализ крови). Развитие гепатотоксичности оценивали на основании клинической симптоматики, а также динамики уровней АЛТ/АСТ, измеренных до начала лечения, через 1, 3, 6 и 12 месяцев терапии. Степень изменения уровня трансаминаз оценивали по международной шкале нежелательных явлений: 1-я степень – повышение уровня активности фермента от 1,25 до 2,5 значения верхней границы нормы (ВГН), 2-я – от 2,6 до 5 ВГН, 3-я – от 5 до 10 ВГН, а 4-я – более 10 ВГН. Под выраженной гепатотоксичностью подразумевали появление клинических симптомов гепатита и/или повышение уровня трансаминаз 3-й и более степени токсичности. Статистическую обработку полученных данных осуществляли при помощи программ Microsoft Office Excel для Windows XP Professional, версия 2010 г. Определяли среднее значение, стандартное отклонение, медиану. Для оценки различий значений в процессе лечения применяли программу Biostat, использовали критерий Стьюдента и парный критерий Стьюдента с достоверностью 95% (p < 0,05).
Исходные характеристики пациентов в группах были сопоставимы между собой. Соотношение мужчин и женщин на всех схемах лечения было примерно одинаково – 60–70% больных составили мужчины. Гепатит В и/или С был диагностирован у 55–75% больных, количество CD4+-лимфоцитов колебалось от 213 до 357 клеток/мкл (по медиане) в разных группах. Медиана уровня РНК ВИЧ достоверно не отличалась в исследуемых группах и составляла 4,61–5,14 log10. Повышение уровня АЛТ всех степеней до начала АРТ было зафиксировано у 22,3–32% больных, АСТ – у 10–28% (3–4-я степень этого нежелательного явления составила 0,8–4%) в разных группах. Медиана уровней АЛТ и АСТ не превышала нормальных значений и составила 24–39 и 23–38 МЕ/л соответственно.
Результаты и обсуждение
Наиболее часто повышение уровня ферментов печени наблюдали через 3–6 месяцев лечения, независимо от схем терапии. Так, до начала АРТ повышение уровня трансаминаз регистрировали у 21,3 и 25% больных (для АЛТ и АСТ соответственно), через 1 месяц терапии – у 31,9 и 23,9%, через 3 месяца – у 42,2 и 37,7%, через 6 месяцев – у 43,9 и 32,3%, через 12 месяцев – у 29 и 20,5%. При этом частота развития гепатотоксичности 3-й степени (по значениям АЛТ) возрастала пропорционально времени приема АРВ-препаратов в течение первых 24 недель лечения. Если до начала терапии этот показатель составлял 1,3%, то через 1 месяц он уже был равен 3%, через 3 месяца – 5,4% (p < 0,05 со значением до лечения), через 6 месяцев – 5,4% (p < 0,05 со значением до лечения), через 12 месяцев он вновь снизился до 2,7%. Тенденцию к учащению повышения уровня АСТ более чем в 5 раз от ВГН при увеличении длительности приема препаратов также наблюдали, но в меньшей степени. В процессе исследования ни разу не отмечали клинических симптомов гепатита или повышения уровня трансаминаз 4-й степени.
Назначение препаратов из группы ИП практически не повлияло на частоту повышения уровня трансаминаз в процессе исследования, и к 48-й неделе лечения уровень АЛТ превышал нормальные значения только у 23% пациентов, что было даже меньше, чем до начала лечения (27,2%). В то же время применение препаратов из группы ННИОТ привело к развитию гепатотоксичности более чем у половины (57,1%) пациентов к 24 неделям терапии (p < 0,001 в сравнении с ИП). Через год АРТ повышенный уровень АЛТ продолжал регистрироваться у 33,8%, что на 11,2% больше исходного значения. Выраженную гепатотоксичность (3–4-й степени) мы регистрировали до начала лечения, на 4, 12, 24 и 48 неделях терапии у 2,4, 1,9, 1,7, 2,2 и 1% пациентов, принимавших ИП, и у 0, 4,7, 8,5, 8 и 4,2% пациентов, получавших ННИОТ соответственно.
Было проведено сравнение частоты повышения уровня трансаминаз при использовании разных АРВ-препаратов. Применение ATV, DRV/r и NFV в течение 48 недель незначительно повлияло на долю больных с повышенными значениями АЛТ (прирост на 4–6% наблюдали только на 4-й неделе лечения). Использование LPV/r и SQV/r ассоциировалось с повышением уровня ферментов печени у 40–50% больных к 24-й неделе АРТ, однако 3-ю степень гепатотоксичности наблюдали только у 2–3% пациентов, принимавших LPV/r, и у 8–12% пациентов, принимавших SQV/r (p < 0,05 по сравнению с другими ИП). Через 12 месяцев терапии ни в одной группе пациентов, принимавших ИП, не было отмечено повышения частоты гепатотоксичности по сравнению с данными до начала лечения. Подавляющее большинство (92%) больных, у которых продолжали регистрировать повышение уровня трансаминаз, имели одновременно протекающие хронические вирусные гепатиты (ХВГ) и/или повышенные значения АЛТ/АСТ до начала АРТ. У части больных, которым были назначены ATV, DRV/r или NFV, произошла нормализация уровней АЛТ и АСТ к 48 неделям лечения.
Таким образом, все исследуемые препараты из группы ИП, за исключением SQV/r, были достаточно безопасными для больных ВИЧ-инфекцией.
При использовании ННИОТ гепатотоксичность наблюдали уже начиная с 4-й недели терапии. Повышение уровня ферментов печени 1–2-й степени при приеме EFV регистрировали в 39,1, 49,6 и 58,1% случаев во время визитов в 4, 12 и 24 недели соответственно. Гепатотоксичность 3-й степени при этом имела место у 1,8, 8,9 и 6,1% больных. Применение NVP было ассоциировано с меньшей частотой, но большей выраженностью гепатотоксичности, что потребовало замены препарата у 10% пациентов. Повышение уровня АЛТ 1–2-й степени зафиксировали у 35, 18,3 и 20,5% больных в течение первых 6 месяцев лечения, 3-й степени – у 10, 6,7 и 14,1% пациентов соответственно (p < 0,05 со значениями до лечения). Все пациенты, у которых была обнаружена гепатотоксичность, имели один или несколько факторов риска ее развития в анамнезе (ХВГ или исходно повышенные значения АЛТ).
К 48-й неделе АРТ доля больных с превышением уровня АЛТ до ВГН снизилась (как и в случае использования ИП в схеме АРТ) до 35,1 и 21,1% (для EFV и NVP соответственно), однако снижение до исходных значений произошло только в группе пациентов, принимавших NVP. У 9 (4,6%) больных, принимавших EFV, продолжали регистрировать выраженную гепатотоксичность.
Таким образом, риск развития выраженной гепатотоксичности был выше при использовании NVP, хотя общая частота повышения уровня трансаминаз была больше среди пациентов, применявших EFV.
Было проведено исследование влияния повышенных уровней АЛТ до начала лечения на развитие гепатотоксичности при использовании АРВ-препаратов классов ИП и ННИОТ. Из анализа были исключены 9 пациентов, имевших исходно повышение уровня трансаминаз 3-й степени. Группы пациентов, имевших нормальные значения АЛТ и получавших ИП или ННИОТ, включали по 270 человек. В группы больных с исходно повышенными значениями АЛТ 1–2-й степени вошли 92 человека, использовавших ИП в схемах АРТ, и 79 человек, использовавших ННИОТ. При этом 75–80% больных имели повышение уровня АЛТ 1-й степени. Группы были сопоставимы между собой. Среди пациентов, которым были назначены ИП и ННИОТ, доля больных хроническими гепатитами В и С составила 71 и 69,3% соответственно. Подавляющее большинство пациентов с исходно повышенным уровнем трансаминаз страдали сочетанной инфекцией с вирусными гепатитами, остальные злоупотребляли алкоголем.
Из всех пациентов с изначально нормальными значениями АЛТ только у 7,4% было обнаружено повышение этого показателя 1–2-й степени через 1 месяц лечения, у 21,4% – через 3 месяца, у 25,3% – через 6 месяцев и у 5,9% – через 12 месяцев терапии. Повышения уровня трансаминаз 3–4-й степени не регистрировали ни в одном случае.
Среди пациентов с изначально повышенным значением АЛТ (1–2-й степени) через 1 месяц АРТ повышенный уровень трансаминазы продолжали регистрировать у 86,2% больных, через 3 месяца – у 88%, через 6 месяцев – у 92,4%, через 12 месяцев – у 61,4%. При этом усиление гепатотоксичности до 3-й степени обнаруживали в 11,5, 18, 18,1 и 8,8% случаев через 1, 3, 6 и 12 месяцев соответственно (p < 0,001 с пациентами, не имевшими повышенного уровня АЛТ до лечения).
При разделении пациентов по схемам АРТ оказалось, что среди лиц с нормальным исходным уровнем АЛТ, получавших ИП, повышение уровня трансаминаз 1–2-й степени наблюдали в процессе лечения всего у 2,9–11,5% больных, тогда как при использовании ННИОТ их доля составила 9,5–40,8% (p < 0,05).
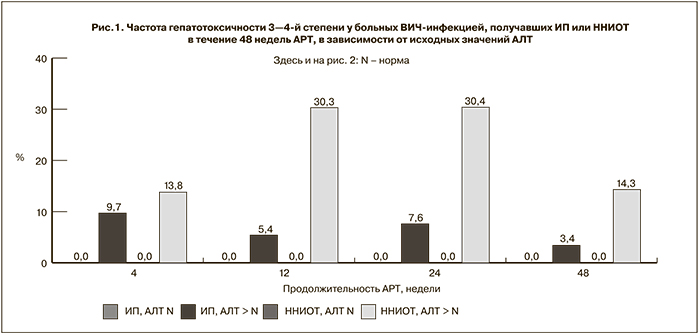
Существенные различия были получены и при сравнении больных с исходно повышенными значениями АЛТ в зависимости от препарата, используемого в схеме АРТ (рис. 1). Так, повышение уровня АЛТ до 3-й степени зафиксировали только у 3,4–9,7% пациентов, использовавших ИП в процессе терапии, в то время как у больных, принимавших ННИОТ, этот показатель составил 14,3–30,4% (p < 0,05). Нормализация показателей трансаминаз через 12 месяцев лечения произошла у 56,9% пациентов, получавших ИП, и лишь у 19,6% пациентов, получавших ННИОТ (p < 0,05).
При расчете шансов развития выраженной гепатотоксичности оказалось, что использование ИП в схеме терапии у пациентов с исходно повышенными значениями АЛТ увеличивает риск развития гепатотоксичности 3-й степени в 8,7 раз по сравнению с больными, имеющими нормальный уровень АЛТ (ОШ – 8,7; 95% ДИ – 6,5–10,9). Применение ННИОТ при тех же условиях увеличивает шансы в 65,7 раза (ОШ – 65,7; 95% ДИ – 63,7–67,7).
Таким образом, повышение уровня АЛТ перед началом АРТ является одним из наиболее неблагоприятных факторов развития гепатотоксичности в процессе лечения, особенно у больных, принимающих АРВ-препараты класса ННИОТ.
Был проведен анализ зависимости частоты развития гепатотоксичности от наличия ХВГ при использовании АРВ-препаратов классов ИП и ННИОТ. ХВГ страдали 257 пациентов, получавших ИП, и 242 пациента, получавших ННИОТ. Группы больных без ХВГ составили 105 и 108 больных соответственно.
В процессе терапии среди пациентов, не имевших ХВГ, гепатотоксичность 1–2-й степени развивалась редко: у 1,1–6,7% при применении ИП и у 6,1–18,5% при применении ННИОТ. Как правило, больные с повышением уровня АЛТ в этих группах злоупотребляли алкоголем. Гепатотоксичности 3–4-й степени не было зафиксировано ни в одном случае.
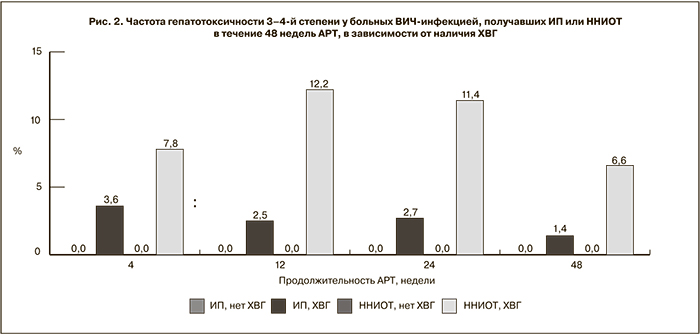
Среди пациентов с коинфекцией доля больных с гепатотоксичностью всех степеней составила 20,6–40,6% в группе получавших ИП и 44,6–74,4% в группе получавших ННИОТ (p < 0,05). При этом только у единичных пациентов, принимавших ИП, регистририровали повышение уровня трансаминаз 3-ю степени, тогда как у больных, получавших ННИОТ, выраженная гепатотоксичность встречалась в 6,6–12,2% случаев (рис. 2).
Анализ ОШ показал, что наличие ХВГ увеличивает риск развития гепатотоксичности 3-й степени в 1,7 раза при использовании ИП (ОШ – 1,7; 95% ДИ – 0–3,4) и в 17,1 раза при применении ННИОТ (ОШ – 17,1; 95% ДИ – 15,1–19,1).
Полученные результаты свидетельствуют о том, что ХВГ являются фактором риска развития гепатотоксичности у больных ВИЧ-инфекцией, получающих АРТ, особенно препараты класса ННИОТ.
Была проведена оценка влияния терапии невирапином на развитие гепатотоксичности в зависимости от пола пациентов и количества СD4+-лимфоцитов до лечения. В 1-ю группу вошли 18 женщин с количеством CD4+-лимфоцитов менее 250 клеток/мкл, во 2-ю – 17 женщин с количеством CD4+-лимфоцитов более 250 клеток/мкл. До начала лечения по 3 женщины из каждой группы (16,7 и 17,6% соответственно) имели повышенные значения АЛТ. В 1-й группе повышение уровня ферментов 1–2-й степени сохранялось у 2 (11,8–13,3%) женщин через 1 и 6 месяцев, при остальных визитах уровень АЛТ не превышал нормальных значений. Повышения уровня АЛТ 3–4-й степени в этой группе не было зафиксировано ни у одной из женщин. Среди пациенток 2-й группы повышение показателей АЛТ зарегистрировали в 25–60% случаев, причем гепатотоксичность 3-й степени развилась у 20–35,3% женщин в течение первых 6 месяцев лечения невирапином. Хотелось бы отметить, что 91% пациенток с подтвержденной гепатотоксичностью во 2-й группе не имели других факторов риска ее развития, кроме назначения невирапина.
3-ю группу составили 29 мужчин с количеством CD4+-лимфоцитов менее 400 клеток/мкл, 4-ю – 16 мужчин с количеством CD4+-лимфоцитов более 400 клеток/мкл. Перед началом АРТ 56,3% мужчин 4-й группы имели повышение уровня трансаминаз 1–2-й степени, в то время как в 3-й группе таких пациентов было 13,8% (все упомянутые пациенты страдали ХВГ). В процессе АРТ у больных 3-й группы не наблюдали увеличения частоты повышения уровня ферментов печени. Лишь у 1 больного через 4 недель лечения уровень АЛТ достиг 3-й степени, который регрессировал до 1-й степени уже к 12 неделям. У пациентов 4-й группы гепатотоксичность усиливалась в течение исследования, а частота повышения АЛТ 3-й степени к 24-й неделе достигла 31,3% (p < 0,05 по сравнению с 3-й группой). Возможно, что в данном случае мы имели дело с одновременным влиянием на развитие гепатотоксичности нескольких факторов (начальные повышенные значения АЛТ, наличие одновременно протекающего ХГВ, количество CD4+-лимфоцитов более 400 клеток/мкл у мужчин и использование невирапина).
Таким образом, женщин с количеством CD4+-лимфоцитов более 250 клеток/мкл и мужчин с этим же показателем, превышающем 400 клеток/ мкл, следует рассматривать как группу риска развития гепатотоксичности при приеме невирапина.
Замену схемы АРТ из-за развития гепатотоксичности произвели у 22 пациентов. У 14 (5,2%) больных, получавших EFV, замена на ИП была сделана на 24-й неделе лечения. Невирапин был заменен у 2 (2,5%) больных на 4-й неделе АРТ, у 5 (6,3%) – на 24-й неделе, у 1 (1,3%) больного – на 36-й неделе. Ни в одном случае повышение уровня трансаминаз не сопровождалось признаками лактоацидоза или желтухой. У 4 пациентов, использовавших невирапин, наблюдали кожные высыпания, что также способствовало принятию решения об отмене препарата.
Таким образом, наиболее часто повышение уровня ферментов печени происходит через 3–6 месяцев АРТ независимо от режима лечения. Использование ИП практически не влияет на частоту повышения этого показателя, в то время как при применении ННИОТ гепатотоксичность развивается более чем у половины пациентов к 6 месяцам АРТ. Исходное повышение уровня АЛТ и наличие ХВГ являются наиболее неблагоприятными факторами развития гепатотоксичности в процессе АРТ, особенно у больных, принимающих препараты класса ННИОТ. Женщин с количеством CD4+-лимфоцитов более 250 клеток/мкл и мужчин с этим же показателем, превышающем 400 клеток/мкл, следует рассматривать как группу риска развития гепатотоксичности при начале приема невирапина. Поскольку в каждом классе есть препараты с большим и меньшим гепатотоксическим эффектом, крайне важно подбирать схемы АРТ строго индивидуально, с учетом всех особенностей пациента.
На основе полученных результатов были сформулированы положения Протоколов диспансерного наблюдения и лечения больных ВИЧ-инфекцией (2014), в которых больным ВИЧ-инфекцией при наличии повышенных уровней аминотрансфераз (в особенности при сочетании с ХГВ) в качестве схем выбора рекомендованы режимы АРТ, включающие ИП. В Протоколах приведен также алгоритм тактики ведения больных ВИЧ-инфекцией при развитии гепатотоксичности в процессе АРТ [14].


