«Многие спрашивали меня, почему вспышка лихорадки Эбола в Западной
Африке столь велика и серьезна, почему с ней так трудно бороться?
Ответ на эти вопросы можно дать одним словом: бедность».
Маргарет Чен, Генеральный директор ВОЗ
Беспрецедентная эпидемия лихорадки Эбола (ЛЭ) в Западной Африке, начавшаяся в конце 2013 г. и продолжающая расширяться до настоящего времени, привлекла внимание и вызвала серьезную озабоченность не только среди медиков, но и в мировом сообществе, включая Россию. Разрозненные сообщения в масс-медиа не описывают полной картины и не всегда достоверны. В данном обзоре представлена, возможно, первая в отечественной литературе попытка рассмотреть эпидемиологические особенности инфекции, вызванной вирусом Эбола в Африке в 2014 г.
Стремительное развитие событий создает для авторов определенные затруднения: бóльшая часть актуальной информации еще не опубликована в рецензируемых журналах. Поэтому часть ссылок ведет на сайты авторитетных международных медицинских организаций: ВОЗ [1], Центров по контролю и профилактике заболеваний США (Centers for Disease Control and Prevention — CDC) [2] и Европейского центра по контролю и профилактике заболеваний (European Center for Disease Control and Prevention — ECDC) [3]. Кроме того, для сокращения и без того обширного списка литературы в некоторых случаях вместо ссылок на несколько оригинальных публикаций дается отсылка к обзорным статьям, в которых рассмотрены конкретные исследования.
Структура обзора такова: введение, содержащее основные факты о лихорадке Эбола; описание собственно эпидемии 2014 г.; обсуждение возможных причин, вызвавших эпидемию, и необходимых противоэпидемических мер; краткое рассмотрение допустимости применения инновационных профилактических и лечебных препаратов против ЛЭ. В следующем сообщении мы рассмотрим вопросы патогенеза и клиники ЛЭ, существующие возможности и перспективы ее профилактики и лечения.
Основные факты
Лихорадка Эбола — зоонозная природно-антропургическая вирусная инфекция, код А98.4 по Международной классификации болезней 10-го пересмотра. Часто ее называют также геморрагической лихорадкой Эбола (Ebola hemorrhagic fever), но более строгим современным термином является Ebola virus disease, поскольку нередки случаи заболевания, даже летальные, без геморрагических проявлений. Мы будем использовать устоявшееся русское наименование — ЛЭ.
Возбудителем ЛЭ являются вирусы рода Ebolavirus, семейства Filoviridae — оболочечные одноцепочечные РНК вирусы диаметром около 80 нм и длиной до 14 000 нм. Геном вируса состоит приблизительно из 19 000 нуклеотидов и кодирует 7 белков: нуклеопротеин (NP), белок вириона 35 (VP35), VP40, гликопротеин (GP), VP30, VP24 и РНК-зависимую РНК-полимеразу. В настоящее время известно 5 видов: собственно Эбола (Ebola virus, EBOV), ранее рассматривавшийся как вирус Эбола, подвид Заир; Судан (Sudan virus, SUDV), ранее рассматривавшийся как вирус Эбола, подвид Судан; вирус леса Таи (Tai Forest virus, TAFV); вирус Бундибуджио (Bundibugyo virus, BDBV); вирус Рестон (Reston virus, RESTV) [4]. Патогенными для человека являются первые 4 вида [5, 6]. Вирус Рестон способен вызывать бессимптомную инфекцию с образованием специфических антител.
Предполагается, что основным природным резервуаром Ebola virus являются крылановые (семейство Pteropodidae), обитающие только в тропической и субтропической зонах Восточного полушария, в частности крыланы видов Hypsignathus monstrosus (молотоголовый крылан), Epomops franqueti (эполетовый крылан Франке) и Myonycteris torquata (ошейниковый крылан), в крови которых были обнаружены РНК вируса и антитела к нему [7, 8]. Возможно инфицирование вирусом Эбола с развитием виремии и других млекопитающих — приматов, свиней, антилоп, грызунов, собак [5, 9—12].
По данным дистанционного зондирования Земли из космоса, все известные вспышки ЛЭ были привязаны к ландшафтным зонам галерейного, по берегам рек, тропического леса (например, в Судане) или сплошного тропического леса (например, в Габоне и Конго) [13, 14].
Инфекция Эбола с эпидемиологической точки зрения достаточно необычна. С одной стороны, она несомненно является природно-очаговой инфекцией, поскольку ее возбудитель способен неопределенно долго циркулировать в природных биоценозах за счет непрерывного эпизоотического процесса среди животных-доноров и реципиентов. Фактором риска для переноса инфекции человеку является потребление мяса диких животных (крыланов, обезьян и др.) и другие формы контакта с ними [15]. Механизм передачи — контактный, при попадании контаминированных вирусом Эбола биологических жидкостей (крови, мочи, слюны и др.) на слизистые оболочки или кожу. Вероятно также инфицирование выделениями плодоядных крыланов в отсутствии непосредственного контакта с ними (по аналогии с вирусной инфекцией Нипах (Nipah) [16]. Однако, проникнув в человеческую популяцию, инфекция Эбола ведет себя практически как антропоноз. В условиях Африки первой основной группой риска являются родственники, ухаживающие за больным, и другие лица, имеющие с ним прямые контакты, а также участники похоронных церемоний. Проблемой в Африке стало и повсеместно происходящее нозокомиальное инфицирование персонала и пациентов больниц, куда обращаются заболевшие ЛЭ, поэтому медицинские работники входят во вторую основную группу риска [5, 6, 17—19]. Известны случаи внутрилабораторного заражения при исследовании зараженных животных или работе с культурой вируса [17, 18, 20].
Первая известная вспышка ЛЭ произошла в 1976 г. в районе реки Эбóла в северной части государства Заир, впоследствии переименованного в Демократическую Республику Конго (ДРК); было выявлено 318 заболевших, 280 из которых умерли (здесь и далее см. табл. 1, построенную по материалам ВОЗ [21] с учетом дополнительной информации [22—24]). Выделенный вирус назвали Эбóла. В ДРК крупные вспышки повторились в 1995 и 2007гг. Последние случаи инфекции Эбола были зарегистрированы в ДРК в 2008 г. (Следует отметить, что таблица ВОЗ не включает данные некоторых публикаций, в частности, 21 случай тяжелой лихорадки с высоким титром антител к Ebolavirus у больных в ДРК в 1981—1985 гг. [25].)
Всего за период с 1976 по 2013 г. в ДРК заболели ЛЭ 930 человек, из них 736 умерли.
Меньшие по размеру вспышки наблюдались в Габоне в 1994, 1996 и, после некоторого перерыва, в 2001—2002 гг.; за все время наблюдения в стране зарегистрировано 208 заболеваний ЛЭ и 150 смертей. В 2001—2003 и в 2005 г. ЛЭ проявилась в Конго, преимущественно недалеко от границы с Габоном — в сумме 249 заболевших и 211 умерших.
Из этих данных вытекало, что ареал вируса Эбола охватывает компактную зону в Центральной Африке, в пределах ± 10о широты от экватора (рис. 1, см. на вклейке). В этой же зоне произошли 2 вспышки инфекции, вызванной впервые обнаруженным эболавирусом Бундибуджио: в 2007 г. в Уганде (зарегистрировано 37 смертей на 149 заболевших) и в 2012 г. в ДРК (29 смертей на 57 заболевших) [26].

Практически одновременно с открытием вируса Эбола в 1976 и 1979 гг. в Южном Судане в 1976 г. произошли 2 вспышки лихорадки, вызванной родственным вирусом Судан (зарегистрирована 151 смерть на 284 заболевших). В 2000 г. крупная вспышка произошла в Уганде (425 заболевших и 224 умерших). В 2004 г. эстафету вновь принял Южный Судан (17 больных и 7 смертей от ЛЭ). 7 лет спустя, в 2011—2012 гг., небольшое число случаев лихорадки Судан (32, из них 22 летальных) было выявлено в Уганде (см. табл. 1 и рис. 1).
Вирус леса Таи был изолирован от больного единожды в 1994 г. в Кот-д’Ивуаре.
Случай ЛЭ, завезенный из Габона, был отмечен в ЮАР в 1996 г.; заболела также медсестра, контактировавшая с пациентом [27].
Итого за 38 лет наблюдений (с 1976 по 2013 г.) в Центральной Африке было зарегистрировано около 2390 клинических случаев заболеваний, вызванных вирусами рода Ebolavirus, при этом около 1590 больных умерли. Наиболее многочисленными были случаи инфекции вирусом Эбола (1387 заболевших и 1097 умерших), что, хотя и трагично, но несопоставимо с ущербом от ВИЧ, туберкулеза и малярии в Африке. Но может быть инфекция Эбола обладала угрожающим потенциалом эпидемического распространения?
На начальном этапе вспышек ЛЭ в ДРК в 1995 г. и Уганде в 2000 г. 1 заболевший инфицировал от 1 до 5 человек; R0, то есть «базовое репродуктивное число», равнялось, по разным оценкам, 2,7 и 2,7 [28] или 1,8 и 1,3 [29] в ДРК и Уганде соответственно. Введение сравнительно ограниченных противоэпидемических мер позволяло снизить «репродуктивное число», которое в данном случае правильнее называть «эффективным репродуктивным числом (Re)» до значений меньше 1, то есть прервать распространение эпидемии [28—31].
Все это позволяло рассматривать филовирусную инфекцию как локальную африканскую проблему, сравнительно незначительную на фоне множества массовых бактериальных, паразитарных и вирусных инфекций в Африке. Определенный интерес в контексте создания и возможного применения бактериологического оружия представлял только высокий уровень летальности и достаточно высокая вирулентность при инфекциях, вызванных Ebolavirus. Однако и предположение о высокой летальности ЛЭ при заражении в природных условиях стало вызывать сомнение. При серологическом исследовании 4349 взрослых из 220 случайно выбранных деревень в Габоне в 2005—2008 гг. было обнаружено, что от 10 до 19% доноров имеют специфические IgG-антитела к вирусу Эбола. Это наблюдение, дополнительно подтвержденное Вестерн-блотом и наличием Т-клеточного иммунитета у доноров, свидетельствовало о широкой распространенности бессимптомных и/или легких форм ЛЭ в Габоне [16]. По мере снижения международной напряженности исследования ЛЭ свертывались в США, Европе и России.
Инкубационный период при ЛЭ варьирует от 2 до 21 дня, хотя обычно он составляет от 1 до 2 нед. или, согласно модельным вычислениям, 12,7 ± 4,3 дня [32]; считается, что в инкубационном периоде больной не заразен. Начало — острое с неспецифическими симптомами: лихорадка, озноб, слабость, миалгия. Позже могут присоединяться и другие симптомы: насморк, кашель, затруднение дыхания, боль в животе, диарея, тошнота, рвота, в тяжелых случаях — геморрагические симптомы. Клинический анализ крови выявляет изменения, типичные для вирусных геморрагических лихорадок: лейкопению, тромбоцитопению, повышенный уровень аминотрансфераз, увеличение частичного тромбопластинового времени, появление продуктов деградации фибрина [5, 33, 34]. На фоне значительных потерь жидкости развиваются нарушения водно-электролитного баланса, концентрации калия и натрия в крови резко снижены [35].
 Клиническая дифференциальная диагностика на начальных стадиях болезни затруднена, поскольку для других инфекционных заболеваний, преобладающих в Экваториальной Африке (малярия, боррелиозные возвратные лихорадки, менингококковая и пневмококковая инфекции, тиф, лихорадка Ласса и др.) характерна сходная неспецифическая симптоматика.
Клиническая дифференциальная диагностика на начальных стадиях болезни затруднена, поскольку для других инфекционных заболеваний, преобладающих в Экваториальной Африке (малярия, боррелиозные возвратные лихорадки, менингококковая и пневмококковая инфекции, тиф, лихорадка Ласса и др.) характерна сходная неспецифическая симптоматика.
Патогенез заболевания изучен недостаточно, в основном в опытах на приматах. Вирус Эбола способен размножаться в моноцитах, макрофагах и дендритных клетках, обнаруживается в эндотелиальных клетках, гепатоцитах, фибробластах, клетках надпочечников. После попадания в кровяное русло вирус диссеминирует в лимфатические узлы, печень и селезенку. Поражение печени ведет к гипопротеинемии, что в свою очередь вызывает повышенную гидрофильность внутренних органов и экссудаты в полостях, включая респираторный дистресс-синдром [35]. Тяжелое и очень тяжелое течение заболевания сопровождается развитием шока, энцефалопатии, значительными кровотечениями и кровоизлияниями во внутренние органы, что, в конечном счете, приводит к полиорганной недостаточности и смерти больного [5, 20]. Летальность при ЛЭ, по официальным данным ВОЗ и результатам их мета-анализа, составляет около 65—75% [21, 22], однако эта цифра, весьма вероятно, существенно завышена из-за недостаточного выявления среднетяжелых и легких форм заболевания. Такие формы, безусловно, существуют, равно как и бессимптомные формы инфекции, обнаруженные в исследовании E.M. Leroy и соавт. [36, 37]. Не исключено, что в реальности летальность составляет менее 5%, как при крымской геморрагической лихорадке в России и Турции в ХХI веке [38]. Примечательно, что из западноафриканских больных, госпитализированных в лечебницы, созданные организацией «Врачи без границ», выжили 70% [39].
Проводится поддерживающее симптоматическое лечение, этиотропной терапии не существует [1—3, 30]. Известны попытки переливания плазмы крови лиц, переболевших ЛЭ, применения гетерологичного (лошадиного) иммуноглобулина, рекомбинантного человеческого белка С (для коррекции нарушений свертываемости крови), рибавирина (рекомендованного ВОЗ для лечения крымской геморрагической лихорадки), но они оказались безуспешными [5, 20, 40]. Возможность использования «экспериментальной» терапии, показавшей положительный эффект в опытах на приматах [41—44], равно как и методы неспецифической и «экспериментальной» специфической профилактики, будут обсуждены ниже.
При наблюдении за 29 переболевшими ЛЭ и 152 совместно проживавшими с ними лицами было показано, что у части (до 70%) переболевших последствия заболевания, в первую очередь артралгия, миалгия и сниженная трудоспособность, сохраняются в течение 6 и даже 21 мес. При этом вирус Эбола или его антигены не выявлялись в образцах крови, слез, слюны, пота, фекалий, мочи, вагинального секрета или спермы переболевших. По неясным причинам РНК вируса Эбола была детектирована в образцах семени, взятых в период с 52-го по 91-й день после начала заболевания, у 4 из 5 исследованных переболевших в возрасте от 25 до 33 лет. Однако никаких свидетельств передачи инфекции от реконвалесцентов к контактным лицам не было обнаружено [45].
Эпидемия 2014 г.
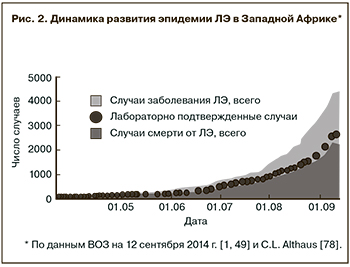
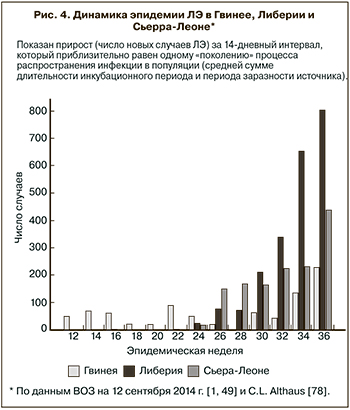
Первые сообщения о вспышке неизвестной лихорадки с высокой летальностью поступили 10 марта 2014 г. из городов Гекеду (Gueckedou) и Мацента (Macenta) на юго-востоке Гвинеи. Уже 16 апреля международной командой ученых была опубликована статья [19], в которой среди 20 изученных больных у 15 удалось подтвердить диагноз ЛЭ методом ПЦР и в 5 случаях изолировать вирус. Ретроспективное эпидемиологическое расследование позволило возвести практически все известные на тот момент случаи инфекции к заболеванию 2-летней девочки, умершей 6 декабря в селе Мелианду префектуры Гекеду. До февраля 2014 г. все заболевшие ЛЭ были родственниками этой девочки или ее знакомыми из сельских районов Гекеду. Однако 5 февраля заболел медицинский работник из больницы Гекеду, заразивший лечившего его врача из больницы Мацента. С этого момента вирус вырвался на свободу и стал распространяться по всей Гвинее. В мае стало окончательно ясно, что эпидемия началась также в соседних странах Либерии и Сьерра-Леоне. Несмотря на все попытки прекратить или ограничить распространение инфекции, заболеваемость ЛЭ продолжает расти практически экспоненциально (рис. 2, ), удваиваясь каждый месяц с апреля по август [46]. В результате, более 48% всех случаев выявлено в последние 3 недели наблюдений (с 17 августа по 7 сентября). Во всех трех странах наибольшее число новых случаев ЛЭ было зарегистрировано в последнюю неделю наблюдений (на 7 сентября — «эпидемиологическая неделя 36») (см. рис. 3, 4). Большинство (около 50%) случаев зарегистрировано в основном очаге эпидемии — в соседствующих районах Гекеду в Гвинее, Лофа (Lofa) в Либерии, Кенема (Kenema) и Кайлахун (Kailahun) в Сьерра-Леоне. Еще 30% — в районах Монтсеррадо, Мацента, Конакри, Магриби и Нимба. Десятки случаев ЛЭ выявляются еженедельно в столицах — Фритауне и Конакри, что является новой отличительной чертой эпидемии 2014 г. и вызывает особое опасение, поскольку их суммарное население превышает 2,5 млн чел. и через эти города проходит множество наземных и воздушных транспортных коммуникаций. Особенно тяжела ситуация в Монровии, столице Либерии, где за неделю (с 1 по 7 сентября) выявлено более 200 новых случаев ЛЭ, а число инфицированных уже в несколько раз превышает число имеющихся койко-мест, и больные, даже самостоятельно обратившись за медицинской помощью, вынуждены возвращаться в свои дома. Специалисты ВОЗ обеспокоены тем, что становится все вероятнее заражение в общественном транспорте — мотоциклах-такси и такси [1, 47].
В целом, согласно предварительной информации ВОЗ, на 7 сентября 2014 г. зарегистрирован 861 случай ЛЭ и 557 смертей в Гвинее, 2081 случай ЛЭ и 1137 смертей — в Либерии, 1424 случая ЛЭ и 524 смерти — в Сьерра-Леоне, то есть всего 4366 случаев и 2218 смертей [48, 49]. 2619 (60%) случаев ЛЭ считаются лабораторно подтвержденными. 21 случай ЛЭ и 8 смертей зарегистрировано в Нигерии, 1 подтвержденный и 2 подозрительных случая — в Сенегале [49].
Параллельно с 28 июля 2014 г. развивается вспышка ЛЭ в ДРК (62 случая и 35 смертей на 10.09.14), ограниченная пока одним округом Jeera, эпидемиологически не связанная с эпидемией в Западной Африке и вызванная геновариантом вируса Эбола, близким к обнаруженному во время эпидемии 1995 г. в ДРК [50, 51].
Результаты молекулярно-эпидемиологических исследований
Предполагается, что общий предок всех видов рода Ebolavirus существовал 1000—2000 [52] или даже 4000 лет назад [53]. При этом современные популяции видов Эбола и Рестон отличаются весьма малым генетическим разнообразием, вероятно из-за «эффекта бутылочного горлышка» или «эффекта основателя», и сформировались сравнительно недавно, позже 1945 г. [52] или даже в 1960—70 гг. [53, 54]. Общий предок известных геновариантов вируса Судан существовал, по расчетам, около 800 лет назад, филогенез вирусов леса Таи и Бундибуджио неясен, поскольку они представлены единичными изолятами.
Средняя скорость мутационного процесса у вируса Эбола оценивается приблизительно в 8 х 10-4 замен на позицию в год, то есть 16 мутаций на геном в год [52, 55]. В работе S. Baize и соавт. [19] были получены полные нуклеотидные последовательности вирусов, изолированных от трех гвинейских больных, лечившихся в середине марта в больницах Гекеду и Киссидугу. Эти 3 изолята были практически идентичными (всего 6 полиморфных позиций из 18 959), что однозначно указывало на непрерывную эпидемиологическую цепочку передачи инфекции. Построив филогенетическое дерево, включавшее все известные на тот момент полногеномные последовательности вирусов рода Ebolavirus, авторы показали, что гвинейские штаммы несомненно относятся к виду Эбола. При этом они отличаются от штаммов вируса Эбола, изолированных ранее в ДРК и Габоне, приблизительно на 3%. На основании структуры филогенетического дерева авторы предположили, что гвинейские, конголезские и габонские штаммы являются потомками общего предка, то есть, иными словами, предположили давнее, ранее 1976 г., существование независимого очага вируса Эбола в Западной Африке. Однако уже в мае—июне специалисты в области компьютеризированного филогенетического анализа [56, 57] указали на недостаточную адекватность процедур, примененных в работе S. Baize [19]. На основании тех же фактических данных они пришли к выводу, что геновариант вируса Эбола, занесенный в Гвинею, впервые возник в Центральной Африке (ДРК, Габон) в 2000—2006 гг. [56] или 1996—2004 гг. [57].

Принципиальным и важным шагом в изучении филогенетики вируса Эбола стала публикация 28 августа [55]. В первые 24 дня эпидемии в Сьерра-Леоне (май—июнь) было собрано 99 образцов генетического материала вируса Эбола от 77 больных. Методом Next Generation Sequencing (параллельное массивное секвенирование) были получены высококачественные полногеномные последовательности всех 99 изолятов, которые затем были изучены с помощью комплекса методов молекулярной эпидемиологии.
12 человек из района Кенема заразилось на похоронах народного лекаря-травника, практиковавшего на границе Гвинеи и Сьерра-Леоне. В этой группе было выявлено 2 несколько отличающихся геноварианта вируса Эбола. Первый вариант в июне уже не выявлялся, а второй стал распространяться по территории Сьерра-Леоне с востока на запад, накапливая в ходе процесса мутации и породив в ходе этого процесса третий геновариант. История его распространения когда-нибудь послужит сюжетом кинофильма. В Восточной провинции рядом с Гвинеей водитель-дальнобойщик подвез инфицированную медсестру за 50 км в ближайшую больницу в городок Jawie. Там она заразила лечащего врача, инфекция распространилась вокруг и была вынесена за 100 км в городок Kakua в Южной провинции. Водитель грузовика, также уже инфицированный, поехал дальше и привез вирус за 250 км в город Mambolo в Северной провинции недалеко от Фритауна [55, 58].
В результате эволюционного процесса в Западной Африке циркулируют уже несколько геновариантов вируса Эбола, несущих, по сравнению с исходными «гвинейскими» штаммами, десятки точечных мутаций. Соответственно штаммы из Гвинеи и Сьерра-Леоне накопили порядка 350 нуклеотидных замен [55]. Эти мутации предположительно снижают чувствительность уже разработанных диагностических ПЦР-тест-систем и могут влиять на патогенность и вирулентность вируса. Так ли это — пока неясно, но очевидно, что чем дольше продлится эпидемия в Западной Африке, тем разнообразнее и необычнее станет часть циркулирующих штаммов [59].
Что касается первоначального предка вируса Эбола, оказавшегося в Западной Африке, данные [55] дополнительно подтвердили, что его надо было искать в Центральной Африке 10 лет назад (с 2002 по 2006 г.). По филогенетическим расчетам единственный штамм, породивший эпидемию, проявился в Западной Африке в период с 27 января по 14 марта 2014 г. (что несколько расходится с эпидемиологическими наблюдениями, приведенными выше). Его потомки, попавшие в Сьерра-Леоне, сформировались в период с 2 апреля по 13 мая.
Был ли исходный штамм занесен инфицированным путешественником, крыланами, живущими как в Центральной, так и в Западной Африке, или иным путем — остается неясным [9, 55, 58]. Эпидемически опасной представляется практика охоты на крыланов, торговля ими и потребление их в пищу (с началом эпидемии гвинейское правительство пытается эту практику запретить) [9]. Также неизвестно и точное время заноса. В работе R.J. Schoepp и соавт. [60] были изучены сыворотки больных, поступивших в 2007—2008 гг. в больницу города Кенема в Сьерра-Леоне с подозрением на лихорадку Ласса. Оказалось, что у 60—70% таких больных можно было лабораторными методами снять диагноз лихорадки Ласса или малярии, то есть этиология лихорадки осталась неизвестной. Тогда более 250 таких сывороток были изучены с помощью комплекса серологических методов, выявляющих антитела к восьми тропическим инфекционным заболеваниям. Соответствующие IgG- и/или IgM-антитела были найдены методом ИФА у 25% больных, причем у 19% — только IgM-антитела, что указывало на острую инфекцию. По частоте встречаемости IgM-антител можно упорядочить выявленные заболевания в порядке убывания: ЛЭ — 18 (8,2%) исследованных больных, лихорадка Марбург (3,2%), желтая лихорадка (2,5%), лихорадка денге (2,4%), лихорадка долины Рифт (2,0%), лихорадка Чикунгунья (2,0%), лихорадка Западного Нила (1,2%), крымская геморрагическая лихорадка (0%). Реакция нейтрализации, золотой стандарт выявления специфических антивирусных антител, была применена для исследования 14 из 18 сывороток, содержащих только IgM-антитела к вирусу Эбола в ИФА. Оказалось, что 7 сывороток содержат в высоких концентрациях антитела, нейтрализующие только вирус Эбола, и одна — антитела, нейтрализующие вирус Судан, но не вирус леса Таи. Это свидетельствует в пользу предположения о наличии вируса Эбола на территории Сьерра-Леоне, как минимум, в 2006—2008 гг. Однако неясно, тот ли это был штамм, который впоследствии вызвал эпидемию 2014 г. В настоящий момент стартует аналогичное исследование коллекции сывороток больных с лихорадкой неясной этиологии, собранных в Гвинее с 1996 г. [9].
Обстоятельства, способствующие распространению эпидемии
15 стран, объединенных историческими, культурными, экономическими и транспортными связями, образуют Экономическое сообщество западноафриканских государств (ECOWAS), основанное в 1975 г. Помимо Гвинеи, Либерии и Сьерра-Леоне, в него входят Бенин, Буркина-Фасо, Гамбия, Гана, Гвинея-Бисау, Кот-д’Ивуар, Кабо-Верде, Мали, Нигер, Нигерия, Сенегал и Того. Общая площадь государств ECOWAS — более 5 млн. кв. км, население — 340 млн чел., валовый национальный доход, скорректированный по паритету покупательной способности (GNI-PPP) — более 1300 млрд долларов или в среднем 3900 долларов на душу населения, что делает этот экономико-торговый союз наиболее мощным в Африке [24]. Но именно затронутые ЛЭ страны относятся к беднейшим и наименее благополучным в мире, занимая, согласно комплексному индексу человеческого развития, оцениваемому ООН, последние места из 187 стран: Либерия — 174-е, Сьерра-Леоне — 177-е и Гвинея — 178-е. GNI-PPP на душу населения крайне низок и составляет около 970$ в Гвинее, 1340$ в Сьерра-Леоне и 580$ в Либерии. На все нужды здравоохранения тратится от 70 до 200$ на человека в год [1]. (Для сравнения, в Российской Федерации эти расходы составляют порядка 1500$ на человека в год, а в США — 8900$.) Отчасти это обусловлено последствиями разрушительных гражданских войн в Либерии и Сьерра-Леоне, политической нестабильностью и экономическим упадком в Гвинее. При этом регион тропического леса, где сходятся границы трех стран и где началась эпидемия ЛЭ, является беднейшим из бедных, отчасти потому, что он населен множеством малочисленных племен, которые не могут лоббировать свои интересы в центральных правительствах.
Почему же вспышка началась именно тогда, когда началась? Многие предыдущие вспышки ЛЭ совпадали по времени с окончанием сезона дождей и началом сезона засухи [14]. В условиях Гвинеи это именно декабрь—январь [23]. Возможно и альтернативное объяснение, также поддерживаемое статистическим анализом: за 2—3 месяца до выявления первого заболевшего ЛЭ наблюдались повышенная влажность и относительно низкая температура воздуха, что характерно для периода дождей [23]. Второе наблюдение предполагает усиление энзоотической циркуляции вируса за несколько месяцев до вспышки, первое, скорее, обращает внимание на условия, способствующие заражению человека от животного. Эти объяснения, возможно, являются взаимодополняющими и оба указывают на декабрь 2013 г. как на период повышенного риска занесения инфекции в человеческую популяцию. Предположение, что климатические условия могут способствовать или препятствовать распространению инфекции Эбола, заслуживает дальнейшего изучения [9]. Примечательно, что в работе J.E. Pinzon и соавт. [14] на основании анализа состояния растительности, характеризуемого нормализованным разностным вегетационным индексом NDVI, и его сезонных изменений было показано, что условия, типичные для риска вспышки ЛЭ, существуют не только в Центральной Африке, но и в поясе, дотягивающемся как раз до границ Гвинеи, Либерии и Сьерра-Леоне (рис. 5, см. на вклейке). Более того, в модели, предложенной J.E. Pinzon и соавт. в 2004 г., локализованные очаги, в которых наблюдались так называемые триггерные погодные изменения, запускающие вспышку ЛЭ, находились в 1994 и в 2001—2003 гг. не только в Габоне и Конго, где реально произошли вспышки ЛЭ, но и в регионе Западной Африки, охваченном эпидемией в 2014 г. (рис. 6, см. на вклейке).
 Использовав несколько иную методику, к аналогичным выводам пришли C.J. Tucker и соавт. [13], указав на характерные для риска вспышки ЛЭ природные условия, сложившиеся в Западной Африке в конце 1994 г. К сожалению, предупреждения оказались невостребованными.
Использовав несколько иную методику, к аналогичным выводам пришли C.J. Tucker и соавт. [13], указав на характерные для риска вспышки ЛЭ природные условия, сложившиеся в Западной Африке в конце 1994 г. К сожалению, предупреждения оказались невостребованными.
Но еще более важны социально-экономические причины беспрецедентной эпидемии ЛЭ. Из-за отсутствия санитарно-эпидемиологического надзора очаг лихорадки неясной этиологии был обнаружен только через 3 мес. после первого (предположительно) заболевания ЛЭ. Еще недели были потрачены на лабораторные исследования и начало попыток противоэпидемических мероприятий. Таким образом, была упущена возможность прервать распространение инфекции, локализовать и ограничить во времени вспышку ЛЭ. Это было характерно и для предыдущих крупных (более 100 больных) вспышек филовирусных лихорадок: от появления первого больного до начала противоэпидемических мероприятий с международным участием проходило от 2 до 7 мес., в среднем 3,5 мес. [26].
В целом здравоохранение в регионе находится в зачаточном состоянии — на 100 тыс. населения приходится лишь 1—2 врача, практикующих преимущественно в городах. Не хватает больниц, практически отсутствуют боксовые отделения, необходимые для изоляции больных, а также простейшие средства для индивидуальной защиты медперсонала, дезинфекции помещений и оборудования, утилизации зараженных отходов [6, 61, 62].
К настоящему времени (12 сентября) более 300 медицинских работников заболели и 144 из них скончались [49, 61]. В относительных величинах хуже всего ситуация в Либерии (81 умерший медработник на 4,2 млн населения) и лучше — в Гвинее (27 смертей на 11,5 млн населения). Это не только сокращает и без того скудные ресурсы и приводит к бегству персонала из больниц, но и повышает уровень напряженности в обществе: если болеют врачи, то на что надеяться обычным людям? По современным оценкам, по меньшей мере 250 медицинских работников требуется для лечения 70 больных лихорадкой Эбола в одном лечебном учреждении [61]. В развитых странах пропорции иные: при успешном лечении двух больных американцев в госпитале Университета Эмори (Атланта, США) было задействовано 5 врачей, 21 медсестра и более 100 человек вспомогательного персонала [35].
Распространению инфекции способствуют местные обычаи и верования. Так, например, в Гвинее в 60% случаях ЛЭ при расследовании причин заражения эпидемиологическая цепочка приводит к участию в традиционных погребальных обрядах [61]. (Ранее был описан случай заражения 27 больных на похоронах «очень уважаемого человека» во время вспышки 2007 г. в Уганде [26]). Рассматривая заболевание как порчу, насланную злыми колдунами, население скрывает больных и контактных от медицинского осмотра, избегает госпитализации, предпочитая обращаться к народным целителям и колдунам [24, 61]. Нередки сообщения о том, как бригады врачей и эпидемиологов просто не могли войти в охваченное ЛЭ селение, поскольку этому препятствовали вооруженные копьями, ножами и камнями жители [39, 63]. Под угрозой уголовного преследования власти требуют информировать о появлении больных ЛЭ и не укрывать их от врачей [63]. Достаточно трудно рационально объяснять необходимость противоэпидемических мероприятий в регионе, где грамотность населения не превышает 40—60% [24]. Поэтому неудивительно, что международные организации стараются максимально задействовать авторитет формальных и неформальных региональных лидеров: мэров, вождей, священников, старост деревень, популярных актеров и спортсменов и т. п.
Непосредственный ущерб, наносимый эпидемией ЛЭ, велик, но еще значительнее косвенные социально-экономические потери. Система здравоохранения охваченных эпидемией стран перенапряжена и окончательно разрушается, что особенно опасно на территориях с высокой заболеваемостью ВИЧ-инфекцией, малярией и другими тропическими болезнями. Производство и торговля сворачиваются, неизбежные карантинные меры, вводимые сейчас в основном очаге эпидемии на границе Гвинеи, Сьерра-Леоне и Либерии, хотя и должны способствовать сдерживанию эпидемии, тяжело переносятся населением. Экспоненциально растет число сирот и просто беженцев, нуждающихся в каком-либо приюте [1, 47]. На встрече Маргарет Чен с президентами Гвинеи, Сьерра-Леоне и Либерии ситуация была суммирована следующим образом: эти страны заведомо не способны сами справиться с эпидемией, общество охватывают чувства беспомощности и безнадежности [61].
Очевидна и уже реализуется опасность выноса инфекции за пределы трех стран: как непосредственно через границу, так и путем воздушного сообщения. ЛЭ уже занесена в Лагос, столицу Нигерии, где первые 13 случаев имели непосредственные контакты с больным путешественником из Либерии, прилетевшим 20 июля, но уже 27 августа лабораторно подтвержденный случай ЛЭ был выявлен в городе Порт-Харкорт, в 440 км от Лагоса, но недалеко от границы с Камеруном. Заболел врач, лечивший человека, контактировавшего с умершим от ЛЭ в Лагосе, но сбежавшим из-под карантина в Порт-Харкорт [64]. Потенциал распространения ЛЭ в Лагосе, самом крупном городе Африки (более 8 млн жителей), и Нигерии в целом (население — 169 млн чел.) невозможно переоценить. 27 августа 2014 г. первый завозной (из Гвинеи) лабораторно подтвержденный случаи ЛЭ был выявлен в Сенегале [1].
Возможен ли занос вируса Эбола в страны других континентов? С формальной стороны это вполне вероятно, поскольку ВОЗ пока не рекомендует строгих ограничений путешествий, а инкубационный период, как уже было сказано, может достигать трех недель и никакой выездной или въездной контроль на границах не может остановить инфицированного пациента без клинической симптоматики.
В оригинальной работе M.F.C. Gomes и соавт. [65] вероятность выноса за пределы Африки оценивается путем математического моделирования и компьютерного симулирования в рамках «Модели глобальной эпидемиологии и подвижности населения», опирающейся на фактические данные о населении 3362 регионов в 220 государствах и интенсивности транспортных связей между ними. В реализации модели учитываются основные закономерности и характеристики эпидемиологии распространения ЛЭ, включая то, что инфекция в Африке может распространяться тремя различными способами: внебольничным, внутрибольничным и на похоронах. По оценкам авторов, к 22 сентября 2014 г. вероятность прибытия инфицированного вирусом Эбола путешественника составляет не менее 25% для Ганы и Великобритании, выше 5% для Гамбии, Кот-д’Ивуара и Бельгии и порядка 1—3% для еще 11 государств, включая Францию, Германию, США и 8 африканских стран. Для остальных стран опасность оценивается существенно ниже. (Тут авторы упускают из виду одно неприятное обстоятельство, вытекающее из теории вероятности. Даже если вероятность заноса инфекции в каждую из 100 стран составляет 0,5%, вероятность того, что инфекция будет занесена в какую-либо одну из них приближается к 40%.). В случае длительной эпидемии риск пандемического распространения инфекции увеличивается. Авторы оценивают также последствия единичного заноса вируса Эбола на новую территорию. Предполагается, что для развитых стран при условии своевременного выявления и изоляции больных и контактных, а также отсутствия внутрибольничного заражения, число вторичных случаев будет менее четырех.
Так или иначе, из районов, затронутых эпидемией, в Россию прилетают сотни лиц (более всего студентов), а в США или Европу — тысячи. Неудивительно, что американские, европейские, российские специалисты разрабатывают рекомендации и принимают меры на случай заноса. Вероятнее всего, медицинские работники, в частности в инфекционных отделениях больниц, будут первыми, кто столкнется и сможет распознать случай, подозрительный на ЛЭ, поэтому рекомендации адресованы в первую очередь им [1—3, 66—68].
CDC был разработан комплект методических материалов, касающихся диагностики ЛЭ, идентификации, изоляции и лечения пациентов, действий экипажей самолетов при подозрении на ЛЭ среди пассажиров и других аспектов борьбы с этой инфекцией [2, 31, 67]. На основе этих материалов российскими специалистами подготовлен русскоязычный текст рекомендаций, доступный на сайте Роспотребнадзора [69].
В условиях США CDC рекомендует разместить больного с ЛЭ или подозрением на ЛЭ в одноместном боксе и принять обычные меры предосторожности против контактного или капельного заражения. Они предусматривают ношение непроницаемого для жидкости халата, перчаток, хирургической маски, защитных очков или щитка для лица. Если у пациента отмечаются обильные выделения, CDC также рекомендует ношение защитных брюк и обуви. Если планируется процедура, способная породить инфицированные аэрозольные частицы (например, интубация или бронхоскопия), CDC рекомендует проводить ее в палате с «отрицательным давлением воздуха» персоналом, носящим маску уровня защиты N95 [2, 66].
Несмотря на эти методические указания, руководство многих американских больниц планирует размещать больных ЛЭ исключительно в палаты отрицательного давления на все время лечения, обязать весь персонал, контактирующий с больным, постоянно носить костюмы высокой степени биозащиты и маски N95 или респираторы с подачей очищенного воздуха. Признавая, что для такого решения есть определенные, прежде всего эмоциональные, обоснования, связанные с высокой заболеваемостью ЛЭ медицинских работников в Африке, специалисты CDC, тем не менее, настаивают, что именно рекомендации CDC являются научно обоснованными и учитывают результаты изучения более 20 вспышек ЛЭ за последние 40 лет. Например, из 173 семейных контактов 27 больных с лабораторно подтвержденной ЛЭ в ДРК в 1995 г. только 16% оказалось инфицированными, хотя контактирующие с больными лица не предпринимали особых мер предосторожности [70]. При этом из 78 лиц, проживавших совместно с больными, но не имевших с ними прямого физического контакта, никто не был инфицирован. Основным фактором риска был непосредственный контакт с выделениями больного. Аналогичные данные были получены и при вспышке ЛЭ в Уганде в 2000 г. [71]. D.G. Bausch и соавт. [72] изучили, насколько загрязнена окружающая среда вокруг больных, в выделениях которых обнаружен вирус Эбола. Оказалось, что мазки, взятые с пола палаты, кровати, прикроватного стула, миски и плевательницы пациента, с кожи медсестер и т. п. не содержали вируса. Положительный результат был получен только при исследовании запачканных кровью медицинских перчаток.
Наконец, накапливаются данные о том, что в нормальной санитарно-гигиенической обстановке заражения вирусом Эбола редки. При лечении пациента в Южной Африке [26] изначально никто не знал о природе его болезни и не предпринимал необычных защитных мер. Из более чем 300 медицинских работников, так или иначе контактировавших с пациентом, заболел ЛЭ только анестезиолог, устанавливавший венозный катетер. При внутрилабораторных заражениях ЛЭ в Сергиевом Посаде и Кольцово, а также в Гамбурге, не заболел никто из контактировавших с больными, в том числе и медработники [17, 18, 20]. Не было вторичных случаев инфекции и при лечении двух больных в больнице Университета Эмори, при этом персонал соблюдал именно рекомендации CDC о стандартных мерах предосторожности и не носил костюмов высокой степени защиты [35]. В целом, CDC и ECDC оценивают вероятность вторичных случаев ЛЭ в Северной Америке и Европе как низкую [2, 3, 65, 73].
Эпидемия лихорадки Эбола — глобальная угроза и меры борьбы с ней
В сложившейся в 2014 г. ситуации эпидемия ЛЭ рассматривается как глобальная угроза, требующая согласованных действий всего мирового сообщества [31]. 8 августа ВОЗ официально признала эпидемию «чрезвычайной угрозой здравоохранению, имеющей международное значение» с активизацией соответствующих разделов Международных медико-санитарных правил 2005 г. (ММСП-2005) [1, 30]. Однако в охваченных ЛЭ странах отсутствуют ресурсы и инфраструктура, позволяющие действовать в соответствии даже с минимальными требованиями ММСП-2005 [74]. В конце июля ВОЗ и правительства Гвинеи, Либерии и Сьерра-Леоне подготовили «План мероприятий по борьбе со вспышкой лихорадки Эбола в Западной Африке» на период с июля по декабрь 2014 г. и запросили финансовую поддержку в размере 71 млн долларов США для исполнения данного плана и первоочередных действий по повышению противоэпидемической готовности [68]. 28 августа, в силу продолжающегося ухудшения эпидемической обстановки, этот план был срочно пересмотрен в сторону увеличения объема и многообразия противоэпидемических мероприятий и существенного роста ожидаемых затрат по линии ВОЗ (до 490 млн долларов США) [75].
Нельзя сказать, что эпидемия развивается беспрецедентно стремительно. С июня до сентября 2014 г. Re составляет, по оценкам H. Nishiura и соавт. [76], от 1 до 2 (как правило, от 1,4 до 1,7), что даже ниже, чем при прошлых вспышках (от 1,3 до 2,7) [28, 29]. Это означает, что число вторичных случаев в расчете на 1 «первичный случай» надо снизить всего лишь вдвое, до показателя ниже 1, и эпидемия пойдет на спад. Проблема в том, что на начальных этапах этого не удалось достичь, и число больных неуклонно и угрожающе возрастает (см. рис. 3 и 4). Математический анализ динамики эпидемии, проведенный различными методами [77, 78], не только дает аналогичные оценки величины Re (от 1,5 до 2,5 в зависимости от страны), но и выявляет лишь слабую тенденцию к ее снижению в Гвинее и Сьерра-Леоне и достаточно неожиданное постоянство Re в Либерии, указывающее на полную неэффективность противоэпидемических мероприятий. При сохранении нынешних темпов развития эпидемии до конца 2014 г. ожидается более 25 000 заболевших [77] или даже, при худшем сценарии, от 80 000 до 280 000 [76]. Эпидемия достигнет пика не ранее апреля 2015 г. и продлится до лета 2016 г. [77].
Задача «изолировать всех больных и проследить всех контактных» сравнительно легко решаема, когда больных десятки, а контактных тысячи. Когда каждую неделю, как в сентябре, в каждой из трех стран добавляется сотня новых больных, она становится крайне тяжелой [49]. Если счет пойдет на тысячи больных и сотни тысяч контактных, кто сможет ее выполнить в условиях Западной Африки? Согласно эпидемиологическим математическим моделям, инфекция с R0 порядка 2 может прекратиться сама собой не ранее, чем переболеет половина восприимчивой популяции [46]. В случае Западной Африки это, как минимум, десяток миллионов человек.
Что-то, безусловно, делалось и делается. Правительства затронутых эпидемией стран на основании объявленного режима чрезвычайного положения вводят подворные обходы, добровольную или насильственную изоляцию контактных на дому, устанавливают различные карантинные кордоны внутри страны или на границе. Предпринимаются меры по запрету публичных собраний с торговыми, культурными или спортивными целями [39, 79], в очагах инфекции прекращают работу учебные заведения.
Несмотря на то, что ни ВОЗ, ни CDC пока не рекомендуют формальных ограничений путешествий, ограничиваясь советами «не посещать очаг эпидемии без особой необходимости», некоторые страны, в первую очередь африканские (Кот-д’Ивуар, Мавритания, Кения), Саудовская Аравия и др., закрыли границы для граждан Гвинеи, Либерии и Сьерра-Леоне, а ряд авиакомпаний (например, British Airways, Emirates и Air France) приостановил полеты в эти страны [65]. Многие страны, в том числе Россия, проводят термометрию пассажиров рейсов из Африки и, при необходимости, медицинский осмотр. Однако ВОЗ признает недостаточную эффективность въездного контроля и призывает усилить выездной контроль в странах, где зафиксированы случаи заболевания ЛЭ. Следует отметить, что с научной точки зрения рациональность частичных транспортных ограничений достаточно дискуссионна. Моделирование показывает, что снижение числа пассажиров полетов из очага инфекции в 5 раз не влияет на форму кривой роста вероятности выноса инфекции Эбола, но лишь отодвигает эту вероятность приблизительно на месяц [65].Такая отсрочка, сама по себе нелишняя, будет полезной, только если за это время удастся переломить тенденцию к разрастанию эпидемии.
В сущности, список срочных необходимых действий достаточно очевиден. В области профилактики — это более безопасное поведение (настороженность по отношению к лихорадочным заболеваниям в эндемичных районах, своевременное обращение за медицинской помощью, введение эпидемически безопасных процедур захоронения), лимитирующее распространение ЛЭ в популяции; повышение уровня биобезопасности в лечебных учреждениях путем обучения персонала, снабжения его средствами индивидуальной защиты и дезинфекции, улучшения условий содержания, изоляции и лечения больных (предотвращение нозокомиальной передачи). В перспективе, для предотвращения повторных заносов инфекции из природных очагов — обеспечение безопасности пищи, в частности прекращение небезопасных практик разделки и потребления мяса диких животных, снижение числа контактов с крыланами (разрыв цепочки животное—человек). Усиление эпидемиологического надзора за ЛЭ предполагает создание системы выявления и учета заболеваний, подозрительных на ЛЭ; внедрение информационных технологий для эффективного сбора, хранения и анализа данных; обеспечение средствами безопасного транспорта биологических образцов и обеспечение диагностическими тест-системами; привлечение и обучение необходимого числа эпидемиологов, лечащих врачей и лабораторных работников. Поскольку необходимая для эффективной борьбы с инфекцией инфраструктура отсутствует, предполагается, в соответствии с рекомендациями ВОЗ, создание специальных центров по чрезвычайной ситуации (Emergency Operation Centers) в каждом из охваченных ЛЭ регионов, проводящих и координирующих противоэпидемические и лечебные мероприятия, а также развертывание надлежащим образом оснащенных центров лечения больных ЛЭ (Ebola treatment Centers), центров выявления ЛЭ, изоляции и наблюдения контактных лиц (Ebola Referral Centers) и аттестованных ВОЗ диагностических лабораторий.
Согласно «Плану борьбы с Эбола» [75], общий бюджет которого составляет 490 млн долларов, ставятся следующие цели с соответствующим предполагаемым финансированием по линии ВОЗ:
- В странах с высокой заболеваемостью ЛЭ в течение 3 мес. переломить тенденцию к росту числа новых случаев ЛЭ и расширению ареала инфекции, прервать распространение инфекции в столицах и главных портовых городах; в течение 6—9 мес. полностью остановить передачу инфекции (на достижение этой цели планируется выделить 389 млн долларов).
- В странах, где обнаружены или могут быть обнаружены единичные случаи ЛЭ, обеспечить полное прерывание передачи инфекции не позднее, чем через 8 нед. после выявления первого случая ЛЭ (13,4 млн долларов).
- В течение 1 мес. ввести в действие план мероприятий по выявлению ЛЭ и борьбе с ней, в первую очередь в странах, граничащих с регионами, где наблюдается активный процесс передачи ЛЭ, и во всех крупных узлах международных транспортных связей (20 млн долларов).
На прочие расходы, связанные с практической реализацией плана, зарезервировано 69 млн долларов.
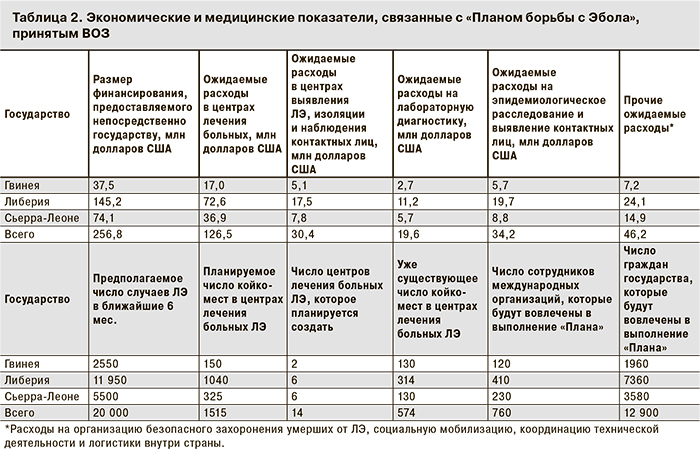
В табл. 2 приведены основные типы мероприятий и ожидаемые расходы за 6 мес., необходимые для достижения первой цели — остановить распространение инфекции в Гвинее, Либерии и Сьерра-Леоне. Финансирование, направляемое непосредственно в эти страны Западной Африки, должно по плану составить 257 млн долларов и распределяться в следующих пропорциях: Гвинея — 15%, Либерия — 56%, Сьерра-Леоне — 29%. Дело в том, что даже при условии выполнения поставленных целей, ВОЗ ожидает значительное количество новых случаев ЛЭ в ближайшие 6 мес.: до 2500 (13% от суммарной заболеваемости) в Гвинее, до 12 000 (60%) в Либерии и до 5500 (27%) в Сьерра-Леоне. Именно эти пропорции (13:60:27) с небольшими вариациями используются для оценки тех или иных ресурсов, необходимых каждой из стран для выполнения плана (см. табл. 2). Из этого расчета планируется создание 14 центров по лечению на 1515 койко-мест. Уже развернуты специальные центры по лечению ЛЭ на 130 коек в Гвинее, на 314 коек в Либерии и на 130 коек в Сьерра-Леоне, но их количество критически недостаточно. Предполагается, что в каждый центр по лечению будут поступать больные в среднем из 10 центров выявления ЛЭ, изоляции и наблюдения контактных лиц, таких центров должно быть создано около 158.
Расходы на лабораторную диагностику рассчитаны, исходя из необходимости изучить 80 000 клинических образцов по общей стоимости в 244$ за образец. Эпидемиологическое расследование и выявление контактных лиц будут вести около 27 мобильных команд; предполагается, что каждая из них сможет в среднем выявить до 1000 контактных лиц в месяц, то есть всего будет прослежено около 160 000 контактных при расходе около 244$ на каждого выявленного.
На организацию 20—25 специальных похоронных команд выделяется порядка 6 млн долларов на 6 мес. при стоимости похорон около 400$. Ожидается, что каждая из команд будет вынуждена проводить до 100 похорон в месяц.
С целью социальной мобилизации и вовлечения общества в борьбу с эпидемией из добровольцев будет сформировано 25 команд, каждая с бюджетом около 80 000$ в месяц и задачей охватить своей активностью до полумиллиона населения.
В помощь национальным центрам по чрезвычайной ситуации на субнациональном (региональном) уровне планируется создать 10 офисов с бюджетом около 450 000$ в месяц, занимающихся координацией региональных партнерских взаимодействий и противоэпидемических мероприятий, оказанием информационной и материально-технической поддержки.
Предполагается, что в выполнении «Плана борьбы с Эбола» примут участие около 760 сотрудников международных организаций и 12 900 сотрудников — граждан Гвинеи, Либерии и Сьерра-Леоне, распределенные по трем странам опять же в пропорции приблизительно 15%:57%:28%.
В центрах лечения Эбола, центрах выявления и изоляции и диагностических лабораториях будут работать около 5940 сотрудников или 43% от общего их числа. Доля иностранцев среди них составит порядка 7%.
Прослеживанием контактных лиц, социальной мобилизацией и взаимодействием с населением в целом будут заниматься 5470 (40%) сотрудников, на 98% — граждане затронутых ЛЭ государств.
Дополнительные противоэпидемические мероприятиям, включая безопасное захоронение, будут поручены 1710 (13%) сотрудникам.
Персонал региональных координационных офисов составит около 540 человек или 4% от числа занятых в «Плане». В целях передачи опыта 25% из них будут сотрудниками международных организаций.
Превентивные противоэпидемические меры предпринимаются и во многих странах мира. В 33 из 41 государства, входящих в «африканский регион ВОЗ» [1, 49], уже функционирует соответствующая система эпиднадзора в основных пунктах пересечения наземной границы, а также в столичных аэропортах, морских портах и крупных больницах. В 12 государствах утверждены специальные протоколы мероприятий в случае выявления путешественника с лихорадкой неясной этиологии. 14 государств рапортовало о наличии функционирующих учреждений для изоляции и лечения лиц с подозрением на ЛЭ. В 27 странах разработана процедура и имеется возможность доставки клинических образцов в аккредитованные ВОЗ диагностические лаборатории. 14 стран утвердили протоколы по выявлению и отслеживанию лиц, контактировавших с больными ЛЭ или с подозрением на ЛЭ [49]. Остальные государства также планируют подобные мероприятия в ближайшее время.
В целом на достижение 2-й и 3-й цели «Плана» (предотвращение расширения зоны, охваченной эпидемией), деятельность лабораторий, координационных и кризисных центров на международном уровне предполагалось потратить более 100 млн долларов.
Впрочем, все это расчеты на 28 августа; уже 8 сентября ВОЗ заявила, что финансирование борьбы с эпидемией, в частности в Либерии, потребует дополнительного увеличения расходов в 3—4 раза.
Разумеется, помощь странам Западной Африки осуществляется не только по линии ВОЗ, но и непосредственно такими организациями, как Всемирная продовольственная программа, Всемирный банк, «Врачи без границ», Институт Пастера и др. Так, например, CDC предоставляет необходимое компьютерное оборудование и программы для создания возможности регистрации и учета заболеваемости «в режиме реального времени», проводит обучение [61]. Новые информационные технологии в принципе могут быть адаптированы даже к условиям сельской местности в Западной Африке, поскольку до 40% населения имеют мобильные телефоны и могли бы с помощью специальных приложений сообщать об эпидемической обстановке.
В настоящее время случаи с подозрением на ЛЭ исследуются либо в лабораториях центров, сотрудничающих с ВОЗ, либо в лабораториях, аккредитованных и контролируемых ВОЗ. Работают мобильные бригады, посланные Евросоюзом и Канадским агентством здравоохранения [49]. Ожидается, что в ближайшее время приступит к диагностической деятельности российская мобильная специализированная противоэпидемическая бригада (СПЭБ), посланная в Гвинею по линии Роспотребнадзора. ВОЗ сообщает также, что в Сьерра-Леоне должны прибыть 165 кубинских специалистов: 50 врачей, 100 медсестер, 3 реаниматолога, 3 эпидемиолога и др. [1].
В 2014 г. международное сообщество вступило недостаточно готовым, без каких-либо лицензированных препаратов для этиотропной терапии или специфической профилактики ЛЭ. В сущности, ситуация на весну 2014 г. была суммирована еще на совещании североамериканских специалистов, состоявшемся в августе 2013 г. [80, 81], список разрабатываемых вакцин и лекарств содержится также в публикациях [5, 41, 82, 83]. Для всех рассмотренных на совещании препаратов начало первой фазы клинических испытаний планировалось в лучшем случае на 2014 г., чаще — на 2015 или 2016 гг. Соответственно медицинское применение успешно прошедших испытание препаратов ожидалось не ранее 2018 г. Однако в 2014 г. один из препаратов, а именно ZMapp, коктейль из трех моноклональных антител производства компании «Mapp Biopharmaceutical Inc.» (США), был использован при лечении двух заболевших американских медицинских работников в клинике Университета Эмори (Атланта) [35, 84]. Это создало прецедент использования нелицензированных препаратов в чрезвычайных ситуациях. При этом, разумеется, нельзя сделать никакого заключения о вкладе этого лечения в благополучный исход заболевания данных пациентов [83]. Весьма вероятно, что при своевременно начатом симптоматическом и поддерживающем лечении в условиях специализированной клиники летальность при ЛЭ существенно ниже 50%, что показывает, в частности, выздоровление нескольких больных при внутрилабораторном заражении вирусами Эбола и Марбург [17, 18].
Насколько этично использование «экспериментальных» лекарственных препаратов, не прошедших не только клинических испытаний с точки зрения эффективности (фаза 3), но и базовых испытаний на токсичность для человека и другие нежелательные побочные эффекты (фаза 1)? Эксперты ВОЗ, собранные на специальное совещание 11 августа, в осторожных выражениях высказали мнение, что это может быть этично и допустимо в связи с тяжестью ситуации [85]. 5 сентября новое собрание экспертов предположило, что в ноябре закончатся предварительные испытания безопасности двух вакцин (на основе химер вируса Эбола с вирусом везикулярного стоматита или аденовируса шимпанзе), и можно будет приступить к вакцинации некоторых медицинских работников в Африке [86]. Также совещание высказалось за переливание сыворотки или даже цельной крови от переболевших ЛЭ, несмотря на то, что убедительные доказательства эффективности такой терапии геморрагических вирусных лихорадок пока отсутствуют. В частности, в медицинском центре Университета Небраски уже проведено 2 переливания плазмы от выздоровевшего американского врача Кента Брентли третьему американцу, заболевшему ЛЭ.
Альтернативой использованию «экспериментальных лекарств» может явиться применение уже лицензированных препаратов, либо обладающих активностью против вируса Эбола in vitro, либо могущих способствовать повышению сопротивляемости организма человека [83]. К таким лекарствам относят хлорохин (препарат для лечения малярии, амебиаза и аутоиммунных расстройств) и иматиниб (ингибитор тирозиновой протеинкиназы, противолейкозный цитостатик), а также инферген, рекомбинантный «консенсусный» интерферон α, применяемый для лечения гепатита С, кломифен и торемифен (селективные модуляторы эстрогеновых рецепторов) и др. [87—89]. Преимущество таких препаратов в том, что в результате клинических испытаний и лечебного применения известны их безопасные дозировки и возможные побочные эффекты. Кроме того, существуют достаточный запас и возможность увеличения производства подобных лекарств. Однако их эффективность для терапии именно ЛЭ абсолютно не изучена. Ведущий специалист в области изучения вируса Эбола Томас Гайсберт (Geisbert) сказал: «Я встречал множество веществ, которые ингибировали вирус Эбола в культуре клеток, но не работали на грызунах, или работали на грызунах, но не защищали обезьян».
Представляется очевидным, что в ходе нынешней эпидемии «экспериментальные» лекарства не будут использоваться в широком масштабе в странах Африки. Вероятнее всего, они могут быть использованы только для лечения и профилактики весьма ограниченного числа лиц, возможно, сотрудников международных организаций и некоторых местных медицинских работников, непосредственно и небезопасно контактирующих с больными [90]. Во-первых, эти препараты пока наработаны в крайне ограниченном количестве. Во-вторых, если речь идет о лекарственных препаратах, без испытаний совершенно непонятно, каким больным их надо назначать. Наиболее тяжелым? Но на терминальной стадии болезни любое лечение может быть бесполезным. Больным со среднетяжелым течением? Но «экспериментальное лечение» больных такого рода труднее этически оправдать, а их выздоровление может быть результатом естественного процесса (в то время как организация двойного слепого плацебо-контролируемого рандомизированного исследования в условиях африканской эпидемии практически невозможна). В-третьих, расшатывание сложившейся строгой системы доклинических и клинических испытаний, лицензирования и применения препаратов может иметь весьма нежелательные последствия. В-четвертых, и это самое важное, использование «экспериментальных» препаратов на настоящем этапе может принести больше вреда, чем пользы как самим разработчикам и производителям, так и профессионалам, борющимся с эпидемией в Африке. Даже если с медицинской точки зрения будет достигнут положительный эффект, это создаст напряженность между западными организациями и африканским обществом, которое, возможно, не уделяя должного внимания эпидемиологическим и социальным мерам, будет требовать «больше лекарств и вакцин», которые пока не могут быть произведены в количествах, необходимых для тысяч и миллионов людей [91]. Если же выявятся неэффективность или неприемлемые побочные эффекты недостаточно испытанных препаратов, это серьезно ударит по репутации разработчиков и затруднит их дальнейшие исследования. Хуже всего, что опять поднимется волна общественного негодования: фармацевтические фирмы травят народ в корыстных целях, «эксплуатируют бедных африканцев». Это существенно затруднит проведение непопулярных, но необходимых в первую очередь эпидемиологических и социальных мероприятий, таких как безопасное захоронение умерших, изоляция больных, отслеживание контактных, ограничение передвижения или более строгие карантинные меры [83]. В определенном смысле создается порочный круг: применение лекарственных средств и вакцин требует проведения их клинических испытаний на больных, что возможно только при наличии большого числа инфицированных [91], но именно в условиях эпидемии проведение клинических испытаний по целому комплексу причин труднореализуемо. Неясно, кто возьмет на себя ответственность разорвать этот порочный круг. От малярии ежедневно умирает около 5000 чел., но достаточно эффективные способы борьбы с этой инфекцией в тропических и субтропических странах все еще не разработаны.
Заключение
Можно только согласиться с Генеральным директором ВОЗ Маргарет Чен: основная причина эпидемии ЛЭ в Западной Африке — социально-экономическая отсталость и, как следствие, неготовность общества использовать даже те ограниченные национальные и международные ресурсы, которые уже имеются в наличии, для борьбы с инфекционными заболеваниями. Безусловно, финансирование противоэпидемических мероприятий будет в ближайшие месяцы увеличено за счет различных международных доноров. США отправляют в Африку 3000 военнослужащих на борьбу с вирусом Эбола, бюджет программы оценивается в 500 млн долларов, планируется, среди прочего, построить 17 центров по обучению медперсонала [92]. Совет безопасности ООН собирал 18 сентября экстренное заседание в связи с кризисной ситуацией, вызванной эпидемией Эбола [93], это второй раз в истории, когда Совет рассматривает проблемы здравоохранения.
Но деньги еще должны быть максимально рационально использованы. В этом контексте представляется перспективным внедрение методических и организационных подходов советской/российской системы санэпиднадзора. Анализируя и представляя российский опыт для зарубежного читателя, мы писали:
«The RU AP system (российская система санэпиднадзора) has extensive and time-proven experience in developing zoonotic disease response systems that is applicable to these regions. Its tradition of education, training, and monitoring are valuable for Africa, Asia, and other epidemiologically active regions. Governments in these parts of the world do not necessarily have well-developed veterinary or public health systems that would be resistant to change. The RF AP system is unique in its multidisciplinary approach, which includes ecologists and biologists with extensive knowledge of animal behavior, biology, and landscape ecology. Could this not serve as an opportunity to take an integrated and multidisciplinary approach to zoonotic threats when building health systems?
It should also be noted that until relatively recently, the RF AP system functioned with basic, low-tech classic microbiological methods and well-trained personnel, which might suit the fiscal challenges of these areas. Additional strengths of the RF AP system are a clear and orderly (albeit bureaucratic) system for sample collection, handling, biosafety, reporting of zoonoses, decision making, and distribution of responsibilities; well-defined response protocols that apply to both humans and animals; and specially trained medical and paraprofessional personnel. These might serve as a template for other countries as they try to develop integrated biosurveillance systems» [94].
Российское здравоохранение, включая противоэпидемические службы, и общество в целом сумело справиться с эпидемиями чумы, тифа, менингококковой инфекции и других высококонтагиозных и смертельных инфекций в 1920-е годы. Это было сделано в условиях, еще более неблагоприятных, чем ситуация в Западной Африке в 2014 г.: в огромной стране с разрушенной гражданской войной экономикой и транспортной системой, с малограмотным деревенским населением и малым количеством врачей и фельдшеров, без международной помощи, без эффективных средств диагностики и терапии, без современных средств коммуникации. Подобные достижения вселяют надежду, что и лихорадка Эбола может и должна быть побеждена.


