Современная антиретровирусной терапия ВИЧ-инфицированных пациентов преследует комплексную цель: сократить количество вируса в организме, восстановить и сохранить иммунологические функций организма, снизить частоту возникновения оппортунистических инфекций и повысить общую продолжительность жизни больных ВИЧ. Основным механизмом действия эффективных лекарственных препаратов (ЛП) для лечения ВИЧ/СПИДа является блокада ферментов вируса, способствующая подавлению репликации ВИЧ на максимально длительный срок. Высокоактивная антиретровирусная терапия (ВААРТ) на сегодняшний день не дает полного избавления от ВИЧ, однако при правильном ее проведении может надолго отсрочить переход ВИЧ-инфекции в стадию СПИДа, а также улучшить качество жизни пациента [1, 2]. В настоящее время, согласно международным стандартам лечения, для терапии ВИЧ-инфицированных пациентов рекомендуется использование схем терапии, которые включают основные группы антиретровирусных лекарственных средств в зависимости от принципа действия: ингибиторы обратной транскриптазы (нуклеозидные – НИОТ, ненуклеозидные – ННИОТ, нуклеотидные – НтИОТ), ингибиторы протеазы (ИП), ингибиторы слияния/проникновения (ИС), ингибиторы интегразы (ИИ) [3, 4].
ИП – данный класс препаратов появился спустя примерно 10 лет после открытия первых ингибиторов обратной транскриптазы. Появление этого класса препаратов обусловило создание схем ВААРТ, включающих, как правило, два препарата из группы НИОТ и один из группы ИП или ННИОТ. Именно использование ИП в комбинированных схемах лечения привело к заметному сокращению заболеваемости и смертности среди больных ВИЧ-инфекцией в течение последнего десятилетия [5]. Одним из представителей класса ИП, который продемонстрировал противовирусную эффективность и в целом хорошую переносимость при введении в комбинации с другими антиретровирусными препаратами, был ампренавир [6]. Однако его биодоступность невысока и может колебаться в диапазоне 35–90% в связи с высокой липофильностью и другими фармакокинетическими параметрами препарата, что в свою очередь приводит к необходимости приема большого количества таблеток (от 10 до 16 в зависимости от схемы лечения) для достижения необходимого терапевтического эффекта и отрицательно влияет на приверженность к лечению, а также потенциально увеличивает риск развития побочных эффектов [6–8]. Другие ЛП из группы ИП, такие как нелфинавир и саквинавир, также необходимо принимать в большом количестве, что ограничивает их использование [9, 10]. Для повышения биодоступности ампренавира был синтезирован ЛП фосампренавир (телзир) – ИП, который является пролекарством, то есть гидролизуется с образованием активного метаболита – ампренавира. 6-недельное рандомизированное контролируемое двойное слепое клиническое исследование, проведенное у наивных ВИЧ-инфицированных пациентов, продемонстрировало достижение такой же концентрации ампренавира при приеме фосампренавира, как и при приеме стандартных доз ампренавира. Таким образом, при использовании фосампренавира достижение терапевтической концентрации препарата происходит при приеме меньшего количества таблеток, что в свою очередь может способствовать повышению приверженности пациента к лечению [11].
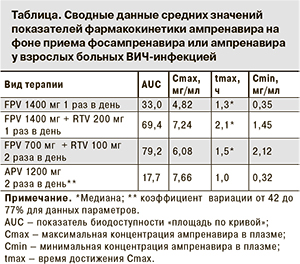
Ампренавир имеет период полувыведения (t1/2), равный 8 ч, его метаболизм происходит преимущественно под действием микросомальных ферментов печени. По данным лабораторных исследований, в сочетании с препаратом из группы ИП ритонавиром наблюдается повышение показателей биодоступности при использовании однокамерной фармакокинетической модели [12, 13]. Ритонавир является мощным ингибитором метаболизма ампренавира и при сочетании с фосампренавиром также влияет на ряд важнейших фармакокинетических параметров (см. таблицу), что приводит к повышению выраженности и продолжительности его действия на системном уровне [14–16].
Базовыми исследованиями оценки клинической эффективности фосампренавира являются рандомизированные открытые многоцентровые клинические исследования NEAT и SOLO продолжительностью 48 нед. каждое, результаты которых позволяют сравнить эффективность использования фосампренавира как без ритонавира, так и в сочетании с ним, с эффективностью аналогичного использования нелфинавира, который на момент начала исследований являлся одним из популярных ЛП из группы ИП для лечения ВИЧ-инфицированных пациентов, ранее не получавших терапии [17, 18].
В исследовании NEAT приняли участие 249 пациентов с ВИЧ, ранее не получавших терапии. Им назначали фосампревир в дозе 1400 мг или нелфинавир в дозе 1250 мг 2 раза в день. В исследовании SOLO приняли участие 64 пациента, которые получали либо фосампренавир/ритонавир (FPV/r) – 1400/200 1 раз в день, либо нелфинавир – 1250 мг 2 раза в день на фоне терапии абакавиром и ламивудином в дозах 300 и 150 мг соответственно 2 раза в день [17–19]. Критерии включения определялись уровнем РНК ВИЧ, при этом не учитывалось содержание CD4+-лимфоцитов, хотя пациенты не получали антиретровирусной терапии до начала исследования. У многих из них была продвинутая стадия ВИЧ-инфекции, средний базовый уровень РНК ВИЧ составил 4,8 log10 копий/мл в обоих исследованиях. Первой контрольной точкой в этих исследованиях было определение числа пациентов, достигших уровня РНК ВИЧ < 400 копий/мл через 48 нед. лечения. Вторая контрольная точка включала определение процента пациентов с уровнем РНК ВИЧ < 50 копий/мл и средние показатели изменения уровня РНК ВИЧ и CD4+-лимфоцитов по сравнению с исходным уровнем [17, 20].
Согласно результатам, полученным в исследовании NEAT, пациенты, получавшие 2 раза в день терапию фосампренавиром, чаще достигали целевых уровней РНК ВИЧ < 400 копий/мл через 48 нед., чем те, кто получал лечение нелфинавиром (66 и 51% соответственно). Примерно такое же соотношение наблюдалось и в достижении второй контрольной точки исследования – показателя уровня РНК ВИЧ < 50 копий/мл (55 и 41% соответственно при использовании фосампренавира и нелфинавира). Важным наблюдением в исследовании NEAT явилось то, что фосампренавир сохранил свою антиретровирусную эффективность независимо от исходных показателей вирусной нагрузки или уровня CD4+-лимфоцитов, тогда как при применении нелфинавира пациенты с поздними стадиями ВИЧ-инфекции значительно реже достигали целевых уровней РНК ВИЧ [20]. По завершении исследования NEAT более 50% пациентов продолжили получать фосампренавир, при этом в подавляющем большинстве (90%) случаев у них был достигнут устойчивый вирусологический ответ.
В исследовании SOLO за 48 нед. показателя вирусной нагрузки < 400 копий/мл достигли 69% пациентов, получавших в составе терапии фосампренавир, и 55% пациентов достигли второго целевого показателя – вирусной нагрузки < 50 копий/мл. Среди пациентов, получавших нелфинавир, эти показатели составили 68 и 53% соответственно. Однако несмотря на не слишком выраженные различия в результатах терапии, следует отметить эффективность фосампренавира в достижении целевых показателей при исходном уровне РНК ВИЧ > 500 000 копий/мл, в отличие от нелфинавира, на фоне которого наблюдался низкий процент достижения целевых уровней при исходно продвинутой стадии ВИЧ-инфекции [17]. Вирусологическая неудача, по данным исследования SOLO, наблюдалась значительно чаще при использовании нелфинавира, чем у пациентов, получающих фосампренавир (17 и 7% соответственно). Важным моментом является и то, что не было выявлено генотипических мутаций, которые могли бы привести к развитию резистентности к ампренавиру. При анализе приверженности пациентов к лечению в исследовании SOLO число пациентов, которые при каждом визите сообщали об удобстве и комфорте при использовании ЛП, было выше среди лиц, получающих FPV/r, чем среди тех, кто получал нелфинавир (78% против 67%) [17, 21].
Таким образом, в исследованиях NEAT и SOLO фосампренавир продемонстрировал бóльшую эффективность в составе комбинированной антиретровирусной терапии у пациентов, ранее не получавших лечения, по сравнению с нелфинавиром. При этом в исследовании NEAT эффективность фосампренавира была выше при приеме его пациентами 2 раза в день в составе комбинированной терапии, а в исследовании SOLO терапия с использованием FPV/r 1 раз в день продемонстрировала такую же эффективность, как и комбинированная терапия с приемом нелфинавира 2 раза в сутки. При этом фосампренавир превосходил нелфинавир по показателям достижения целевых уровней у пациентов, имеющих исходно высокие уровни вирусной нагрузки, а также по достижению устойчивого вирусологического ответа и приверженности пациентов к терапии.
 Одним из исследований эффективности и безопасности приема комбинации фосампренавира (телзир) с ритонавиром (FPV/r) в сравнении с комбинацией лопинавир/ритонавир (LPV/r) явилось исследование KLEAN, которое проводили в течение 48 (n = 878), 96 (n = 679) и 144 (п = 199) нед. Сравнительное исследование KLEAN показало, что эффективность телзира 700 мг в сочетании с ритонавиром 100 мг 2 раза в день сопоставима с эффективностью комбинации LPV/r при применении совместно с абакавиром/ламивудином (АВС/ЗТС) в стандартных дозировках в течение 48 нед. у пациентов, ранее не получавших ВААРТ [22]. Данные, полученные в контрольной точке через 48 нед., продемонстрировали сходную эффективность двух схем терапии: 73% пациентов, получавших FPV/r, и 71% пациентов, получавших LPV/r, достигли показателя концентрации РНК ВИЧ < 400 копий/мл. Продолжение исследования KLEAN – наблюдательное исследование длительностью 96 нед., данные которого позволяют оценить долгосрочные результаты применения FPV/r у пациентов, ранее не получавших ВААРТ [23, 24]. Так, к 96-й неделе терапии целевого уровня < 400 копий/мл достигли 93% пациентов в группе, получавшей FPV/r, и 87% пациентов из группы, получавшей LPV/r. Целевого уровня < 50 копий/мл к 96-й неделе на фоне терапии препаратом FPV/r достигли 85% пациентов, а в группе, получавшей LPV/r – 75% пациентов. Средний уровень CD4+-лимфоцитов продолжал повышаться после 48 нед. лечения, и к 96-й неделе терапии прирост составил 292 клетки/мм3 в группе пациентов, получавших FPV/r, и 286 клеток/мм3 в группе получавших LPV/r [25]. Оба режима лечения хорошо переносились пациентами, при этом отмечено незначительное число случаев прекращения терапии из-за развития побочных эффектов: 2% в группе пациентов, получавших FPV/r, и 3% в группе пациентов, получавших LPV/r. Таким образом, комбинация FPV/r сохраняла клиническую эффективность, продемонстрированную к 48-й неделе терапии, в течение дальнейшего периода наблюдения продолжительностью 96 нед. [24].
Одним из исследований эффективности и безопасности приема комбинации фосампренавира (телзир) с ритонавиром (FPV/r) в сравнении с комбинацией лопинавир/ритонавир (LPV/r) явилось исследование KLEAN, которое проводили в течение 48 (n = 878), 96 (n = 679) и 144 (п = 199) нед. Сравнительное исследование KLEAN показало, что эффективность телзира 700 мг в сочетании с ритонавиром 100 мг 2 раза в день сопоставима с эффективностью комбинации LPV/r при применении совместно с абакавиром/ламивудином (АВС/ЗТС) в стандартных дозировках в течение 48 нед. у пациентов, ранее не получавших ВААРТ [22]. Данные, полученные в контрольной точке через 48 нед., продемонстрировали сходную эффективность двух схем терапии: 73% пациентов, получавших FPV/r, и 71% пациентов, получавших LPV/r, достигли показателя концентрации РНК ВИЧ < 400 копий/мл. Продолжение исследования KLEAN – наблюдательное исследование длительностью 96 нед., данные которого позволяют оценить долгосрочные результаты применения FPV/r у пациентов, ранее не получавших ВААРТ [23, 24]. Так, к 96-й неделе терапии целевого уровня < 400 копий/мл достигли 93% пациентов в группе, получавшей FPV/r, и 87% пациентов из группы, получавшей LPV/r. Целевого уровня < 50 копий/мл к 96-й неделе на фоне терапии препаратом FPV/r достигли 85% пациентов, а в группе, получавшей LPV/r – 75% пациентов. Средний уровень CD4+-лимфоцитов продолжал повышаться после 48 нед. лечения, и к 96-й неделе терапии прирост составил 292 клетки/мм3 в группе пациентов, получавших FPV/r, и 286 клеток/мм3 в группе получавших LPV/r [25]. Оба режима лечения хорошо переносились пациентами, при этом отмечено незначительное число случаев прекращения терапии из-за развития побочных эффектов: 2% в группе пациентов, получавших FPV/r, и 3% в группе пациентов, получавших LPV/r. Таким образом, комбинация FPV/r сохраняла клиническую эффективность, продемонстрированную к 48-й неделе терапии, в течение дальнейшего периода наблюдения продолжительностью 96 нед. [24].
Продолжение наблюдения за участниками исследования KLEAN до 144 нед. позволило оценить эффективность поддержания целевых уровней РНК ВИЧ < 50 копий/мл и < 400 копий/мл у ВИЧ-инфицированных пациентов на фоне терапии FPV/r или LPV/r в сочетании с ABC/3TC в фиксированной комбинации доз [26]. По итогам 144 нед. терапии результаты проведенного исследования показали, что целевого уровня РНК ВИЧ < 50 копий/мл достигли 73% пациентов, принимавших FPV/r, по сравнению с 60% пациентов, принимавших LPV/r, а уровня < 400 копий/мл – 83 и 70% пациентов соответственно. В обеих исследуемых группах наблюдалось улучшение иммунологических показателей, а также увеличение количества CD4+-лимфоцитов по сравнению с исходным уровнем за 144-недельный период исследования. В целом данные расширенного исследования KLEAN (от 48 до 144 нед.) подтвердили мощный и устойчивый антиретровирусный эффект при использовании фосампренавира в составе комбинированной терапии, независимо от исходного уровня вирусной нагрузки, а также хорошую переносимость и безопасность препарата для пациентов [26, 27].
Одним из последних исследований эффективности и безопасности использования фосампренавира в комплексной терапии ВИЧ-инфицированных пациентов в долгосрочной перспективе является исследование APV30005 [28]. Это многоцентровое, неконтролируемое открытое исследование применения фосампренавира в составе комбинированной терапии у ВИЧ-инфицированных пациентов в возрасте от 13 лет и старше, которые принимали участие в предыдущих исследованиях применения фосампренавира и ампренавира. Исследуемые схемы включали FPV/r 1400/200 мг 1 раз в день, FPV/r в дозе 700/100 мг 2 раза в день или фосампренавир 1400 мг 2 раза в день. Это исследование является на сегодняшний день самым длительным, в него были включены 753 пациента. Большинство из них получали терапию фосампренавиром свыше 192 нед., а 53 пациента получали этот препарат в составе комбинированной антиретровирусной терапии более 8 лет. Оценку эффективности (уровень РНК ВИЧ и CD4+-лимфоцитов), а также возникновения побочных эффектов проводили каждые 12 нед. Кроме того, проводилась оценка прогрессирования ВИЧ-инфекции. Согласно полученным данным, пациенты достигли целевого уровня РНК ВИЧ < 50 копий/мл во всех исследуемых группах, лучшие показатели наблюдались в группе ВИЧ-инфицированных без предшествующего опыта терапии. Также на протяжении всего исследования у пациентов повышалось количество CD4+-лимфоцитов. Побочные эффекты 2–4-ой степени тяжести, связанные с назначенной терапией, были отмечены у 250 (33%) пациентов, при этом большинство из них проявлялось в первые 48 нед. терапии. После 48 нед. терапии более чем у 70% пациентов сохранялся уровень РНК ВИЧ < 50 копий/мл. [28, 29]. Таким образом, длившееся 8 лет исследование результатов использования фосампренавира в комбинированной терапии больных ВИЧ-инфицией не выявило новых проблем, связанных с безопасностью и переносимостью препарата, при этом продемонстрировало сохранение устойчивого вирусологического ответа на протяжении длительного времени.
Представляют интерес результаты рандомизированного открытого многоцентрового исследования ALERT, в котором проводилось сравнение эффективности и безопасности использования двух представителей группы ИП – фосампренавира (FPV) и атазанавира (ATV), имеющих сходные фармакокинетические параметры, позволяющие назначать терапию с использованием каждого из них 1 раз в день в сочетании с ритонавиром на фоне терапии тенофовиром/эмтрицитабином (TDF/FTC) [30–32]. Основной контрольной точкой в исследовании являлось достижение целевых уровней РНК ВИЧ < 50 копий/мл после 48 нед., а также проводилась дополнительная оценка достижения целевого уровня после 24 нед. терапии. Оценивали также изменения исходного уровня CD4+-лимфоцитов, возникновение резистентности за весь период исследования и частоту возникновения побочных эффектов. Результаты исследования продемонстрировали сопоставимую эффективность терапии в достижении целевых уровней РНК ВИЧ и повышении уровня CD4+-лимфоцитов у пациентов, получавших как FPV/r, так и ATV/r после 48 нед. терапии. Сопоставимыми оказались и изменения липидных профилей на фоне приема исследуемых ИП: оба препарата показали незначительное увеличение показателей липопротеинов низкой плотности, общего холестерина и триглицеридов, ни один из которых не превысил верхних границ нормы. Возникающие побочные эффекты в обеих исследуемых группах преимущественно относились к 1–2-й степени тяжести согласно классификации тяжести побочных эффектов. Наиболее часто встречающимися побочными эффектами в группе пациентов, получающих FPV/r, были диарея (53%) и тошнота (13%); в группе пациентов, получающих ATV/r, диарея и тошнота встречались реже (15 и 9% соответственно), однако значительно чаще встречались такие побочные эффекты, как гипербилирубинемия (43%) и желтуха (6%) [32]. Таким образом, побочные эффекты 2–4-ой степени тяжести, как показали результаты исследования, чаще возникали на фоне терапии ATV/r, чем FPV/r (57 против 15%), что в большей степени обусловлено отрицательным влиянием ATV на печень в отличие от фосампренавира, обладающего лучшим профилем безопасности.
Преимущества однократного приема FPV/r в дозе 1400/100 мг в сравнении с приемом FPV/r в дозе 700/100 мг 2 в сутки на фоне терапии АВС/3ТС оценивались в исследовании MERIT [33]. В этом открытом рандомизированном исследовании контрольной точкой являлось число пациентов, достигших уровня РНК ВИЧ < 400 копий/мл через 48 нед. терапии при однократным (n = 105) и при двукратном (n = 106) приеме FPV/r, а также проводилась оценка изменения уровня холестерина липопротеидов невысокой плотности (non-HDL cholesterol) и наличия побочных эффектов [34].
В проведенном исследовании были получены сопоставимые результаты эффективности терапии у пациентов, получающих FPV/r 1 раз в сутки, и у пациентов, получающих его 2 раза в сутки: 98% пациентов в каждой подгруппе достигли целевого уровня РНК ВИЧ < 400 копий/ мл через 48 нед. терапии. Изменение количества холестерина липопротеидов невысокой плотности от исходного уровня составило +1,10 ммоль/л на фоне приема FPV/r 1 раз в сутки и +1,26 ммоль/л – на фоне двукратного приема, что само по себе не имеет достаточной клинической значимости. Согласно полученным данным, на фоне сравниваемых режимов терапии выявлялись сходные побочные эффекты, однако побочные эффекты, относящиеся ко 2–5-й степени тяжести, наблюдались у 26% пациентов, принимающих FPV/r 1 раз в сутки и у 36% пациентов на фоне приема препарата 2 раза в сутки. В частности диарея, связанная с приемом терапии, возникала на фоне однократного приема FPV/r менее чем у 1% пациентов, на фоне двукратного приема – у 12% [33].
С учетом распространенности гепатита С у ВИЧ-инфицированных пациентов важными являются результаты исследования, в котором изучали влияние FPV/r на функции печени у пациентов с сочетанной инфекцией ВИЧ/гепатит С [35]. В исследуемой группе (n = 636) у 54% пациентов были обнаружены HCV-антитела и 5,6% пациентов являлись носителями HBsAg. Всем им была назначена терапия FPV/r в дозе 700/100 2 раза в день. За время исследования только у 0,47% пациентов наблюдался рост уровня АЛТ более чем в 3 раза. В целом же частота возникновения нарушений функций печени у пациентов, получающих FPV/r в составе комбинированной терапии, является низкой, в том числе у пациентов с наличием ко-инфекции ВИЧ/гепатит С и с выраженной степенью фиброза или цирроза печени [35].
Исходя из приведенных данных, фосампренавир (телзир) рекомендован и успешно используется в качестве начальной терапии у пациентов, до этого лечения не получавших, а также перспективен в отношении долгосрочной эффективности терапии ВИЧ-инфицированных пациентов. Таким образом, использование FPV/r в составе комбинированной терапии показывает хорошую противовирусную эффективность и переносимость как при лечении пациентов с ВИЧ-инфекцией, ранее не получавших антиретровирусной терапии, так и у пациентов на поздних стадиях заболевания. Препарат демонстрирует хороший профиль безопасности, особенно при режиме применения 1 раз в сутки, мало влияет на липидную картину крови и не оказывает отрицательного влияния на функции печени даже при наличии гепатита С у ВИЧ-инфицированных пациентов. Сравнительные данные ряда исследований убедительно демонстрируют долгосрочную эффективность использования фосампренавира (телзира) в составе комбинированной терапии вне зависимости от исходного уровня РНК ВИЧ, достижение устойчивого вирусологического ответа и повышение приверженности пациентов к ВААРТ.


