В России с каждым годом увеличивается число больных ВИЧ-инфекцией, нуждающихся в лечении. По данным Федерального научно-методического Центра по профилактике и борьбе со СПИДом, число ВИЧ-инфицированных, зарегистрированных на территории России на 31.10.2012, составляло 703 781 человека, из них 6 193 ребенка [1]. Ситуация имеет стойкую тенденцию к ухудшению, распространенность ВИЧ-инфекции увеличивается. Правильно подобранная антиретровирусная терапия (АРВТ) продлевает жизнь ВИЧ-инфицированным, повышает ее качество и снижает риск передачи вируса другим людям [2].
В последовательности назначения схем АРВТ выделяют схемы первого, второго и последующих рядов (линий) и схемы резерва (схемы спасения). Схемы первого ряда – это терапия, проводимая пациенту, ранее не получавшему противовирусных препаратов, или у которого она не менялась по причине неэффективности. Под схемами второго ряда подразумевают режимы АРВТ, которые применяют в случае неэффективности терапевтических схем первого ряда. Схемы резерва (спасения) – нестандартные схемы, применяемые при неэффективности схем второго и последующих рядов, включающие препараты разных групп, подбираемые индивидуально, исходя из анализа результатов исследования резистентности возбудителя и ранее проводимой терапии [3].
Наибольшие сложности сопряжены с подбором схем третьей и последующих линий терапии, что связано с ограничениями в выборе эффективных препаратов, обусловленными появлением частично устойчивых вирусных штаммов при длительной АРВТ и, зачастую, плохой переносимостью. Согласно российским протоколам ведения больных, рекомендуется оптимизация схемы АРВТ на основании результатов исследования резистентности и включение антиретровирусных препаратов (АРВП) новых классов [ингибиторы интегразы (ралтегравир), ингибиторы слияния (энфувиртид) и ингибиторы CCR5-рецепторов (маравирок)] или препаратов известных классов [ненуклеозидные ингибиторы обратной транскриптазы – ННИОТ (этравирин), ингибиторы протеазы – ИП (дарунавир)], имеющих другой спектр резистентности [3, 4]. Каждый из перечисленных препаратов имеет ряд особенностей, обусловленных принадлежностью к определенному классу АРВП, механизмом противоретровирусной активности, формой выпуска, профилем безопасности, резистентности и т. д. Однако во всех зарубежных клинических руководствах (EACS 2012, IAS-USA 2012, DHSS 2012, BHIVA 2012, WHOER 2012) [2, 5–8], так же как и в российских, применение полностью активного препарата нового класса (маравирок, ралтегравир, энфувиртид) или препарата известного класса с другим профилем резистентности (дарунавир, этравирин) рекомендовано и является оптимальным подходом к терапии пациентов с неэффективностью предшествующих режимов АРВТ, обусловленной развитием резистентности ВИЧ к АРВП.
Экономическую целесообразность применения новых препаратов для лечения больных ВИЧ-инфекцией с опытом терапии изучали в ряде зарубежных исследований [9–14], но в основном отдельно для каждого препарата в комбинации с оптимизированной базовой терапией (ОБТ) по сравнению только с ОБТ (без сравнения различных препаратов между собой). Есть также 2 исследования, посвященных оценке затратной эффективности маравирока, ралтегравира и этравирина, одно выполнено с позиции здравоохранения Франции, другое – США [15, 16]. В России подобных исследований не проводили.
Отсутствие данных об оценке клинико-экономической целесообразности применения маравирока по сравнению с препаратами других классов у пациентов с опытом АРВТ ВИЧ-инфекции в условиях российского здравоохранения послужило предпосылкой для проведения настоящего исследования.
Цель исследования – клинико-экономическая оценка эффективности применения маравирока по сравнению с ралтегравиром, дарунавиром, энфувиртидом и этравирином в составе резервных схем терапии ВИЧ-инфекции у пациентов, ранее получавших АРВТ.
Задачи:
- Проанализировать результаты клинических исследований эффективности и безопасности сравниваемых препаратов у больных ВИЧ-инфекцией.
- Осуществить непрямое сравнение эффективности и безопасности маравирока и других препаратов в составе резервных схем терапии у пациентов с ВИЧ-инфекцией, ранее получавших АРВТ.
- Определить методы клинико-экономического анализа, построить модель для его проведения.
- Рассчитать клинико-экономические показатели и оценить целесообразность применения маравирока в целевой популяции пациентов в сравнении с препаратами других классов.
Гипотезы исследования:
- При сопоставимой эффективности и меньшей стоимости маравирок обладает клинико-экономическими преимуществами перед ралтегравиром, дарунавиром и энфувиртидом у пациентов с опытом терапии ВИЧ-инфекции.
- Применение маравирока является более эффективным, хотя и более дорогим вариантом лечения по сравнению с этравирином, что требует в дальнейшем проведения анализа «затраты–эффективность» в рамках отдельной работы.
Клинико-экономический анализ проводили на основе допущения, что все препараты могут применяться в одинаковой популяции пациентов. Маравирок показан только для пациентов, инфицированных ВИЧ-1 с тропизмом к CCR5 ко-рецептору. Соответственно фактически в настоящем исследовании анализируется стратегия выбора варианта лечения для пациентов, инфицированных ВИЧ-1 с тропизмом к CCR5 ко-рецептору, при котором можно применять как маравирок, так и любой другой исследуемый препарат.
Методы исследования
Нами проведено непрямое сравнение эффективности и безопасности альтернативных препаратов на основе результатов отдельных рандомизированных контролируемых испытаний (РКИ), в которых маравирок, ралтегравир и этравирин сравнивали с плацебо, а дарунавир и энфувиртид – с их отсутствием (ОБТ применяли как в исследуемых группах больных, так и в контроле). Непосредственно для непрямого сравнения использовали методику, предложенную H.С.Bucher и соавт. [17], подробно описанную в статье С.В. Горяйнова и соавт. [18]. Доказательствами для непрямого сравнения послужили результаты РКИ перечисленных препаратов, найденные в базе данных Medline при помощи ключевых слов, операторов булевой логики и параметра поиска, отбиравшего только публикации с заданным типом (РКИ). Среди соответствующих критериям отбора публикаций отбирали только исследования, в которых имелась общая контрольная группа, позволявшая использовать их для построения сети доказательств для непрямого сравнения, а также выполненные в принципиально схожих популяциях пациентов, что необходимо для соблюдения допущения транзитивности, определяющего достоверность непрямого сравнения [18, 19]. Достоверность результатов РКИ [20–25] оценивали на основании определения в них вероятности систематических и случайных ошибок. Дополнительно были проанализированы результаты длительного наблюдения за пациентами, получавшими исследуемые препараты [26–30].
В проведенном нами непрямом сравнении не было выявлено статистически значимых различий в эффективности маравирока, ралтегравира, дарунавира и энфувиртида в составе резервных схем АРВТ, однако маравирок превосходил этравирин как по частоте достижения неопределяемого уровня РНК ВИЧ, так и по изменению уровня CD4+ Т-лимфоцитов. Для клинико-экономического анализа был выбран метод «минимизации затрат», при котором непосредственно сравнивали затраты на применение альтернативных препаратов в течение 48 и 96 нед. Сравнение маравирока с этравирином с учетом полученных в непрямом сравнении данных о большей эффективности первого требовало применения метода «затраты–эффективность» с расчетом показателя приращения затрат, но из-за различий в характеристиках препаратов и временных ограничений в рамках данного анализа такого сравнения не проводили.
Затраты рассчитаны в модели-калькуляторе, построенной на базе программного обеспечения Microsoft Excel, на основании зарегистрированных предельных отпускных цен производителей на препараты из перечня жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) и нормативов финансовых затрат в системе здравоохранения РФ. Для маравирока, не включенного, но претендующего на включение в перечень, использована цена компании-производителя, по которой он будет регистрироваться в случае включения в перечень. Учитывались затраты на сравниваемые АРВП (маравирок, ралтегравир, дарунавир, энфувиртид), усредненную ОБТ (схемы с препаратами из групп НИОТ и ИП), диспансерное наблюдение больных ВИЧ-инфекцией. Затраты на проведение теста на тропизм ВИЧ перед назначением маравирока включены в цену препарата.
Затраты на ОБТ рассчитывались как средняя стоимость двух препаратов из группы НИОТ и препарата из группы ИП, усиленного ритонавиром, в течение 48 и 96 нед. терапии*. Цены на препараты, входящие в схему ОБТ, определены по данным предельных отпускных цен АРВП из перечня ЖНВЛП. Цена на тенофовир, который не имеет зарегистрированной цены в перечне ЖНВЛП и не закупается в рамках приоритетного национального проекта, определена по данным тендерных закупок препарата (http://zakupki.gov.ru) учреждениями здравоохранения РФ в 2012 г.
Кратность и вид лабораторных обследований и посещений специалистов при диспансерном наблюдении ВИЧ-инфицированных определены по рекомендациям Федерального научно-методического Центра по профилактике и борьбе со СПИДом и Национального научного общества инфекционистов [3, 4]. В качестве источника информации о ценах на услуги, входящие в диспансерное наблюдение, использовали нормативы финансирования с соответствующими поправочными коэффициентами по профилю специалиста на посещение амбулаторно-поликлинических учреждений (включая проведение плановых лабораторных тестов) по «Территориальной программе государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи в городе Москве на 2012 год» [31].
Дополнительно анализировали влияние на бюджет системы здравоохранения включения маравирока в стандарт первичной медико-санитарной помощи при болезни, вызванной ВИЧ, в раздел «Прочие противовирусные препараты» (группа препаратов J05AX, длительность лечения – 365 дней) наравне с другими препаратами новых классов (ралтегравир, энфувиртид) [32].
Нами было рассчитано, как меняются расходы федерального бюджета при включении маравирока с частотой предоставления 2% (0,02) в этот раздел и соответствующем уменьшении долей уже включенных в него препаратов (ралтегравира и энфувиртида) с 7 до 5%. Поскольку распределение частоты применения ралтегравира и энфувиртида не указано, было принято допущение об их назначении в равных долях.
На завершающем этапе исследования был выполнен анализ чувствительности, демонстрирующий, как изменятся результаты при изменении цен на лекарственные препараты. Поскольку маравирок на данный момент не включен в перечень ЖНВЛП, а остальные препараты сравнения включены и закупаются в рамках реализации приоритетного национального проекта в сфере здравоохранения, мы рассчитали альтернативные результаты по реальным ценам аукционов (http://zakupki.gov.ru) по закупке АРВП. Для маравирока, не закупаемого в рамках национального проекта, использована средняя цена тендерных закупок препарата учреждениями здравоохранения в 2012 г. из базы данных по торгам «Курсор» (www.cursor-is.ru).
Результаты и обсуждение
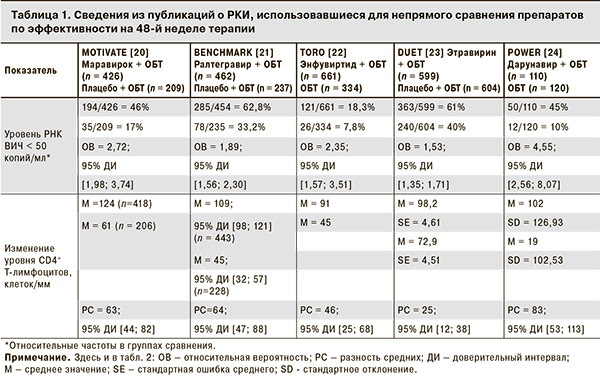
В результате систематического поиска научной информации по проблеме было найдено 226 публикаций, из которых были отобраны статьи с результатами РКИ исследуемых препаратов. Для каждого препарата имелось два идентичных РКИ, отличавшихся только странами, в которых они были проведены. Результаты обоих РКИ были опубликованы вместе, поэтому суммарно для обзора использовано 6 публикаций [20–25], включая результаты оценки безопасности энфувиртида, описанные в отдельной публикации:
- маравирок – РКИ MOTIVATE 1 и 2 [20];
- ралтегравир – РКИ BENCHMARK 1 и 2 [21];
- энфувиртид – РКИ TORO 1 и 2 [22, 25];
- этравирин – РКИ DUET 1 и 2 [23];
- дарунавир – РКИ POWER 1 и 2 [24].
При проведении непрямого сравнения нами было принято допущение, что контрольные группы ОБТ с плацебо либо без него можно использовать в качестве общего контроля.
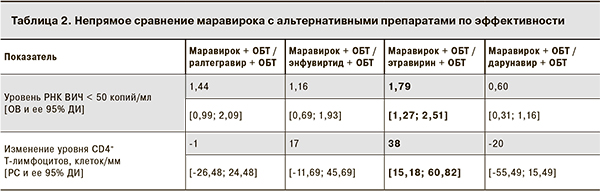
Результаты РКИ, использовавшиеся для расчетов при непрямом сравнении препаратов по эффективности (анализ по назначенному лечению), приведены в табл. 1, результаты проведенного нами непрямого сравнения препаратов по эффективности на 48-й неделе терапии – в табл. 2.
При непрямом сравнении маравирока с ралтегравиром не было получено статистически значимых различий по частоте достижения неопределяемого уровня РНК ВИЧ в крови и изменению уровня CD4+ Т-лимфоцитов, хотя по показателю достижения неопределяемой вирусной нагрузки нижняя граница 95% ДИ близка к 1, следовательно, можно говорить о статистической тенденции большей эффективности маравирока по сравнению с ралтегравиром. Также не было получено статистически значимых различий по этим показателям при сравнении маравирока и энфувиртида (95% ДИ для ОВ и РС включают 1 и 0 соответственно). При применении маравирока была получена статистически значимая большая частота достижения неопределяемого уровня РНК ВИЧ и большее изменение уровня CD4+ Т-лимфоцитов по сравнению с этравирином. При сравнении маравирока и дарунавира не было получено статистически значимых различий ни по одному из этих показателей.
Провести полноценное непрямое сравнение безопасности исследуемых препаратов оказалось невозможно из-за различия в публикациях формы представления информации о нежелательных явлениях (НЯ). Во всех статьях единообразно были даны только сведения о частоте любого НЯ, что является не вполне информативным показателем.
Наибольшую значимость с точки зрения как клиники, так и экономики имеют НЯ средней и тяжелой степени, требующие дополнительного лечения, а также НЯ, требующие смены АРВТ. Различий в частоте таких средних и тяжелых НЯ, как диарея, тошнота, усталость, повышение АСТ или АЛТ более чем в 5 раз по отношению к верхней границе нормы между маравироком и ралтегравиром, а также между маравироком и этравирином не было выявлено. Головная боль средней тяжести и тяжелая статистически значимо реже встречалась при применении маравирока, чем при применении ралтегравира (ОВ = 0,18; 95% ДИ [0,04; 0,82]). Различий между маравироком и этравирином по этому показателю не выявлено. Частота отмены терапии в связи с НЯ не различается при сравнении маравирока с остальными четырьмя препаратами. Что касается энфувиртида, при его применении наблюдается высокая частота местных реакций (в месте инъекции) [24, 25], которых нет при применении маравирока – таблетированного препарата с пероральным приемом.
Опубликованные результаты долговременного наблюдения за пациентами, участвовавшими в РКИ BENCHMARK [28], POWER [29] и DUET [30] также подтвердили сохранение устойчивого вирусологического ответа у большинства пациентов в течение 96 нед. и отсутствие новых данных о безопасности.
Таким образом, при анализе безопасности маравирока, ралтегравира и дарунавира не было выявлено каких-либо существенных различий между препаратами, которые могли бы повлиять на затраты. Различие с энфувиртидом, обусловленное инъекционной формой последнего, если и могло повлиять на затраты, то только в пользу маравирока. Различия в безопасности этравирина и маравирока нуждаются в более детальном анализе, однако исходя из имеющихся данных, нет оснований полагать, что у этравирина есть преимущества перед маравироком, которые могли бы повлиять на затраты.
Ожидаемые средние затраты на терапию одного больного ВИЧ-инфекцией с применением маравирока, ралтегравира, дарунавира и энфувиртида в составе резервных схем АРВТ в течение 48 и 96 нед. представлены в табл. 3.
Как видно из табл. 3, затраты на применение маравирока в составе резервных схем АРВТ ниже, чем на другие препараты. В результате применение схемы маравирок + OБТ по сравнению со схемами ралтегравир + ОБТ, дарунавир/ритонавир + ОБТ и энфувиртид + ОБТ экономит в среднем на одного пациента соответственно 177 764,16, 59 929,92 и 462 295,92 руб. за 48 нед. терапии и 340 714,64, 114 865,68 и 886 067,18 руб. – за 96 нед.
Расчет изменения стоимости стандарта первичной медико-санитарной помощи при ВИЧ-инфекции в действующей редакции и при включении маравирока с частотой назначения 2% в раздел 3 стандарта представлен в табл. 4.
Включение в стандарт маравирока с частотой предоставления 2% позволит уменьшить расходы на применение «прочих противовирусных препаратов» на 6 933,98 руб. в среднем на одного больного в год.
Согласно данным формы мониторинга приоритетного национального проекта «Здоровье» [33], число больных ВИЧ-инфекцией, получавших АРВТ, в Российской Федерации (по данным на 31.10.2012 г.) составило 116 572 человека. Включение в стандарт маравирока с частотой назначения 2% позволит сэкономить 808 307 916,56 руб. из средств федерального бюджета, выделяемых на закупку АРВП [34].
Анализ чувствительности результатов исследования к колебанию цен на лекарственные препараты для больных ВИЧ-инфекцией с опытом АРВТ показал, что при использовании для маравирока цен тендерных закупок учреждениями здравоохранения, а для сравниваемых препаратов – цен, определенных по данным закупок в рамках приоритетного национального проекта, маравирок останется наиболее выгодной альтернативой. Применение схемы маравирок + OБТ по сравнению со схемами ралтегравир + ОБТ, дарунавир/ритонавир + ОБТ и энфувиртид + ОБТ экономит в среднем на одного пациента соответственно 47 049,84, 4 096,44 и 451 963,44 руб. за 48 нед. терапии и 90 178,86, 7851,51 и 866 263,26 руб. – за 96 нед.
Результаты проведенного исследования свидетельствуют о целесообразности применения у больных ВИЧ-инфекцией в Российской Федерации маравирока в составе резервных схем АРВТ как не менее эффективной, безопасной и более экономичной альтернативы по сравнению с ралтегравиром, энфувиртидом и дарунавиром.
Наше исследование, как и любое другое, характеризуется рядом ограничений, обусловленных, главным образом, недостатком или неоднозначностью информации.
Его результаты показали, что маравирок в составе резервных схем АРВТ превосходит этравирин по частоте достижения неопределяемого уровня РНК ВИЧ в крови и не отличается по этому показателю от энфувиртида и дарунавира. При сравнении с ралтегравиром был получен пограничный уровень статистической значимости, что, вероятно, связано с присущим непрямому сравнению дефицитом статистической чувствительности и, следовательно, более широкими ДИ, чем в прямых сравнительных РКИ. Принимая во внимание этот факт, а также значение точечной оценки данного сравнения, нельзя исключить превосходство маравирока над ралтегравиром по частоте достижения неопределяемого уровня вирусной нагрузки.
Ценность результатов непрямого сравнения ограничена рядом объективных факторов. Главное ограничение связано с тем, что популяции пациентов в РКИ различных препаратов не являются одинаковыми: в клинических испытаниях маравирока участвовали пациенты исключительно с R5-штаммом ВИЧ-1, являющимся субпопуляцией всех резистентных пациентов в целом, участвовавших в РКИ других препаратов. Кроме того, выступавшая в роли общего контроля ОБТ также не была одинаковой: она подбиралась индивидуально и имела свои особенности в каждом исследовании. Например, в РКИ маравирока MOTIVATE часть больных получала энфувиртид, что ограничивает возможности непрямого сравнения маравирока и энфувиртида. В РКИ этравирина DUET в составе ОБТ из ИП использовали только дарунавир с ритонавиром, тогда как в РКИ MOTIVATE, напротив, дарунавир не применяли. Наконец, на результаты непрямого сравнения могли оказать влияние возможные систематические ошибки в использовавшихся для этого РКИ. Однако в отсутствие прямых сравнительных исследований непрямое сравнение является единственным возможным способом сравнения вмешательств.
Обобщение результатов РКИ рассмотренных нами препаратов выполняли и другие авторы. Так, в 2011 г. были опубликованы результаты мета-анализа РКИ [35] новых препаратов для лечения больных ВИЧ-инфекцией с опытом терапии, который включал и все проанализированные нами РКИ. Целью мета-анализа была оценка эффективности новых препаратов в целом, а не в сравнении друг с другом, при этом он имел те же ограничения, что и непрямое сравнение, что отмечено авторами.
Различия в схемах ОБТ в разных РКИ затрудняют и проведение фармакоэкономического анализа. Из-за существенных вариаций в схемах ОБТ у пациентов с опытом терапии при проведении фармакоэкономических расчетов может учитываться стоимость усредненной ОБТ [13]. Подходы к определению усредненной ОБТ различны. Мы использовали схему, включающую 2 препарата из группы НИОТ и один ИП, усиленный ритонавиром, что соответствует рекомендациям [2]. Согласно рекомендациям ВОЗ для Европейского региона, после неудачи схем первой линии в рамках общественного здравоохранения для схем второй линии предпочтительно резервировать ИП. Оптимальным решением является применение усиленного ритонавиром ИП, дополненного двумя НИОТ. Еще одно важное, на наш взгляд, ограничение присутствует в расчетах экономии при введении в стандарт маравирока за счет уменьшения доли ралтегравира и энфувиртида. Поскольку распределение частоты применения ралтегравира и энфувиртида не указано, было принято допущение об их назначении в равных долях, что может не соответствовать реальной клинической практике, однако принимая во внимание отсутствие необходимых данных в стандарте и тот факт, что оба препарата дороже маравирока, экономия будет присутствовать в любом случае.
Ряд ограничений был связан также с объективными особенностями финансирования отечественного здравоохранения и ценообразования на медицинские услуги. Так, в связи с отсутствием в доступных источниках сведений о ценах на тесты для определения резистентности к АРВП, мы вынуждены были использовать минимальные показатели себестоимости обследования, такие как непосредственная стоимость тест-системы, не учитывая ни затраты на работу медперсонала, ни накладные расходы. Данное ограничение приводит к недооценке влияния выполнения данного диагностического обследования на общие затраты, однако, на наш взгляд, не должно существенно изменить выявленные закономерности. Согласно принятым методам оплаты за оказание медицинской помощи, расходы на этот тест должны входить в норматив финансирования за посещение (инфекциониста), и мы выделили его как отдельный элемент затрат только из-за достаточно высокой цены, которая важна с позиции не столько системы здравоохранения, сколько отдельного медицинского учреждения.
До недавнего времени фармакоэкономический анализ новых препаратов для лечения больных ВИЧ-инфекцией с опытом терапии проводили для каждого препарата в комбинации с ОБТ в составе резервных схем АРВТ отдельно по сравнению только с ОБТ, что методически много проще. Однако в последнее время появились исследования, посвященные сравнению разных препаратов (маравирок, ралтегравир и этравирин) [15, 16]. Они характеризуются теми же ограничениями, что и наше исследование, однако в отсутствие более достоверных данных их можно рассматривать как источник полезных сведений, позволяющих делать более обоснованный выбор между альтернативными вариантами терапии. Следует отметить, что и в зарубежных исследованиях, где сравнивали результаты применения нескольких препаратов у пациентов с опытом АРВТ, маравирок был расценен как затратно-эффективная альтернатива в сравнении с ралтегравиром и этравирином [16].
Выводы
- В проведенном нами непрямом сравнении эффективность схем резерва АРВТ, включающих маравирок, статистически значимо не отличалась от эффективности схем, включающих ралтегравир, энфувиртид и дарунавир, ни по изменению уровня CD4+ Т-лимфоцитов, ни по частоте достижения неопределяемого уровня вирусной нагрузки, однако превосходила по этим показателям схемы, включающие этравирин.
- Схемы АРВТ, содержащие маравирок, статистически значимо не отличаются от схем, содержащих дарунавир, по риску основных НЯ и риску повышения АЛТ и АСТ более чем в 5 раз от верхней границы нормы. Выявлена меньшая частота головной боли средней и тяжелой степени при применении маравирока по сравнению с ралтегравиром. Энфувиртид характеризуется значительной частотой реакций в месте инъекции, которых нет на маравироке – таблетированном препарате с пероральным приемом. Статистически значимых различий в частоте других НЯ при сравнении переносимости маравирока и энфувиртида не выявлено.
- Затраты на применение схем резерва АРВТ, включающих маравирок, у CCR5-тропных пациентов с опытом терапии ниже, чем на применение схем, включающих ралтегравир, дарунавир и энфувиртид, что в сочетании с сопоставимой эффективностью и высокой безопасностью позволяет считать применение маравирока более экономически целесообразным.
- При использовании цен тендерных закупок маравирока учреждениями здравоохранения и цен сравниваемых препаратов, определенных по данным закупок в рамках приоритетного национального проекта, маравирок будет оставаться экономически выгодной альтернативой по сравнению с ралтегравиром, дарунавиром и энфувиртидом.
- Результаты проведенного непрямого сравнения показали большую эффективность схем резерва, содержащих маравирок, для достижения неопределяемого уровня вирусной нагрузки и изменения уровня CD4+ Т-лимфоцитов по сравнению со схемами, содержащими этравирин. Однако маравирок является более дорогостоящим препаратом, чем этравирин, что требует для сравнения этих двух препаратов проведения в дальнейшем анализа «затраты–эффективность».
- Включение маравирока в стандарт первичной медико-санитарной помощи при ВИЧ-инфекции с частотой предоставления 2% позволит сократить средства федерального бюджета, выделяемые на закупку АРВП, на применение «прочих противовирусных препаратов» (J05AX) в среднем на 6 933,98 руб. на одного больного в год, что, с учетом количества ВИЧ-инфицированных, получающих АРВТ (116 572 пациента), составит 808 307 916,56 руб.