Инфекция, вызванная вирусом гепатита С (HCV) — одна из главных причин хронических заболеваний печени во всем мире [1]. Клинические проявления HCV-инфекции многообразны и могут варьировать в зависимости от степени фиброза, наличия цирроза печени и гепатоцеллюлярной карциномы. Число хронически инфицированных людей во всем мире превышает 200 млн, но большинство из них не имеют никакого представления о своем заболевании. Предполагают, что хроническая HCV-инфекция более чем в 40% случаев приводит к формированию цирроза печени, смертность от осложнений которого составляет около 4% в год. Частота возникновения гепатоцеллюлярной карциномы среди этих пациентов ежегодно достигает 5% с вероятностью смерти в течение первого года у 33%. Необходимо обратить внимание, что в Европе HCV-инфекция занимает первое место среди причин первичного рака печени [2].
В 2011 г. группой экспертов EASL были обновлены клинические рекомендации по ведению пациентов с HCV-инфекцией [3]. Согласно руководству EASL, терапия первой линии при хронической HCV-инфекции — это комбинация пегелированного интерферона-альфа-2а (ПегИФН-α-2а) или 2b (ПегИФН-α-2b), вводимых подкожно 1 раз в неделю, с ежедневным пероральным приемом рибавирина.
 К сожалению, по данным многих исследователей, и эта терапия не гарантирует стопроцентного избавления от вируса. Однако определенные надежды в клиницистов вселяют результаты исследований III фазы трехкомпонентной терапии с ингибиторами протеазы NS3 телапревиром [4—6] или боцепревиром [7, 8]. Но при этом нельзя забывать о повышении интенсивности и увеличении частоты побочных эффектов при проведении трехкомпонентной терапии.
К сожалению, по данным многих исследователей, и эта терапия не гарантирует стопроцентного избавления от вируса. Однако определенные надежды в клиницистов вселяют результаты исследований III фазы трехкомпонентной терапии с ингибиторами протеазы NS3 телапревиром [4—6] или боцепревиром [7, 8]. Но при этом нельзя забывать о повышении интенсивности и увеличении частоты побочных эффектов при проведении трехкомпонентной терапии.
Целью нашей работы явился анализ результатов противовирусной терапии 55 больных хроническим гепатитом С (ХГС), которые получали лечение согласно рекомендациям EASL.
Материалы и методы
Под нашим наблюдением находились 55 больных ХГС в возрасте от 21 года до 63 лет, которые наблюдались и получали противовирусное лечение в Центре по профилактике и борьбе со СПИДом и инфекционными заболеваниями Министерства здравоохранения Кабардино-Балкарской Республики. Из них у 11 больных был диагностирован цирроз печени вирусной этиологии С, класс А по Чайлду-Пью. Среди больных было 26 женщин и 29 мужчин. Средний возраст больных без цирроза печени составил 35 ± 1,2 года, с циррозом печени — 46 ± 2,5 года (табл. 1). Средняя длительность заболевания с момента регистрации у 44 больных без цирроза печени составила 7,2 ± 2,3 года. Всем пациентам на базе клинико-диагностической лаборатории проводили стандартные исследования: УЗИ органов брюшной полости с эластографией печени; биохимические (АЛТ, АСТ, ГГТ, коагулограмма, протеинограмма) и клинические (лейкоциты, лимфоциты, тромбоциты) исследования крови. Проводили также исследования на маркеры HCV методами иммуноферментного анализа (ИФА) и полимеразной цепной реакции (ПЦР). В сыворотке крови больных методом ИФА определяли антитела к антигенам HCV (анти-HCV) с помощью наборов производства НПО «Диагностические системы» (Н. Новгород). В плазме крови с антикоагулянтом ЭДТА методом ПЦР определяли вирусную нагрузку и генотипы HCV с помощью отечественных наборов производства ООО «ИнтерЛабСервис» (Москва). В качестве противовирусной терапии 45 больных получали ПегИФН-α-2в в дозе 1,5 мкг/кг в неделю, 10 больных — ПегИФН-α-2а в дозе 180 мкг в неделю в сочетании с рибаверином (15 мг/кг) ежедневно. Эффективность терапии учитывали по определению быстрого вирусологического ответа (БВО), раннего вирусологического ответа (РВО), на 24-й неделе терапии, по окончании терапии и через 24 нед. после ее окончания. Длительность терапии, согласно рекомендациям EASL, устанавливалась от 16 до 72 нед.
По уровню биохимической активности больные распределились следующим образом: нормальные показатели АлАТ были у 47% больных ХГС и у 40% больных циррозом печени, уровень АлАТ от 2 до 4 норм — соответственно у 47 и 60% больных, более 4 норм — только у 6% больных ХГС. По данным эластографии, из 44 больных ХГС показатели на уровне F0—F1 наблюдались у 38%, F2 — у 19% и F3 — у 43%. Высокая (> 600 000 МЕ/мл) вирусная нагрузка определялась у 22 больных ХГС и у 5 больных циррозом печени (табл.1).
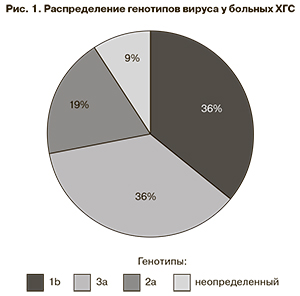
При анализе генотипов НVС были получены следующие данные. У больных ХГС чаще встречались генотипы 1b (у 36%) и 3а (у 36%), генотип 2а был определен у 19% и у 9% генотип не определялся (рис. 1). У больных циррозом печени преобладал генотип 3а (8 человек), генотип 1b был выявлен у 3 пациентов.
Результаты и обсуждение
При анализе проведенной противовирусной терапии в зависимости от генотипа вируса и степени фиброза у больных ХГС были получены следующие данные. БВО был получен только y 38% больных с генотипом 1b, отсроченный вирусологический ответ — у 29%, РВО — у 69%; на 24-й неделе терапии и сразу после ее окончания РНК НСV не определялась ни у одного пациента. Несмотря на это устойчивый вирусологический ответ (УВО) был достигнут только у 40% больных с генотипом 1b (рис. 2).
Анализ эффективности противовирусной терапии у пациентов с генотипом 1b в зависимости от степени фиброза печени показал, что среди больных фиброзом F0—F1 УВО был достигнут у 50%, тогда как у пациентов с фиброзом F2—F3 — уже только у 25%.
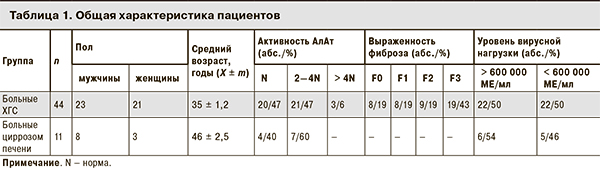
У большинства больных с генотипами 3а и 2а наблюдался БВО (рис. 2). УВО в этих группах пациентов был достигнут у 80% пролеченных. В группе пациентов с неустановленным генотипом УВО определялся в 60% случаев.
В группе больных без цирроза печени вне зависимости от генотипа вируса УВО был получен в 68% случаев, тогда как в группе больных с циррозом печени — в 54,5%. Довольно высокий процент УВО у больных с циррозом печени связан, по-видимому, с преобладанием в этой группе больных с генотипом 3а. У 3 пациентов с циррозом печени и генотипом 1b УВО не был достигнут.
УВО был получен у 56% больных с исходно высокой вирусной нагрузкой и у 73% больных с исходно низкой вирусной нагрузкой.
 Следует отметить, что большинство больных ХГС терапию переносили удовлетворительно. У многих больных были отмечены умеренной выраженности гриппоподобный и астено-вегетативный синдромы. Из наиболее частых побочных эффектов противовирусного лечения следует отметить зуд и экзантему у 23,6% пациентов, а также разной степени выраженности гематологические проблемы, развившиеся на 9—12-й неделе терапии у 74,5% пациентов. Пяти больным с гематологическими побочными эффектами пришлось снижать дозировку противовирусных препаратов в связи с нейтропенией до уровня ≤ 750/мм3, тромбоцитопенией — до уровня ≤ 50 000/мм3 и снижением гемоглобина в рамках ≤ 85— ≥ 100 г/л. 1 больному с заместительной целью проводили переливание тромбоцитарной массы. Досрочно терапию прервали 7 больных: двое — из-за выраженной депрессии, у 1 пациентки на 32-й неделе лечения развился ишемический инсульт, двое пациентов с генотипом 1b были признаны «не ответчиками» на лечение (не было получено заметного снижения вирусной нагрузки на 12-й неделе терапии или РНК НVC определялась на 24-й неделе терапии), 1 пациентка прекратила терапию в результате декомпенсации хронической рецидивирующей крапивницы и отека Квинке и у 1 больного развился острый орхит.
Следует отметить, что большинство больных ХГС терапию переносили удовлетворительно. У многих больных были отмечены умеренной выраженности гриппоподобный и астено-вегетативный синдромы. Из наиболее частых побочных эффектов противовирусного лечения следует отметить зуд и экзантему у 23,6% пациентов, а также разной степени выраженности гематологические проблемы, развившиеся на 9—12-й неделе терапии у 74,5% пациентов. Пяти больным с гематологическими побочными эффектами пришлось снижать дозировку противовирусных препаратов в связи с нейтропенией до уровня ≤ 750/мм3, тромбоцитопенией — до уровня ≤ 50 000/мм3 и снижением гемоглобина в рамках ≤ 85— ≥ 100 г/л. 1 больному с заместительной целью проводили переливание тромбоцитарной массы. Досрочно терапию прервали 7 больных: двое — из-за выраженной депрессии, у 1 пациентки на 32-й неделе лечения развился ишемический инсульт, двое пациентов с генотипом 1b были признаны «не ответчиками» на лечение (не было получено заметного снижения вирусной нагрузки на 12-й неделе терапии или РНК НVC определялась на 24-й неделе терапии), 1 пациентка прекратила терапию в результате декомпенсации хронической рецидивирующей крапивницы и отека Квинке и у 1 больного развился острый орхит.
Таким образом, полученные нами данные коррелируют с данными литературы [9, 10]. При этом необходимо еще раз констатировать недостаточную эффективность противовирусной терапии у больных ХГС с генотипом 1b и четкую связь малой эффективности терапии с выраженной стадией фиброза печени.
Выводы
- Достижение УВО зависело от генотипа вируса, стадии фиброза, наличия цирроза печени и исходного уровня вирусной нагрузки. УВО чаще достигался в группах больных с генотипами 2а и 3а, с меньшей стадией фиброза и изначально низкой вирусной нагрузкой.
- Из побочных эффектов мы чаще наблюдали гриппоподобный и астено-вегетативный синдромы, а также изменения в крови (лейкопения, анемия, тромбоцитопения).
- Большинство больных переносили терапию удовлетворительно. У 7 (12,7%) больных противовирусную терапию пришлось прервать по той или иной причине.


