В настоящее время в мире более 200 млн человек инфицированы вирусом гепатита С (НСV), при этом до 5 млн из них проживают в России [1]. Развитие хронической формы у подавляющего большинства (около 85%) заболевших гепатитом С с последующим вероятным переходом в цирроз и первичный рак печени определяет ситуацию, при которой вирусное поражение печени так широко распространено в нашей стране [1].
«Золотым стандартом» противовирусной терапии (ПВТ) при хронической HCV-инфекции является применение пегилированного интерферона-α (ПегИНФ-α) в сочетании с рабавирином [2]. Анализ данных клинических исследований показал, что при генотипах 2 и 3 HCV назначение ПегИНФ-α и рибавирина приводит к формированию стойкого вирусологического ответа (СВО) у 62–81%, в то время как при генотипе 1 HCV – только у 35–42% [3].
НСV поражает не только клетки печени, но и непосредственно лейкоциты, что приводит к постепенному снижению их уровня в периферической крови. Одним из наиболее распространенных нежелательных явлений при проведении ПВТ является лейко/нейтропения, которая может быть одной из причин снижения дозы ПегИНФ-α во время ПВТ [2, 3]. В течение первых 2 нед ПВТ у половины больных регистрируется снижение количества нейтрофилов [4, 5]. Как известно, основным фактором в патогенезе нейтропении у больных ХГС является миелосупресивное действие ИФН-α, вследствие чего угнетается гранулоцитопоэз и снижается количество нейтрофильных лейкоцитов в периферическом кровяном русле. Некоторые исследователи указывают на то, что снижение дозы ПегИНФ-α может оказаться неблагоприятным с точки зрения частоты формирования СВО, в то же время существуют исследования в которых показано отсутствие достоверного изменения частоты СВО при применении гранулоцитарных факторов роста (ГКСФ) [6, 7].
Таким образом, высокая частота лейко- и нейтропении как до начала так и на фоне комбинированной ПВТ у больных ХГС требует дальнейшего изучения.
В последнее время для предупреждения развития миелотоксического эффекта при химиотерапии онкологических заболеваний применяется отечественный препарат дикарбамин. Он защищает гемопоэтические клетки от миелосупрессорного действия, ускоряет созревание и дифференцировку нейтрофильных лейкоцитов, предотвращает явления апоптоза.
Цель исследования – изучить влияние дикарбамина на эффективность ПВТ у больных ХГС с генотипом 1b HCV и исходно сниженным количеством лейкоцитов и нейтрофилов.
Материалы и методы
Под наблюдением находились 86 пациентов с ХГС (анти HCV «+», РНК HCV «+», генотип 1b) в возрасте от 20 до 52 лет (средний возраст 32 ± 1,2 года). Среди них было 46 (53,5%) мужчин и 40 (46,5%) женщин.
Все пациенты были разделены на 2 группы, сопоставимые по полу и возрасту, в зависимости от схемы лечения: 1-я группа (n = 44) получала ПегИНФ-α-2b + рибавирин, 2-я группа (n = 42) – ПегИНФ-α-2b + рибавирин + дикарбамин. ПегИНФ-α-2b назначали подкожно в дозе 100 мкг 1 раз в неделю, рибавирин – 1000 мг в сутки ежедневно курсом 48 нед. В соответствии с рандомизацией (проводилась с применением «метода конвертов») дикарбамин назначали по 100 мг 1 раз в день курсом 9 нед от началаПВТ, затем за 9 нед перед её окончанием.
Эффективность лечения оценивали по СВО на 24-й неделе наблюдения после завершения ПВТ. Изучение уровня лейкоцитов и нейтрофилов в крови проводили до лечения и на этапах контроля ПВТ (4, 8, 12, 24, 36, 48 нед). Достоверных межгрупповых различий зарегистрировано не было. Перед началом проведения двойной ПВТ у всех больных отмечались лабораторные признаки лейко- и нейтропении (содержание лейкоцитов в общем анализе крови 3,5–3,0 х 109/л, нейтрофилов – 2,0–1,5 х 109/л). Проведенное исследование было одобрено этическим комитетом, все пациенты давали информированное согласие на участие в исследовании.
Статистическую обработка и графическую визуализацию данных производили в соответствии с технологией современного компьютерного анализа на IBM-совместимом персональном компьютере с использованием приложений Microsoft Excel пакета Office 2007 и Statistica (StatSoft) версии 6.0, функционировавших в операционной среде Microsoft Windows 7 Professional.
Результаты обсуждение
В табл. 1 представлена характеристика участвовавших в исследовании пациентов до начала ПВТ.
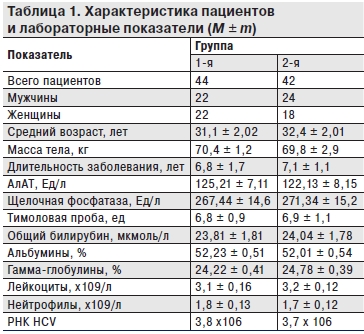
У больных ХГС зарегистрированы следующие основные синдромы: у 98 % – астеновегетативный (повышенная утомляемость, раздражительность, расстройство сна, снижение работоспособности и общая слабость, недомогание, неустойчивость настроения, головная боль), у 90,9% – диспепсический (снижение аппетита, неприятные ощущения в животе, тошнота, метеоризм, отрыжка, у отдельных больных – рвота). У 81% отмечалась тяжесть и/или боль в эпигастрии и/или в правом подреберье (синдром «правого подреберья»), имевшая преимущественно тупой, ноющий характер. Гепатомегалия регистрировалась у 81% пациентов, увеличение печени сопровождалось уплотнением её консистенции и умеренной болезненностью при пальпации. Эти ведущие синдромы у большинства (88,2%) пациентов регистрировались одновременно. Частота встречаемости основных клинических синдромов в разных группах больных представлена в табл. 2. До начала терапии достоверных различий между показателями больных 1-й и 2-й группы зарегистрировано не было.
При оценке динамики содержания лейкоцитов и нейтрофилов в крови у больных ХГС на фоне ПВТ без учета варианта лечения установлено, что доля лиц с I степенью лейко- и нейтропении перед началом лечения составляла 83,7%. По мере продолжения ПВТ увеличивалось число пациентов, у которых уровень лейкоцитов и нейтрофилов снижался в зависимости от выбранной тактики лечения (табл. 3). Сравнивая разные схемы терапии, мы установили, что в 1-й группе происходило достоверно более выраженное снижение исследуемых показателей по сравнению со 2-й группой, в которой больные получал дикарбамин. Так, в 1-й группе в минимальное содержание лейкоцитов составило (2,1 ± 0,16) х 109/л, нейтрофилов – (1,0 ± 0,03) х 109/л, тогда как во 2-й группе – (3,4 ± 0,11) х 109/л и (1,9 ± 0,05) х 109/л соответственно (р < 0,05).
* Достоверность различий между показателями 1-й и 2-й группы (р < 0,05).
Анализ эффективности ПВТ (табл. 4) показал достоверно лучшие результаты лечения у пациентов 2-й группы по сравнению с 1-й (p < 0,05).
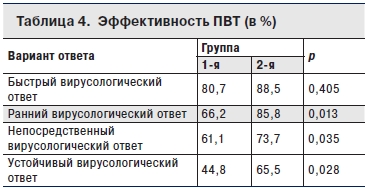
Таким образом, можно предположить возможность потенцирования противовирусного эффекта препаратом дикарбамин при назначении его в комбинации с ПВТ. Это эмерджентное свойство препарата было зарегистрировано при изучении отдаленных результатов проведенного лечения (достижение СВО).
Сравнительная характеристика основных биохимических показателей в 2 группах больных ХГС до ПВТ и через 24 нед после ее окончания представлена в табл. 5.
* Достоверность различий между показателями 1-й и 2-й группы (р < 0,05).
Как видно из табл. 5, показатели цитолиза и холестаза достоверно улучшались у пациентов 2-й группы через 24 нед после проведенной терапии. У пациентов 1-й группы на фоне развившихся лейко- и нейтропении мы вынужденно снижали дозу противовирусного препарата у 13,6%, а в отдельных случаях (у 6,8%) прекращали ПВТ. Эти вынужденные меры обусловливали вирусологический прорыв и в дальнейшем приводили к повышению биохимической активности печеночных трансаминаз. Применение дикарбамина у пациентов 2-й группы показало достоверно значимый лучший отдаленный результат восстановления метаболических показателей печени.
Таким образом, назначение дикарбамина в комплексе с двойной ПВТ является перспективным направлением в лечении HCV-инфекции.
Выводы
1. Назначение дикарбамина в комбинации с ПегИНФ-α-2b и рибавирином у больных ХГС, инфицированных HCV генотипа 1b, с лейко- и нейтропенией на старте терапии позволяет проводить лечение без снижения дозы и отмены ПегИНФ-α-2b, так как при этом не происходит критического снижения уровня лейкоцитов и нейтрофилов на фоне лечения.
2. Включение дикарбамина в комбинированную ПВТ привело к повышению частоты СВО у больных ХГС, что повысило эффективность лечения на 20,7%.


