Инфекция, вызванная вирусом гепатита С (HCV), остается глобальной проблемой здравоохранения. По последним оценкам Всемирной организации здравоохранения (WHO, 2012), HCV инфицированы 3% населения или 170 млн человек. Около 150 млн человек больны хроническим гепатитом С (ХГС), и 350 000 человек ежегодно умирают от заболеваний печени, вызванных HCV, в том числе от декомпенсированного цирроза печени или гепатоцеллюлярной карциномы (ГЦК).
Расчетная распространенность HCV-инфекции у взрослых в России составляет 2,0–2,5% [1]. При обследовании 562 больных ХГС было установлено, что чаще всего встречается HCV генотипа 1, доля которого составляет 55,7% в структуре всех случаев HCV-инфекции [2]. Распространенность HCV-инфекции в последние годы постоянно увеличивалась. По данным Минздрава России, заболеваемость ХГС с 1994 по 1999 г. возросла в 6 раз. В 1999 г. распространенность HCV-инфекции составила 19,31 на 100 тыс. населения, а в 2009 г. она повысилась бoлее чем вдвое – до 40,79 на 100 тыс. населения [1].
Смертность от цирроза печени в России резко увеличилась за последние три десятилетия. Например, стандартизированная по возрасту смертность от этого заболевания на 100 тыс. пациенто-лет в возрасте 20–64 года возросла с 1983–1985 гг. по 1993–1995 гг. на 87,3% (с 7,4 до 13,9) и с 1993–1995 гг. по 2000–2002 гг. еще на 32,1% (до 18,3) [3]. Эти показатели значительно выше, чем в западноевропейских странах. При изучении причин резкого снижения ожидаемой продолжительности жизни в России в 90-е гг. было установлено, что в 2,4% случаев оно было связано с хроническими заболеваниями печени и циррозом [4].
Учитывая большое число инфицированных пациентов и вероятное увеличение распространенности хронической HCV-инфекции в будущем, на протяжении следующих нескольких десятилетий в России можно ожидать постоянного роста заболеваемости, смертности и затрат, связанных с HCV-ассоциированными заболеваниями. Однако эту тенденцию можно изменить, если больные ХГС будут обеспечены противовирусными препаратами.
В России имеется большое число больных с установленным диагнозом ХГС, однако частота противовирусной терапии относительно низкая по сравнению с другими европейскими странами. Например, в России доля больных, получавших лечение по поводу хронической HCV-инфекции, составила менее 1%, а во Франции – 16% [5]. Низкая частота противовирусной терапии обусловлена различными причинами. Главные среди них – низкая доступность противовирусных препаратов для пациентов и ограниченная эффективность терапии пегилированным интерфероном (ПегИФН) и рибавирином (РБВ) у больных ХГС, вызванным HCV генотипа 1.
Благодаря более высокой эффективности и возможности сокращения длительности противовирусной терапии применение боцепревира и телапревира изменило парадигму лечения хронической HCV-инфекции, вызванной вирусом генотипа 1 [6]. Например, общая частота устойчивого вирусологического ответа (УВО) у первичных больных ХГС с HCV генотипа 1 после присоединения боцепревира к терапии ПегИФН и РБВ увеличилась с 38 до 66% [7].
Появление новых мощных противовирусных препаратов может привести к увеличению доли больных, получающих противовирусную терапию. Однако присоединение телапревира или боцепревира к стандартным препаратам сопровождается ростом затрат на лечение. В связи с этим необходимо взвешивать благоприятные эффекты новых противовирусных средств, увеличение затрат на противовирусную терапию, частоту возможных нежелательных явлений. Эффективность затрат на противовирусную терапию ХГС в России не изучалась. Мы использовали российские данные, результаты клинических исследований и данные литературы для разработки математической модели лечения HCV-инфекции, прогрессирования болезни, мониторирования ее течения и выживаемости больных с целью оценки затрат и выживаемости с поправкой на качество жизни в когорте больных ХГС, получающих только стандартные противовирусные препараты или боцепревир в комбинации со стандартной терапией.
Методы
Описание модели
Мы использовали марковскую модель, чтобы рассчитать пожизненные затраты и QALY для терапии ПегИФН и РБВ и стратегии лечения, предполагающей назначение боцепревира в соответствии с российской инструкцией по его применению. Модель включала клинические, эпидемиологические, экономические данные и данные о качестве жизни, которые использовали для оценки влияния терапии на пожизненную частоту развития печеночных осложнений HCV-инфекции. Структура модели соответствует описанным ранее моделям анализа эффективности затрат при HCV-инфекции [8–12] и включает в себя 2 фазы: фазу лечения и фазу естественного течения HCV-инфекции. При изучении всех состояний учитывали риск смерти в общей популяции.
1-я фаза модели имитирует противовирусную терапию, включая 24-недельный период наблюдения. Во время каждого недельного цикла пациент может прекратить лечение по медицинским или немедицинским причинам, в том числе в связи с отсутствием вирусологического ответа. В конце фазы лечения у пациента достигается УВО или он возвращается в исходное состояние здоровья, связанное с HCV-инфекцией.
2-я фаза модели имитирует естественное течение ХГС и позволяет предсказать пожизненную частоту развития серьезных печеночных исходов (декомпенсированного цирроза печени, ГКЦ), смерти от заболевания печени и трансплантации печени. В случае успешного лечения у пациента достигается УВО. Предполагается, что УВО у больных без цирроза печени указывает на выздоровление. Заболевание печени в этом случае не прогрессирует, а риск развития тяжелых печеночных осложнений отсутствует. У больных с циррозом, достигших УВО, выздоровление считают частичным. В этом случае заболевание печени может прогрессировать, но значительно медленнее, чем при отсутствии УВО. Если УВО не достигнут, пациент возвращается в исходное состояние здоровья; у таких больных могут развиться печеночные осложнения и может потребоваться трансплантация печени. У пациентов, не ответивших на лечение, заболевание прогрессирует с той же скоростью, что и у больных, не получавших противовирусной терапии.
Тяжесть хронической HCV-инфекции оценивали на основании степени фиброза по классификации METAVIR: отсутствие фиброза (F0), портальный фиброз без септ (F1), портальный фиброз с отдельными септами (F2), многочисленные септы без цирроза (F3), компенсированный цирроз (F4). У пациентов, переходящих в состояние компенсированного цирроза, могут развиться его последствия – декомпенсированный цирроз и ГЦК. Модель прогрессирующего течения болезни предполагает, что болезнь печени у пациента с определенным индексом фиброза может перейти в более тяжелую стадию или состояние его здоровья останется прежним. При неэффективности противовирусной терапии переход к менее тяжелому состоянию здоровья не допускается.
Учитывая тяжесть болезни печени у больных декомпенсированным циррозом и/или ГЦК, им может потребоваться трансплантация печени. У пациентов с декомпенсированным циррозом, ГЦК и больных, перенесших трансплантацию печени, принимали во внимание дополнительный риск смерти. Учитывая разницу смертности, затрат и качества жизни в течение первого года и последующих лет при этих состояниях здоровья, их анализировали отдельно: декомпенсированный цирроз (1-й год) и декомпенсированный цирроз (последующие годы), ГЦК (1-й год) и ГЦК (последующие годы), трансплантация печени и после трансплантации печени. Состояние здоровья «трансплантация печени» продолжается 1 год. Если пациент жив в конце 1-го года, то он переходит в состояние «после трансплантации печени». Предполагается, что у больных, перенесших трансплантацию печени, отсутствует риск реактивации вирусной инфекции и развития заболевания печени.
Схемы противовирусной терапии
Модель имитирует схемы лечения в российской инструкции по применению боцепревира (рис. 1, см. на вклейке) и стандартную схему двойной противовирусной терапии у больных, инфицированных HCV генотипа 1. Схема лечения боцепревиром зависит от того, получал пациент противовирусную терапию ранее или нет, а также от наличия цирроза печени. Боцепревир во всех случаях назначают после 4-недельной вводной терапии ПэгИФН и РБВ. Модель включала следующие стратегии противовирусной терапии с боцепревиром:
1.Первичные пациенты без цирроза: если через 8 нед не определяется РНК HCV, а вирусологический ответ сохраняется через 12 и 24 нед, то лечение прекращается через 28 нед. Если РНК HCV определяется через 8 нед, но не определяется через 24 нед терапии, то пациент продолжает лечение тремя противовирусными препаратами до 36-й недели, а затем получает ПэгИФН и РБВ еще в течение 12 нед.
2.Пациенты без цирроза, не ответившие на предыдущую терапию: при наличии вирусологического ответа через 12 и 24 нед лечение всеми тремя препаратами продолжают до 36-й недели, а затем применяют ПэгИФН и РБВ в течение еще 12 нед.
3.Пациенты с циррозом или нулевым ответом на предыдущую терапию: при наличии вирусологического ответа через 12 и 24 нед лечение всем тремя препаратами продолжают до 48-й недели.
Схемой сравнения у всех больных считается рекомендованная ранее терапия двумя противовирусными препаратами:
4.Лечение ПегИФН-α-2b и РБВ в течение 48 нед (ПР48).
Решение о прекращении тройной и двойной противовирусной терапии принимают на основании вирусологического ответа через 12 и 24 нед. Всем больным, у которых концентрация РНК HCV превышает 100 МЕ/мл через 12 нед или определяется РНК HCV через 24 нед, рекомендуется прекратить противовирусную терапию.
Показатели модели
Модель включает исходную характеристику пациентов, а также показатели лечения, клинические показатели, затраты и показатели полезности, связанные с противовирусной терапией и состояниями здоровья при HCV-инфекции. В табл. 1 приведены все показатели, которые использовали в основном сценарии и при анализе чувствительности.
Для описания когорты больных и противовирусной терапии использовали данные исследований SPRINT-2 и RESPOND-2, а также результаты опросов экспертов-гепатологов. Опросы проводили в 2 этапа. На 1-м этапе оценивали эпидемиологию HCV-инфекции и типичную практику ее лечения, а также частоту госпитализаций и медикаментозной терапии. На 2-м этапе анализировали лечение больных с далеко зашедшими заболеваниями печени в обычной практике и в специализированных лечебных учреждениях. Для этого опрашивали гепатологов, работающих в лечебных учреждениях 3 уровней (поликлиники, городские больницы и ведущие региональные центры) в 5 регионах России (Самара, Тольятти, Ульяновск, Владивосток и Сыктывкар). Клинические характеристики HCV-инфекции и показатели полезности каждого состояния здоровья были взяты из опубликованных исследований.
Характеристика больных
Особенности пациентов оказывают влияние на выбор схемы лечения боцепревиром, эффективность противовирусной терапии и ежегодную смертность. В модели каждую схему противовирусной терапии анализировали в 20 когортах больных, инфицированных HCV генотипа 1. Когорты были выделены на основании всех возможных комбинаций предыдущего опыта противовирусной терапии, пола и исходного индекса фиброза по классификации METAVIR. Средний возраст и пол первичных больных соответствовали таковым в когорте исследования SPRINT-2, а средний возраст и пол больных, не ответивших на предыдущую терапию – в когорте исследования RESPOND-2. Предполагали, что в России все пациенты были нечернокожими. По исходному индексу фиброза METAVIR пациенты были распределены на основании опроса экспертов.
Показатели, связанные с лечением
Модель включала досрочное прекращение противовирусной терапии в связи с отсутствием вирусологического ответа (в соответствии с заранее определенными критериями), прекращение лечения по медицинским или немедицинским причинам, частоту УВО, частоту и длительность анемии. Показатели лечения у первичных больных и больных, не ответивших на предыдущую терапию, оценивали на основании анализа post hoc исследований SPRINT-2 и RESPOND-2 соответственно.
Для моделирования лечения боцепревиром при отсутствии цирроза (исходный индекс фиброза F0–F3) использовали данные больных, которым проводили тройную противовирусную терапию с учетом вирусологического ответа в указанных выше исследованиях. Для моделирования противовирусной терапии при циррозе печени (исходный индекс фиброза F4) использовали данные больных, которым проводилась фиксированная по длительности тройная терапия. Характеристики двойной противовирусной терапии были получены при анализе контрольных групп в исследованиях SPRINT-2 и RESPOND-2.
Анализ post hoc отличался от первичного анализа. Во-первых, пациенты, у которых не определяли исходный индекс METAVIR, были исключены из анализа post hoc. Во-вторых, в инструкцию включены 2 правила прекращения терапии. В каждом клиническом исследовании было предусмотрено одно правило прекращения терапии – через 12 нед у первичных больных и через 24 нед у больных, не ответивших на предыдущую терапию. Чтобы имитировать ситуацию в клинических исследованиях в случае использования правил, указанных в инструкции, мы предполагали, что при отсутствии вирусологического ответа пациенты немедленно прекращают противовирусную терапию.
Пациентов, у которых не было оснований для прекращения лечения через 12 нед в соответствии с инструкцией и не проводился анализ РНК HCV через 24 нед, мы считали завершившими полный курс противовирусной терапии, но не достигшими УВО. Если у пациентов, достигших вирусологического ответа через 12 нед, определялась виремия через 24 нед, мы считали, что они прекращают терапию через 24 нед.
Дополнительное правило прекращения терапии, указанное в инструкции, оказывало влияние на частоту досрочного прекращения терапии, анемии и УВО. Кроме того, отличалась длительность терапии боцепревиром у первичных больных без цирроза печени, у которых определялась РНК HCV через 8 нед и отсутствовали указанные в инструкции основания для прекращения терапии через 12 и 24 нед. В клиническом исследовании у таких больных боцепревир применяли в течение 24 нед, а в инструкции рекомендуется продолжать лечение этим препаратом в течение 32 нед. Мы предположили, что дополнительный прием боцепревира в течение 8 нед не повлияет на частоту исходов, таких как УВО, но увеличит стоимость лечения.
Клинические показатели
Клинические показатели, отражающие скорость прогрессирования HCV-инфекции, вероятность выполнения трансплантации печени и смертность от заболевания печени, были определены на основании тщательного анализа данных литературы. Для оценки общей смертности с поправкой на возраст и пол использовали российские таблицы вероятности дожития.
Скорость прогрессирования определяли на основании данных Н. Thein и соавт. [13], которые недавно опубликовали результаты систематизированного обзора и мета-анализа 111 исследований у пациентов с хронической HCV-инфекцией. Авторы привели показатели скорости прогрессирования для каждой стадии фиброза по классификации METAVIR, которую использовали в клинических исследованиях боцепревира. Они вносили поправку на системные ошибки, связанные с дизайном исследования и отбором больных [14]. Скорость развития декомпенсированного цирроза и ГЦК оценивали на основании исследования G. Fattovich и соавт. [15], которые изучали естественное течение болезни в когорте из 384 больных циррозом печени, и исследования R. Planas и соавт. [16], которые наблюдали 200 больных декомпенсированным циррозом. Ежегодную вероятность трансплантации печени у больных декомпенсированным циррозом или ГЦК определяли на основании формы № 12 статистической отчетности учреждений здравоохранения в 2011 г.
Затраты
Затраты оценивали с позиции плательщика в ценах 2013 г. Общие затраты, связанные с HCV-инфекцией, рассчитывали на основании затрат на противовирусную терапию; затрат, связанных с каждым состоянием здоровья; затрат на трансплантацию печени и на время пребывания в каждом состоянии здоровья. Затраты на противовирусную терапию рассчитывали на основании стоимости противовирусных препаратов и мониторирования больных во время терапии. Затраты на лечение анемии в модели считали равными 0, так как модель предполагает оценку затрат с позиции плательщика. В клинических исследованиях для лечения анемии использовали эритропоэтин. В модель были включены затраты на противовирусные препараты для всех сравниваемых стратегий терапии. Ежедневные затраты на ПегИФН-α-2b и РБВ и мониторирование основывались на информации о средних дозах, установленных при опросе экспертов-гепатологов. Затраты на лечение ПегИФН рассчитывали на основании средневзвешенной рыночной доли пегасиса и пегинтрона, которая составляет 48 и 52% соответственно. Затраты на лечение больных ХГС (индексы фиброза F0–F3) рассчитывали на основании длительности госпитализации таких больных (форма № 14 статистической отчетности учреждений здравоохранения в 2011 г.) [17]. Затраты на лечение больных компенсированным циррозом или далеко зашедшим заболеванием печени (декомпенсированным циррозом и/или ГЦК) оценивали на основании данных, полученных при опросе гепатологов (этапы 1 и 2), а также длительности госпитализации больных фиброзом (форма № 14 статистической отчетности учреждений здравоохранения в 2011 г.) [18]. Информация об общих затратах на трансплантацию печени в России отсутствует. При анализе мы использовали затраты на хирургическое вмешательство в рамках высокотехнологичной медицинской помощи в трансплантологии [19] и затраты на медикаментозное обеспечение больных, перенесших трансплантацию [20]. Данные о среднем числе лекарственных назначений в год и средней стоимости одного назначения были взяты из отчета Росздравнадзора [20].
Будущие затраты дисконтировали на 5%.
Показатели качества жизни, связанного со здоровьем
Показатели полезности лечения и каждого состояния здоровья при HCV-инфекции и осложнениях ХГС были определены на основании обзора литературы. Эти показатели использовали, чтобы учесть негативное влияние противовирусной терапии, хронической HCV-инфекции и осложнений ХГС на качество жизни. Учитывали влияние терапии ПегИФН и РБВ на качество жизни. Противовирусная терапия этими препаратами сопровождалась утомляемостью, гриппоподобными симптомами, анемией, зудом, депрессией и нарушением качества сна [21]. Негативное влияние лечения на качество жизни пациентов без анемии рассчитывали путем сравнения качества жизни больных, получавших двойную комбинированную терапию или не получавших лечения, с помощью опросника EuroQol Index (EQ-5D); среднее значение коэффициента для лечения составило 0,85 [22]. Негативное влияние лечения на качество жизни пациентов с анемией оценивали путем сравнения качества жизни больных с анемией и без нее также с помощью опросника EQ-5D; расчетное значение коэффициента составило 0,83 [23]. Полезность состояний здоровья, связанных с хронической HCV-инфекцией и тяжелым заболеванием печени, оценивали на основании исследования, проведенного German Hepatitis C Model Group [10].
Показатели QALY дисконтировали на 3%.
Предельная эффективность затрат
В соответствии с рекомендациями Комиссии по макроэкономике и здравоохранению, выделяют 3 категории эффективности затрат на основании валового внутреннего продукта (ВВП): эффективность затрат высокая (менее ВВП на душу населения); затраты эффективные (в 1–3 раза выше ВВП на душу населения); затраты неэффективные (более чем в 3 раза выше ВВП на душу населения). ВВП на душу населения в России в 2011 г. составил примерно 381,775 руб. Соответственно затратно-эффективными следует считать стратегии лечения, характеризующиеся значением ICER менее 1 145 325 руб.
Валидация модели
Модель валидировали на основании оценки внешней, предсказательной и конвергентной валидности [24]. Внешнюю валидность модели определяли эксперты на основании предполагаемых характеристик HCV-инфекции и противовирусной терапии. Чтобы определить предсказательную валидность модели, сравнивали вероятность развития печеночных осложнений HCV-инфекции, которую рассчитывали с помощью модели или на основании опубликованных эпидемиологических данных. Мы также анализировали конвергентную валидность модели путем сравнения расчетной эффективности затрат на терапию ПегИФН и РБВ с соответствующими показателями в нескольких опубликованных исследованиях [10], предполагавших сходные допущения. Диапазон значений ICER, рассчитанных с помощью модели, перекрещивался со многими расчетными показателями в предыдущих исследованиях.
Анализ основного сценария
Моделирование проводили в каждой когорте больных определенного профиля. Мы рассчитывали пожизненную частоту развития осложнений болезни печени, дисконтированные затраты и дисконтированные QALY для каждой когорты. На основании распределения характеристик больных определяли взвешенные средние показатели. Результаты представлены отдельно для первичных больных и больных, не ответивших на предыдущую терапию, а также больных без цирроза и с циррозом. Приведены также общие результаты для первичных больных и больных, не ответивших на предыдущую терапию.
Анализ чувствительности
Мы провели односторонний анализ чувствительности для нескольких показателей, включая эффективность лечения, скорость прогрессирования, частоту развития серьезных осложнений заболевания печени, затраты при различных состояниях здоровья, показатели полезности и ставки дисконтирования. Влияние изменений этих показателей на ICER (боцепревир по сравнению с ПР48) оценивали отдельно у первичных больных и больных, не ответивших на предыдущую терапию, с помощью графиков торнадо.
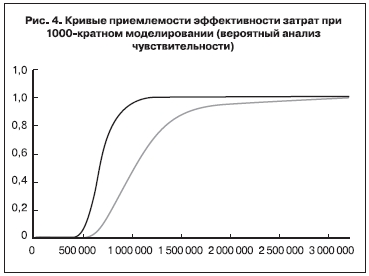
Кроме того, чтобы оценить влияние неопределенности расчетных показателей модели, мы провели вероятностный анализ чувствительности на основании 1000-кратного моделирования. Результаты представлены в виде кривых приемлемости эффективности затрат (CEAC) [25].
Результаты
Анализ основного сценария
С помощью модели рассчитывали пожизненный кумулятивный риск развития печеночных осложнений ХГС в зависимости от стратегии противовирусной терапии, рекомендуемой в инструкции по применению боцепревира, у первичных больных и больных, не ответивших на предыдущую терапию.
На рис. 2 показано предполагаемое число исходов на 10 000 больных, получавших лечение в каждой группе. Было показано, что у первичных больных лечение боцепревиром по сравнению с двойной терапией приведет к снижению кумулятивной частоты развития декомпенсированного цирроза на 31%, ГЦК – на 30%, трансплантации печени – на 30% и смертности от заболевания печени – на 29%. У пациентов, не ответивших на предыдущую противовирусную терапию, лечение боцепревиром по сравнению с двойной терапией приведет к снижению кумулятивной частоты декомпенсированного цирроза на 47%, ГЦК – на 52%, трансплантации печени – на 52% и смертности от заболевания печени – на 51%. Кроме того, лечение боцепревиром сопровождается увеличением ожидаемой продолжительности жизни по сравнению с ПР48 на 0,59 и 1,08 года соответственно.
Общие дисконтированные пожизненные затраты и дополнительные QALY при каждой стратегии терапии приведены в табл. 2. Хотя затраты на противовирусную терапию и мониторирование у первичных и не ответивших на предыдущую терапию больных при применении боцепревира были значительно выше (866 925 и 1 057 598 руб. соответственно), чем при ПР48 (299 604 и 195 227 руб. соответственно), тем не менее общие затраты на лечение HCV-инфекции и заболеваний печени, связанных с HCV, в группах больных, принимавших боцепревир, были на 32–52% ниже, чем в группе ПР48. ICER на противовирусную терапию с боцепревиром по сравнению с ПР48 составил 973762 руб./QALY у первичных больных и 650 288 руб./QALY у больных, не ответивших на предыдущую терапию.
Анализ чувствительности
Был проведен односторонний анализ чувствительности, чтобы оценить влияние изменений показателей скорости прогрессирования ХГС и развития печеночных осложнений, затрат, связанных с состояниями здоровья, и полезности на ICER (боцепревир по сравнению с ПР48). На рис. 3 представлены значения ICER в зависимости от 20 наиболее важных показателей.
Результаты вероятностного анализа чувствительности приведены в виде кривых приемлемости эффективности затрат (рис. 4). В качестве предельного значения эффективности дополнительных затрат использовали 1 145 325 руб./QALY. По сравнению с ПР48 противовирусная терапия с боцепревиром была затратно-эффективной у первичных больных и пациентов, не ответивших на предыдущую терапию, в 65,0 и 99,2% случаев соответственно.
Обсуждение
Исследования SPRINT-2 и RESPOND-2 показали, что присоединение боцепревира к ПегИФН-α-2b и РБВ приводит к значительному увеличению частоты УВО по сравнению с терапией только ПегИФН и РБВ у первичных взрослых больных, инфицированных HCV генотипа 1, и больных, не ответивших на предыдущую противовирусную терапию. Однако стоимость терапии с боцепревиром превышает стоимость применения только ПегИФН и РБВ. Учитывая ограниченные ресурсы, плательщики должны учитывать отдаленные эффекты терапии на клинические исходы заболевания и связанное с этим экономическое бремя. Результаты настоящего исследования свидетельствуют о том, что противовирусная терапия с боцепревиром, рекомендуемая в инструкции по медицинскому применению, может привести к значительному снижению риска развития печеночных осложнений и улучшению выживаемости первичных больных и больных, не ответивших на предыдущую терапию. По данным анализа эффективности затрат, повышенные затраты на терапию с боцепревиром были обоснованными. ICER на лечение боцепревиром по сравнению с двойной противовирусной терапией был ниже предельного значения (1 145 325 руб./QALY) как у первичных больных, так и больных, не ответивших на предыдущую противовирусную терапию.
Учитывая вариабельность оценочных показателей в опубликованной литературе и возможную вариабельность эффективности терапии, мы провели анализ чувствительности для большинства показателей модели – эффективности противовирусной терапии, скорости перехода из одного состояния в другое, затрат, связанных с состоянием здоровья, и качества жизни при определенных состояниях здоровья. Как у первичных больных, так и больных, не ответивших на предыдущую терапию, результаты анализа затрат, суммарной выгоды и затратной эффективности терапии варьировали в широких пределах в различных сценариях.
Коэффициенты эффективности дополнительных затрат, рассчитанные при одностороннем анализе чувствительности, в большинстве случаев свидетельствовали об эффективности затрат на терапию с боцепревиром по сравнению с ПР48 у первичных больных при предельном значении ICER 1 145325 руб./QALY. ICER превышал указанное предельное значение только при наличии следующих допущений: нижняя граница полезности УВО; состояние здоровья, связанное с F0; ставка дисконтирования затрат и полезности 5%; верхняя граница частоты УВО при лечении ПегИФН и РБВ и нижняя граница частоты УВО при противовирусной терапии с боцепревиром. Вариабельность расчетных показателей вероятности перехода из одного состояния здоровья в другое, УВО, затрат и полезности оценивали с помощью вероятностного анализа чувствительности. При 1000-кратном моделировании присоединение боцепревира к ПегИФН и РБВ было затратно-эффективным (предельное значение – 1 145 325 руб./QALY) в 65% случаев.
Коэффициенты эффективности дополнительных затрат, рассчитанные при одностороннем анализе чувствительности, во всех случаях указывали на эффективность затрат на применение боцепревира по сравнению с ПР48 у больных, не ответивших на предыдущую терапию, при предельном значении ICER 1 145 325 руб./QALY. По данным вероятностного анализа чувствительности, включавшего 1000-кратное моделирование, затраты на боцепревир в комбинации с ПегИФН и РБВ были эффективны в 99% случаев при предельном значении ICER 1 145 325 руб./QALY.
Результаты анализа чувствительности свидетельствуют о том, что затраты на противовирусную терапию с боцепревиром остаются эффективными при изменении показателей скорости прогрессирования заболевания, эффективности затрат и полезности в широком диапазоне.
По сравнению с описанными ранее моделями анализа эффективности затрат мы внесли некоторые изменения в структуру модели и вводимые показатели. Мы пересмотрели показатели вероятности прогрессирования ХГС, развития серьезного заболевания печени, трансплантации печени и затраты, связанные с состоянием здоровья, на основании данных, которые ранее отсутствовали. Во-вторых, в отличие от большинства предыдущих исследований, мы включили в модель лечение больных циррозом печени. Мы предположили, что у таких пациентов излечение от HCV-инфекции будет частичным даже при наличии УВО. Это означает, что у больных циррозом, достигших УВО, сохраняется риск декомпенсации заболевания печени и развития ГЦК. При моделировании мы исходили из того, что у больных легким и среднетяжелым ХГС наличие УВО указывает на излечение, т. е. у больных, достигших УВО, отсутствует риск развития серьезных осложнений HCV-инфекции. Результаты небольшого числа исследований свидетельствуют о том, что у больных среднетяжелым ХГС может развиться ГЦК, даже если они ответили на противовирусную терапию [26, 27]. Однако данные некоторых исследований показали, что вероятность такого перехода близка к 0. Учитывая недостаток информации и незначительную вероятность такого перехода, мы не включили ее в нашу модель.
Наше исследование имеет некоторые ограничения, связанные со структурными допущениями и вводимыми показателями. Во-первых, оно не включает лечение ВИЧ-инфицированных больных ХГС, хотя у них выше риск развития серьезного заболевания печени. Мы не включали таких больных в связи с отсутствием данных о влиянии терапии на отдаленные исходы HCV-инфекции. Эффективность затрат на лечение боцепревиром у ВИЧ-инфицированных больных ХГС с HCV генотипа 1 может быть изучена в будущем после завершения соответствующих клинических исследований. Во-вторых, мы предполагали, что противовирусная терапия бесполезна у больных, не достигших УВО [28, 29]. Мы не изучали возможности замедления прогрессирования болезни у пациентов, не ответивших на противовирусную терапию, по сравнению с пациентами, не получавшими лечения. В-третьих, мы не учитывали возможности повторного лечения противовирусными препаратами, которые имеются сегодня или могут появиться в ближайшем будущем. Сроки повторного лечения больных, получавших двойную противовирусную терапию в исследовании SPRINT-2, можно оценить на основании исследования RESPOND-2, в которое включали пациентов, не ответивших на предыдущую терапию. Однако эффективность повторного лечения у больных, не ответивших на одну из схем противовирусной терапии с боцепревиром, неизвестна. В-четвертых, чтобы оценить роль боцепревира в лечении HCV-инфекции в клинической практике, мы включили в модель схемы противовирусной терапии, рекомендуемые в инструкции по применению боцепревира. Однако эти стратегии отличаются от схем лечения в клинических исследованиях. В связи с этим показатели, связанные с лечением, оценивали на основании анализа post hoc данных, полученных в исследованиях SPRINT-2 и RESPOND-2. Хорошо известно, что анализ post hoc имеет определенные ограничения. Все характеристики лечения основывались только на данных клинических исследований, хотя частота досрочного прекращения противовирусной терапии, которая оказывает влияние на ее эффективность, может отличаться в клинической практике. В-пятых, в российской популяции отсутствуют данные, необходимые для оценки качества жизни, поэтому мы пользовались данными литературы. И наконец, анализ проводился с позиции плательщика. У больных ХГС или последствиями цирроза снижаются трудоспособность, производительность и активность и увеличиваются непрямые медицинские затраты по сравнению с таковыми у людей, не инфицированных HCV [30–32]. Включение таких затрат в анализ привело бы к снижению значений ICER (боцепревир по сравнению с двойной терапией), так как противовирусная терапия с боцепревиром по эффективности превосходит ПР48.
Чтобы учесть эти ограничения, мы провели анализ чувствительности, который показал, что эффективность затрат на терапию с боцепревиром сохраняется даже при значительном изменении всех показателей, использованных при моделировании.
Таким образом, противовирусная терапия с боцепревиром приводит к снижению частоты развития печеночных осложнений, в том числе декомпенсированного цирроза, ГЦК, смерти от заболевания печени и трансплантации печени у первичных больных, инфицированных HCV генотипа 1. Наша модель также показала, что применение боцепревира позволяет добиться более выраженного клинического эффекта при сокращении длительности противовирусной терапии, которое может ограничить ее негативное влияние на качество жизни. С позиции плательщика противовирусная терапия с боцепревиром, подобранная с учетом вирусологического ответа, и фиксированная по длительности тройная противовирусная терапия (боцепревир/ПР48) характеризовались эффективностью затрат по сравнению с терапией ПегИФН и РБВ при обоснованном предельном значении ICER.


